功能磁共振用于肿瘤光热和光动力协同治疗的实时监测研究
曹健波,付贵峰,张帆,刘刚
(厦门大学公共卫生学院分子影像暨转化医学研究中心,福建厦门 361102)
0 引言
纳米医学的飞速发展为医学的进步提供了全新的机遇,尤其在恶性肿瘤的光热(photothermal therapy,PTT)和光动力(photodynamic therapy,PDT)治疗方面,越来越多具有治疗功能的纳米复合物受到研究者重视.因其安全有效性,光热和光动力治疗逐渐成为继手术、放疗、化疗及生物疗法后肿瘤治疗的又一有效手段.随着研究的不断进展,越来越多的功能化纳米材料进入人们的视野,如金纳米粒子[1],碳纳米管[2-4],石墨烯等[5-7],且均表现出良好的生物相容性和初步治疗效果.与此同时,建立一种有效的无创性疗效长期监测及肿瘤预后评价体系,就成为了亟待解决的问题,也是医学影像工作者面临的新挑战.磁共振成像因其较好的组织分辨率,一直在医学影像中发挥着重要作用,尤其是功能磁共振的发展,使其不仅局限于对组织结构的反映,更可反映体内一系列的功能代谢变化.DWI是目前唯一可反映或体内水分子扩散的成像方式,肿瘤细胞因代谢或功能障碍或凋亡坏死后,水分子扩散运动受到影响,导致其表观扩散系数发生变化,故DWI可作为反映肿瘤光热和光动力治疗后疗效监测的有效手段[8-9].该评价体系的建立,将为纳米材料的设计、制备及功能化研究提供有力支撑,并在其临床推进方面发挥重要指导作用.
1 材料与方法
1.1 纳米材料
实验选取聚乙二醇修饰的氧化石墨烯复合物装载二氢卟吩e6(G0-PEG-Ce6)作为光热和光动力治疗的纳米材料,该材料由苏州大学杨凯老师课题组馈赠.该复合材料中聚乙二醇(PEG)修饰的氧化石墨烯(nano-graphene oxide,nGO)和还原石墨烯(RGO)[1-3]具有很强的近红外吸收,在肿瘤的光热治疗方面展现出了优势,同时由于石墨烯为单层碳原子结构,具有较大的表面积,故可作为光动力治疗中光敏剂的优良载体[4].二氢卟吩e6(chlorin e6,Ce6)为叶绿素衍生物,可从植物中大量获得,化学结构稳定,在630~700nm波长范围内有很强的红外吸收.实验中利用石墨烯装载二氢卟吩e6,表现出良好的光热和光动力效应.
1.2 材料细胞毒性及体外治疗效果实验
实验选取4T1细胞株,来自中国科学院细胞库.纳米材料的细胞毒性试验采用MTT实验进行验证.取对数期细胞,胰酶常规消化后制成细胞悬液,均匀加入96孔板,每孔体积为100μL,细胞数量为5 000~10 000.培养24 h后,分别加入浓度为6.25、12.5、25、50、100、200μg·mL-1的GO -PEG -Ce6,继续培养24 h.24 h后每孔加入5 mg·L-1的MTT溶液20μL,继续孵育4 h后弃去上清液,每孔加入100μL二甲基亚砜(DMSO),震荡10 min,用酶标仪检测其在490 nm处的吸光度(OD)值.细胞存活率计算公式如下:细胞存活率=实验组光密度值/空白组光密度值×100% .试验中每孔设置五个复孔,计算结果取平均值.
体外光热和光动力治疗效果也由MTT实验验证,细胞分入96孔板以后,待其贴壁,加入5μmol(以Ce6计)的GO-PEG-Ce6共培养,培养不同时间(0.5、1、2、4 h)后,分别接受不同处理:① 光热治疗,808 nm激光照射10 min,激光强度为0.3 W·cm-2;②光动力治疗,630 nm激光照射5 min,激光强度为0.05 W·cm-2;③ 光热光动力协同治疗,先用0.3 W·cm-2强度的808 nm激光照射10 min后,改用0.05 W·cm-2的630 nm激光照射5 min.再加入MTT溶液,4 h后弃去上清,每孔加入100μL DMSO,震荡10 min,用酶标仪检测其在490 nm处的OD值,计算出不同组的细胞存活率.
1.3 实验动物模型及光热和光动力治疗
30只雌性Balb/C小鼠,16~18 g,购自上海斯莱克实验动物有限公司.动物清洁饲养一周后,于右臀部种植皮下肿瘤.对数期4T1细胞消化后重悬,每只动物注射细胞数约为5×106,注射细胞悬液体积为100μL,两周后,使用磁共振观察每只动物的肿瘤生长情况,选取形状大小相似的20只,随机分为四组,分别为PBS对照组、单纯光热治疗组、单纯光动力治疗组和光热光动力协同治疗组.
实验组动物尾静脉注射GO-PEG-Ce 6 200μL,对照组注射PBS.24 h后分别对四组动物进行光热和光动力治疗.①光热治疗,808 nm激光照射10 min,激光强度为1 W·cm-2;②光动力治疗,630 nm激光照射5 min,激光强度为0.2 W·cm-2;③光热光动力协同治疗,先用1 W·cm-2强度的808 nm激光照射10 min后,改用0.2 W·cm-2的630 nm激光照射5 min.治疗时使用10%(体积分数)水合氯醛麻醉动物,注射剂量为4μL·g-1,并适当固定,保证整个肿瘤区域均暴露在激光照射范围内.
1.4 治疗效果MRI监测
MRI实验选取注射材料前,治疗后1、3、7、14 d 5个时间点进行扫描.扫描时使用异氟烷和氧气混合气体进行持续气体麻醉,并使用呼吸监控装置实时监测动物呼吸状态.所有扫描均使用9.4T磁共振成像仪(Bruker 94/20 USR,Germany),使用内径为4 cm的小鼠专用体线圈(RF 1H 75/40,Bruker,Germany).MRI扫描参数如下:
1)快速自选回波T2加权像(TurboRARE),TR/TE=2 500/33 ms,矩阵256×256,层厚1.0 mm,层间距1.0 mm,视野大小(field of view,FOV)=40 mm×40 mm.
2)自选回波扩散加权成像序列(SE-DWI),B值选取800 s·mm-2,TR/TE=3 000/27 ms,矩阵256×256,层厚1.0 mm,层间距1.0 mm,FOV=40 mm ×40 mm.
1.5 组织学染色
动物持续观察结束后处死.取下主要器官和肿瘤组织使用4%(质量分数)多聚甲醛固定,进行苏木精—伊红染色(hematoxylin-eosin staining).另取肿瘤组织,使用冰冻切片包埋剂包埋,低温冷冻后,进行冰冻切片,使用血小板内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1,PECAM-1/CD31)对其血管分布情况进行染色.切片与一抗(CD31抗体)室温孵育1 h后加入二抗,二抗为荧光素Cy3标记的羊抗兔IgG(immunoglobulin G)抗体.细胞膜着红色者为阳性,无着色者为阴性.使用荧光显微镜观察其血管分布情况.
2 结果与讨论
2.1 纳米材细胞毒性及体外光热和光动力治疗效果测定
如图1(a)所示,纳米材料细胞毒性实验MTT实验结果显示GO-PEG-Ce6无明显细胞毒性.实验分别使用了6.25、12.5、25、50、100、200μg·mL-1等浓度的纳米材料处理细胞24 h后,相对细胞活性均处在80%以上,其中浓度最大的200μg·mL-1处理细胞后,细胞相对活性也达到84%,表明该纳米材料没有明显的毒性,具有良好的生物相容性,可将其用于生物体内成像.
体外光热和光动力治疗效果如图1(b)所示.随着孵育时间延长,治疗后细胞存活率逐渐降低,证明细胞杀伤效果是由于细胞吸收GO-PEG-Ce6后经过治疗所致,并非由于游离的纳米材料自身毒性.孵育4 h后,单纯光热治疗组相对细胞活性为40%,单纯光动力治疗为30%,而光热和光动力协同治疗组中,细胞存活率为20%,证明该材料有良好的体外光热和光动力治疗效果.
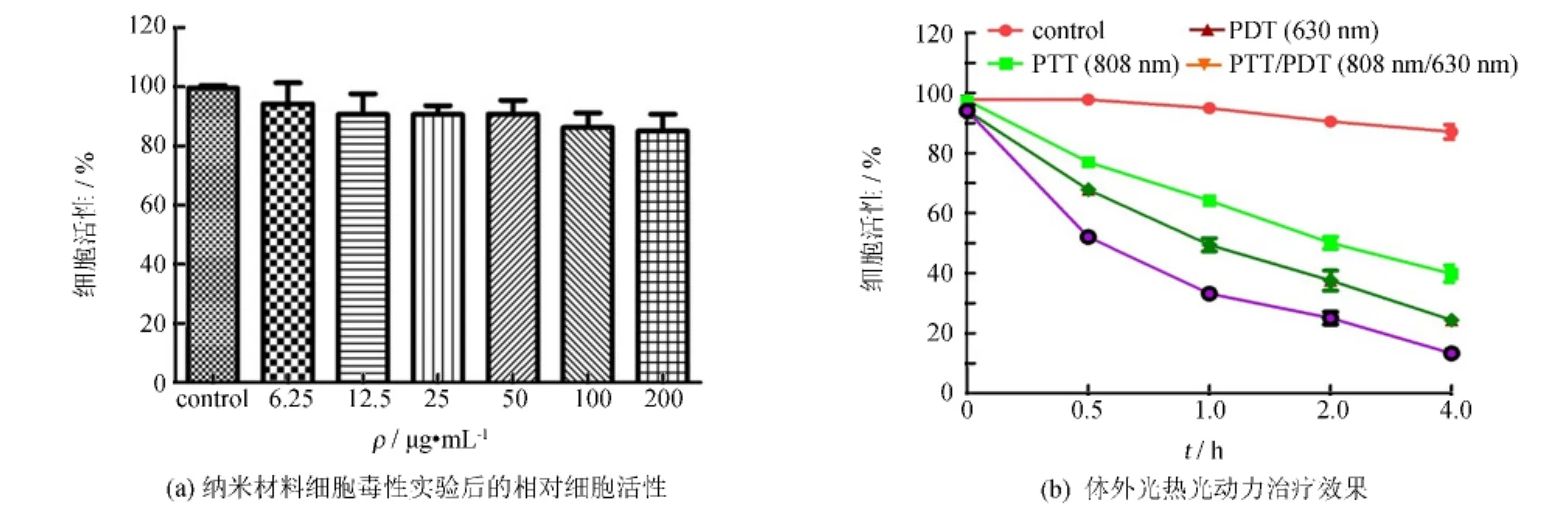
图1 细胞毒性及体外治疗效果评价Fig.1 Cell toxicity tests and photothermal therapeutic effect
2.2 实验动物光热和光动力治疗
图2(a)为T2加权图像,反映了不同组肿瘤体积变化.图2(b)为不同组ADC图.ADC(apparent diffusion coefficient,ADC)又称表观扩散系数,是DWI成像后得到的重要参数,可反映体内水分子的扩散运动.肿瘤细胞凋亡后,水分子扩散受到影响,导致ADC值上升.PBS对照组同时进行了光热和光动力治疗.光热治疗时,动物肿瘤处体表温度由34℃上升至44℃上下,经光动力治疗后不同时间点使用MRI观察,分别统计其肿瘤大小及ADC值.其中肿瘤体积明显增大,14 d后肿瘤体积已经达到初始时4~5倍大小(见图2(a)).ADC值早期无明显变化,7 d后,由于肿瘤体积增大,自身出现细胞凋亡及坏死,ADC值有一定上升.实验组动物注射GO-PEG-Ce6后24 h进行光热和光动力治疗,光热治疗时,肿瘤处体表温度可上升至48~49℃,可达到杀灭肿瘤的目的.光动力治疗后选取不同时间点进行MRI观察,分别统计肿瘤大小和ADC值变化.其中单纯光热治疗后细胞体积明显变小,激光直接照射的表皮处表现最为明显,而肿瘤细胞的凋亡和坏死也由此部分开始,而由于深部肿瘤细胞并未完全被杀死,长期观察后肿瘤体积又有逐渐增大的趋势.单纯光动力治疗后肿瘤体积无明显变化,治疗后3 d,细胞有明显凋亡和坏死,而由于未能完全杀灭肿瘤,故14 d后,残余肿瘤细胞开始生长,肿瘤体积变大.光热和光动力系协同治疗后,肿瘤杀伤效果明显,3 d后肿瘤体积仅有很小残余,ADC图像也显示细胞凋亡明显,经长期观察后,肿瘤并未复发,完全杀死了肿瘤细胞.
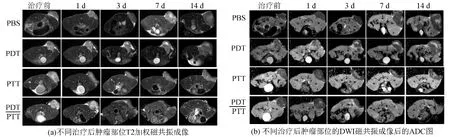
图2 活体磁共振成像Fig.2 In vivo MRI representative T2WI ADC - map and MRI evaluating tumor response after PTT
2.3 磁共振数据定量分析
图3(a)为T2加权成像反映的肿瘤体积变化.其相对肿瘤体积(relative tumor volume)为不同观察时间点的肿瘤体积与初始肿瘤体积的比值.其中PBS组中无治疗效果,观察过程中肿瘤体积逐渐增大,至观察结束时,已达到初始体积的4~5倍.光动力治疗组中3 d时肿瘤体积略有减小,随后又开始增大.光热治疗组中7 d内肿瘤体积持续减小,但并未完全杀死肿瘤,14 d时肿瘤体积已有增大趋势.联合治疗组中肿瘤体积在3 d时几乎完全消失,此后亦无复发.图3(b)为ADC值的变化,其中联合治疗组中ADC值从1 d起,显著上升,3 d后,由于肿瘤几乎完全消失,无法准确测量ADC值.而光动力治疗组和光热治疗组中,3 d时ADC值均有明显上升,表明其治疗产生了一定的细胞杀伤作用,此后随着肿瘤体积的增大,肿瘤内部自发性地开始出现坏死等,其ADC值逐渐上升.PBS组中,随着体积增大,ADC值逐渐升高.
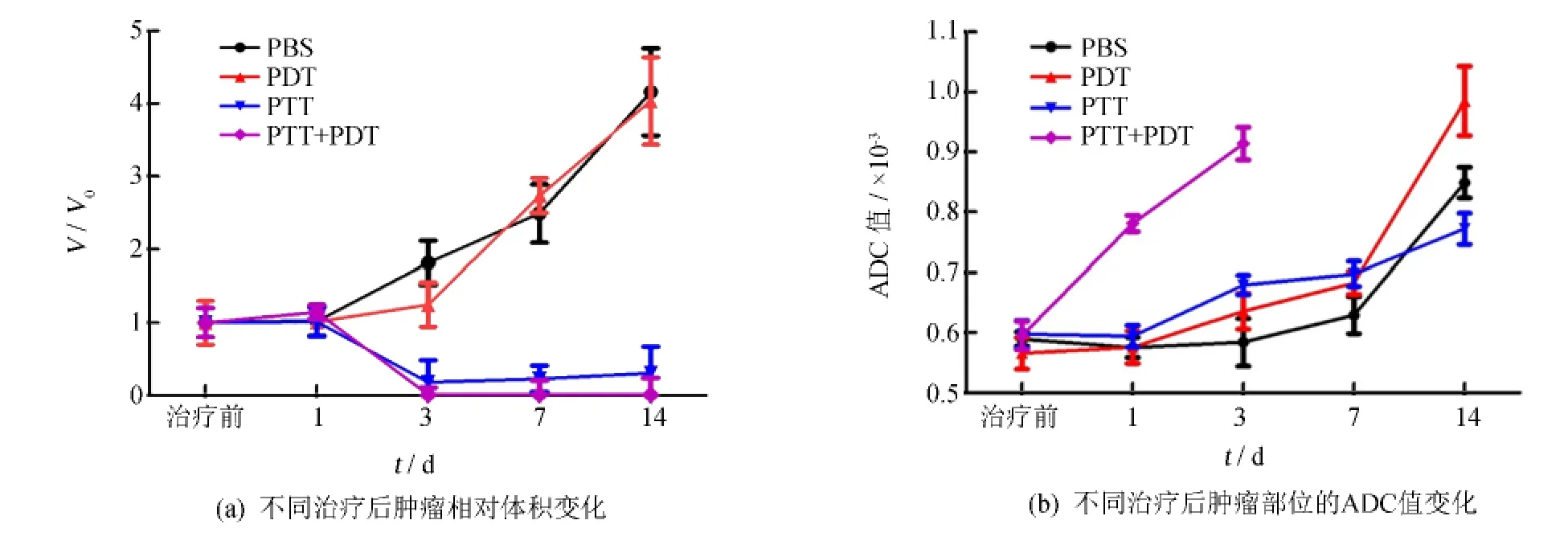
图3 不同治疗方法的磁共振数据分析Fig.3 Effect of different treatment on the tumor
经HE染色和CD31染色后,显微镜观察拍照,如图4所示,分析结果.PBS对照组中HE染色显示细胞结构完整,极少凋亡和坏死,CD31染色显示组织血管丰富且完整.实验组中,HE染色可看到大面积的细胞凋亡及坏死,而由于激光穿透深度有限,故光热治疗组中,直接接受激光照射的表面坏死较为严重,CD31染色也表明其血管主要集中在激光未直接照射的组织处.单纯光动力治疗中,未出现明显的正常组织和破坏组织的分界,但也表现出部分损伤.光热和光动力协同治疗组中,杀伤效果最明显,几乎无正常组织表现,也看不到完整的血管.
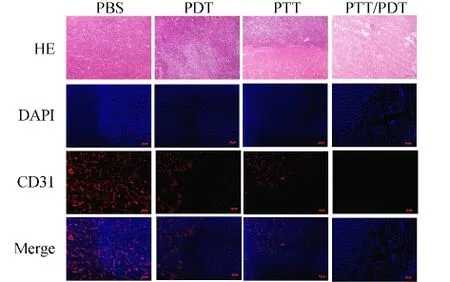
图4 不同治疗后肿瘤的HE染色和CD31染色Fig.4 HE stained images and CD31 stained images of different treatment
光热和光动力治疗后,肿瘤细胞可出现缺血、坏死或其他乏氧病理变化[13],水分子扩散运动增强,ADC值升高.实验单纯光热和光动力两组中,ADC值在治疗后1 d均有短暂升高,此后又下降,ADC图上也有部分区域始信号始终没有升高,该部分肿瘤并未完全杀死,经一段时间后,肿瘤复发.而光热和光动力协同治疗组在治疗后,ADC值显著上升,ADC图上整个肿瘤区域均表现为高信号,表明肿瘤细胞杀灭较为彻底,同时解剖图像上可看到3 d后肿瘤体积急剧减小,14 d后无复发.表明ADC是灵敏且有效的肿瘤预后标志,结合肿瘤体积变化,可较好的反映光热和光动力治疗效果.
3 结语
目前,新型纳米材料的研究均停留在临床前阶段,虽然在实验动物中均表现出良好的效果和临床潜力,但要应用到临床研究中,还有许多问题要解决,如纳米材料靶向性研究、基于纳米粒子的原位肿瘤原位微创治疗研究、影像学引导的精确治疗研究、无创实时的疗效评价体系等.实验使用磁共振成像方法对肿瘤治疗效果进行了评价和预测,希望可以为影像学评价体系的建立打开新的思路.同时,若能解决肿瘤光热光动力治疗时的实时温度监测及实时组织含氧量等的监测问题,将为医学纳米材料的发展提供重要的指导意义,同时也可为有临床应用潜力的纳米粒子的进一步研究提供指导.
通过实验,证实了扩散加权磁共振成像可较好地反映光热和光动力治疗效果,并对长期疗效做出预测,可在指导纳米粒子合成和临床应用方面发挥重要作用.
[1]Xia Younan,Li Weiyang,Cobley C M,et al.Gold nanocages:from synthesis to theranostic applications[J].Accounts of Chemical Research,2011,44(10):914-924.
[2]Kam N W S,O’Connell M,Wisdom JA,et al.Carbon nanotubes as multifunctional biological transporters and near-infrared agents for selective cancer cell destruction[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(33):11 600-11 604.
[3]De La Zerda A,Zavaleta C,Keren S,et al.Carbon nanotubes as photoacoustic molecular imaging agents in living mice[J].Nature Nanotechnology,2008,3(9):557-562.
[4]Liu Zhuang,Tabakman S,Welsher K,et al.Carbon nanotubes in biology and medicine:in vitro and in vivo detection,imaging and drug delivery[J].Nano Research,2009,2(2):85 -120.
[5]He Shijiang,Song Bo,Li Di,et al.A graphene nanoprobe for rapid,sensitive,and multicolor fluorescent DNA analysis[J].Advanced Functional Materials,2010,20(3):453-459.
[6]Jung JH,Cheon D S,Liu F,et al.A graphene oxide based immuno-biosensor for pathogen detection[J].Angewandte Chemie International Edition,2010,49(33):5 708-5 711.
[7]Yang K,Zhang S,Zhang G,et al.Graphene in mice:ultrahigh in vivo tumor uptake and efficient photothermal therapy[J].Nano Letters,2010,10(9):3 318 -3 323.
[8]Frankel T L,Gian R K,Jarnagin W R.Preoperative imaging for hepatic resection of colorectal cancer metastasis[J].Journal of Gastrointestinal Oncology,2012,3(1):11-18.
[9]Heusner T A,Kuemmel S,Koeninger A,et al.Diagnostic value of diffusion-weighted magnetic resonance imaging(DWI)compared to FDGPET/CT for whole - body breast cancer staging[J].European Journal of Nuclear Medicine and Molecular Imaging,2010,37(6):1 077-1 086.
[10]Yang Kai,Wan Jianmei,Zhang Shuai,et al.The influence of surface chemistry and size of nanoscale graphene oxide on photothermal therapy of cancer using ultra-low laser power[J].Biomaterials,2012,33(7):2 206 -2 214.
[11]Robinson JT,Tabakman SM,Liang Y,et al.Ultrasmall reduced graphene oxide with high near-infrared absorbance for photothermal therapy[J].Journal of the American Chemical Society,2011,133(17):6 825 -6 831.
[12]Cai CJ,Xu M W,Bao SJ,et al.A green and facile route for constructing flower- shaped TiO2nanocrystals assembled on graphene oxide sheets for enhanced photocatalytic activity[J].Nanotechnology,2013,24(27):275 602.
[13]Green H N,Crockett SD,Martyshkin DV,et al.A histological evaluation and in vivo assessment of intratumoral near infrared photothermal nanotherapy-induced tumor regression[J].International Journal of Nanomedicine,2014,9(1):5 093 -5 102.

