肥大细胞在IgA 肾病中的表达及致病机制
王思远 严 苗 苏 可 陈 铖
IgA 肾病( IgA nephropathy,IgAN) 为临床常见的一种肾脏疾病,15% ~40%患者最终进展至终末期肾衰竭[1]。小管间质病变是影响IgAN 进展和预后的重要因素之一[2]。目前已有文献报道IgAN 患者肾间质存在肥大细胞浸润,且肥大细胞数量与肾纤维化程度存在正相关关系[3]。但亦有报道发现,肥大细胞可以通过调节炎性细胞浸润并抑制去分化减轻肾脏纤维化[4]。本研究通过分析肥大细胞在IgAN 及其合并肾功能不全患者肾组织中的表达,并对其作用机制进行探讨。
材料与方法
1.病例选取:肾脏标本来源包括:外伤或肾肿瘤肾切除患者的正常肾组织12 例( 正常组) ,IgAN 患者20 例( IgAN 组)及IgAN 合并肾功能不全( 血Cr 值<200μmol/L) 患者8 例( IgARI 组) 。IgAN 组及IgARI 组标本来源于根据临床指征进行的肾活检术。对所有肾组织所进行的处理和使用均遵循国家伦理准则。诊断由肾脏病理医师根据班夫分类系统完成。
2.肾组织肥大细胞染色和计数:4%甲醛溶液固定,石蜡包埋,切片后用0.1%甲苯胺蓝染色。肥大细胞的计数由两名研究者分别独立完成,并记录为“计数/平方毫米”。
3.细胞的培养: 人肥大细胞系( HMC -1) 购买自青岛博康生物技术有限公司,细胞完全培养基为含有10%胎牛血清( 美国Gibco 公司) ,50μmol/L 1 -硫代甘油( 美国Sigma 公司,M6145) 的IMDM 培养基( 美国Gibco 公司) ,在37℃,5%CO2条件下进行培养。体外培养的肥大细胞分为3 组: 正常组,IL-6 刺激组(10ng/ml 美国Peprotech 公司) 及TNF -α 刺激组(20ng/ml 美国Gemini Bio-products 公司) 。HMC-1 细胞以2 ×105/ml 的密度在无血清培养基中培养6h 后添加相应刺激,分别在4、8 及24h 3 个时间点收集细胞,并在24h 收集无刺激因素肥大细胞设为正常对照组。
4.实时定量PCR 检测肾素mRNA 表达:Trizol 法提取HMC-1 细胞总RNA,分离出的RNA 样品通过Nanodrop 检测RNA 的纯度及含量,ExScriptTMRT 试剂盒合成cDNA 后,采用Taqman 探针技术进行实时定量PCR。肾素探针来源美国life technology 公司,商品号Hs00982555_m1。以GAPDH 设为内参照。
5.免疫印迹法检测肾素蛋白表达: 用含有Cocktail( 美国Sigma-Aldrich 公司) 的细胞裂解液(0.5%脱氧胆酸钠,0.1%十二烷基硫酸钠,1%Triton X -100,1mmol/L 苯甲磺酰氟,150mmol/L NaCl,20mmol/L Tris,pH 7.5,5mmol/L 依地酸) 裂解细胞,13000 ×g 4℃离心,取上清,BCA 法测定蛋白浓度,取等量蛋白12%SDS -PAGE 凝胶电泳,转膜至硝酸纤维素膜( 美国GE Heathcare 公司) ,一抗分别为肾素兔来源多克隆抗体(1∶200,美国Santa Cruz 公司) ,辣根过氧化物酶标记的二抗(1∶10000,美国CST 公司) ,ECL( 美国Santa Cruz 公司) 反应,Geldoc( 美国Biorad 公司) 扫描硝酸纤维素膜,之后采用蛋白剥离缓冲液孵育硝酸纤维素膜30min,常规封闭液封闭后,与GAPDH 小鼠单克隆抗体(1∶20000,美国Santa Cruz 公司)常温孵育2h,相应二抗反应后再次显现扫描,应用Gel -Pro Analyzer 4.5 软件进行积分吸光度( A) 分析。
结 果
1.人肾组织肥大细胞染色计数: IgAN 组( 1.890±0.578 个/平方毫米) 及IgANRI 组( 5.450 ±1.435个/平方毫米) 较正常组( 0.230 ±0.187 个/平方毫米) 肥大细胞均增高( P =0.000) ,IgANRI 组较IgAN组肥大细胞数亦增高( P =0.000) 。肥大细胞主要分布于肾间质,特别是纤维化区域。血管球区域及小管管腔未见肥大细胞。肥大细胞计数与小管萎缩、间质纤维化、球性肾小球硬化存在相关关系( 图1) 。
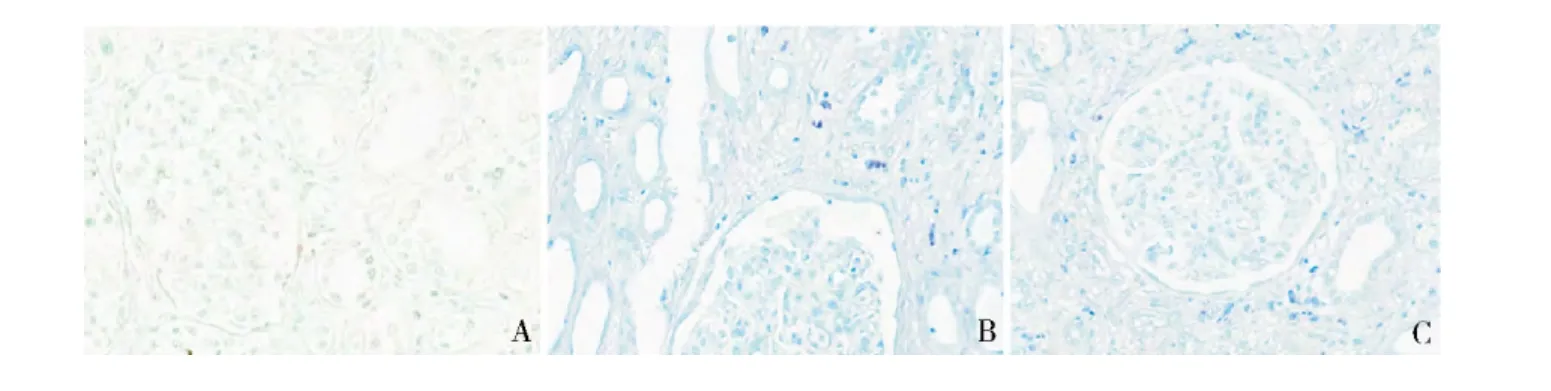
图1 人肾组织肥大细胞计数( 甲苯胺蓝染色,×400)
2.肾素的定量:正常培养的肥大细胞即可产生肾素mRNA 及蛋白,IL -6 刺激组及TNF -α 刺激组肾素的表达较正常组肾素的表达明显增多,并呈时间依赖性升高( P <0.05,图2) 。
讨 论
IgAN 好发于青少年,男性多见,以肾小球系膜基质与系膜细胞增殖和( 或) 单核细胞浸润为特点,包括4 项主要病理指标:系膜细胞增生、内皮细胞增生、节段性硬化或粘连及肾小管萎缩或肾间质纤维化。近年的研究证实,系膜细胞分泌炎性因子、活化补体在导致IgA 肾病的病理改变和临床症状中起重要作用[5]。但其具体的发病机制尚未完全阐明,积极寻找IgAN 致病因素及探讨可能的干预因素对指导临床治疗有重要意义。
在IgAN 中,肾小管间质病变较小球病变与疾病的进展联系更加紧密[6,7]。研究发现小管间质浸润的肥大细胞数量可能是判断IgAN 预后的指标之一[3]。并且肥大细胞可通过多种机制参与肾纤维化的过程[8],如:肥大细胞分泌的TGF-β1 已被证实可通过诱导上皮细胞去分化从而促进纤维化的发生[9]。但亦有研究表明,肥大细胞缺陷小鼠肾脏α-SMA表达较野生型小鼠明显增加,提示肥大细胞抑制肾脏的纤维化[4,6]。本研究收集临床肾活检标本,发现IgAN 及IgAN 肾功能不全患者肾间质存在肥大细胞浸润,且肥大细胞的数量与小管萎缩、间质纤维化、球性肾小球硬化等存在相关关系。提示干预肥大细胞浸润至肾组织可能延缓IgAN 患者疾病的进展,减缓肾功能减退。

图2 肥大细胞肾素的定量
肾素-血管紧张素系统( RAS 系统) 尤其是局部RAS 系统的激活在慢性肾脏损伤中发挥重要作用[10]。有报道发现,IgAN 中,肾间质浸润的肥大细胞在血管紧张素Ⅱ阳性细胞团周围聚集,血管紧张素Ⅱ阳性细胞计数与肥大细胞计数呈相关关系,并同时发现,肥大细胞本身并不能表达血管紧张素Ⅱ[11]。提示肥大细胞与局部RAS 激活存在一定联系。最近研究发现,缺血再灌注损伤中,心肌肥大细胞分泌肾素,激活RAS 系统,从而引起心率失常的发生[12,13]。本研究通过体外培养肥大细胞,采用实时定量PCR及免疫印迹两种方法证实,肥大细胞可表达肾素基因及蛋白,可参与局部RAS 系统的激活。并且,在炎性因子IL-6 和TNF -α 刺激下,肥大细胞肾素mRNA及蛋白的表达呈时间梯度增加。提示IgA 肾病中,系膜细胞分泌的炎性因子可通过增加肥大细胞肾素的表达,加重病理改变。对IgAN 的发病机制进行了进一步的阐明。
综上所述,肥大细胞在IgAN 的疾病进展中起促进作用。其中,系膜细胞分泌炎性因子刺激肥大细胞表达肾素,激活RAS 系统,导致进一步的病理改变和临床症状。减轻炎性反应、干预肥大细胞浸润至肾组织及调节局部肾素表达可能是IgAN 患者治疗的新靶标。
1 1 Berthoux F,Mohey H,Laurent B,et al.Predicting the risk for dialysis or death in IgA nephropathy[J]. J Am Soc Nephrol,2011,22(4) : 752 -761
2 Liu J,Yang JR,He YN,et al.Accelerated senescence of renal tubular epithelial cells is associated with disease progression of patients with immunoglobulin A ( IgA) nephropathy[J]. Transl Res,2012,159(6) :454 -463
3 Silva GE,Costa RS,Ravinal RC. et al. Renal macrophage infiltration is associated with a poor outcome in IgA nephropathy[J]. Clinics( Sao Paulo) ,2012,67(7) : 697 -703
4 Kim DH,Moon SO,Jung YJ,et al. Mast cells decrease renal fibrosis in unilateral ureteral obstruction[J]. Kidney Int,2009,75( 10) :1031 -1038
5 Lai KN,Leung JC,Chan LY,et al.Activation of podocytes by mesangial - derived TNF - alpha: glomerulo - podocytic communication in IgA nephropathy[J]. Am J Physiol Renal Physiol,2008,294( 4) :945 -955
6 Tomino Y.Predictors of prognosis in IgA nephropathy[J]. Kaohsiung J Med Sci,2012,28(10) :517 -520
7 Lin Q,Chen Y,Lv J,et al. Kidney injury molecule -1 expression in IgA nephropathy and its correlation with hypoxia and tubulointerstitial inflammation[J]. Am J Physiol Renal Physiol,2014,306( 8) :885 -895
8 Blank U,Essig M,Scandiuzzi L,et al. Mast cells and inflammatory kidney disease[J]. Immunol Rev,2007,217: 79 -95
9 Park SH,Choi MJ,Song IK,et al. Erythropoietin decreases renal fibrosis in mice with ureteral obstruction: role of inhibiting TGF -beta-induced epithelial-to -mesenchymal transition[J].J Am Soc Nephrol,2007,8(5) : 1497 -1507
10 Ferrao FM,Lara LS,owe J.Renin-angiotensin system in the kidney:What is new? [J]. World J Nephrol,2014,3(3) : 64 -76
11 Aldi S,Takano K,Tomita K,et al. Histamine H4 - receptors inhibit mast cell renin release in ischemia/reperfusion via protein kinase C epsilon-dependent aldehyde dehydrogenase type-2 activation[J]. J Pharmacol Exp Ther,2014,349(3) : 508 -517
12 Aldi S,Marino A,Tomita K,et al. E - NTPDase1/CD39 modulates renin release from heart mast cells during ischemia/reperfusion: a novel cardioprotective role[J]. FASEB J,2014 ( Epub ahead of print)
13 Sakamoto-Ihara T,Suzuki Y,Kurusu A,et al. Possible involvement of mast cells in renal fibrosis in patients with IgA nephropathy[J]. Inflamm Res,2007,56(10) : 421 -427

