胃肠道间质瘤的超声征象与病理危险度相关性分析
吴 俊 赵志军 赵改萍 胡玉藏 侯晓东
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是1983 年由Mazur 等首次提出的起源于胃肠道Cajal 细胞的间叶源性肿瘤,特征性地表达CD117和(或)CD34 阳性,是潜在恶性病变,其恶性程度是根据肿瘤直径以及有丝分裂(MI)来评估的[1,2]。其临床症状出现较晚且无特异性,临床早期诊断较为困难,随着超声影像学检查的不断普及,GIST 的检出率明显提高。现将笔者医院经手术、病理和免疫组化证实的48 例GIST 的超声检查结果进行回顾性分析,探讨GIST 的超声特征与病理危险度的相关性,以提高超声对本病诊断的准确率。
资料与方法
1.一般资料:回顾性分析笔者医院2011 年10 月~2014年11 月经内镜活检、手术和病理免疫组化证实的GIST 患者48 例,其中,男性26 例,女性22 例,患者年龄34 ~82 岁,平均年龄55.4 ±23.6 岁。临床症状主要包括上腹部胀痛、腹胀、贫血、黑便、腹部包块和不全肠梗阻等。病例的纳入标准:有完整的超声检查资料,有内镜检查或手术结果和病理免疫组化结果的患者;超声资料不完整或有完整的超声检查资料而无内镜检查或无手术结果和病理免疫组化结果的患者不纳入本组的统计。本组GIST 良恶性区分依据美国国立卫生研究院原发GIST 危险度分级方案(2008 版),将GIST 分为极低、低、中和高危险度4 级[3]。
2.仪器与方法:应用Philips HD11XE 和GE 730 EXPERT彩色多普勒超声诊断仪,腹部探头,频率(3.5 ~5.5)MHz,必要时使用高频探头。患者禁饮食8 ~12h,先常规扫查肝胆胰脾肾,然后依据病变部位扫查胃、小肠、结肠。胃十二指肠检查:口服准备好的速溶胃肠超声助显剂500 ~600m1,根据患者胖瘦情况用量酌情增减,然后开始检查。体位以平卧位、左侧卧位、右侧卧位,必要时坐位,并配合呼吸。对贲门、胃底、胃体、胃窦和十二指肠作系统观察,在长轴、短轴各个切面上仔细观察观察胃、十二指肠壁及其周围有无异常病灶,胃壁的蠕动等;空肠和回肠的检查(空腹直接检查)以脐周为中心,做纵、横、斜多切面扫查,结肠(空腹、必要时灌肠后检查)沿走行进行扫查,观察肿瘤的部位、大小、形态、与相邻脏器的关系、回声特征,并应用彩色多普勒技术观察肿瘤的血流分布及频谱特征。发现病灶后测量记录并采集图像保存于工作站中。
3.统计学方法:采用SPSS 17.0 统计学数据处理软件,将胃肠道间质瘤的超声征象包括生长部位、大小、形态、生长方式、回声分布、血流情况、钙化、坏死液化和转移情况等,与其生物学危险度分级进行对照比较,进行卡方χ2检验,以P <0.05 为差异有统计学意义。
结 果
本组48 例胃肠道间质瘤患者均为单发。肿瘤位于胃部32 例:胃底9 例,胃体13 例,胃窦10 例;小肠11 例:十二指肠1 例,空肠6 例,回肠4 例;结肠5 例:横结肠2 例、降结肠1 例和乙状结肠2 例。本组GIST极低危险度12 例,低危险度16 例,中危险度11 例,高危险度9 例。极低和低危险度者GIST 直径为0.6 ~5.6cm;中危险度者GIST 直径为3.6 ~4.1cm;高危险度者GIST 直径为2.8 ~10.8cm。超声检出胃部最小的GIST 直径约0.6cm,小肠和结肠GIST 直径均≥1.5cm。32 例胃部间质瘤中,9 例实行了内镜下切除术,切除肿瘤直径为0.6 ~3.0cm,另1 例直径为3.5cm 的间质瘤内镜下切除出血较多,进行了急诊手术切除。其余胃部间质瘤及小肠和结肠间质瘤均进行了手术治疗。超声检出的48 例GIST,肿瘤位置与内镜和术中所见符合45 例,符合率为93.8%,1 例为胃底大弯侧肿瘤误认为左肾上腺肿瘤,1 例左下腹空肠肿瘤误认为乙状结肠肿瘤,1 例胃体上段小弯侧肿瘤误认为肝左叶肿瘤。
GIST 肿瘤的超声表现与病理危险度分级的相关性见表1。GIST 的高、中、低及极低危险度与肿块大小、内部回声是否均匀、是否有钙化及坏死液化和是否有转移差异有统计学意义(P <0.05),而与肿瘤发生的部位、肿块形态是否规则、生长方式、血流信号差异无统计学意义(P >0.05):病理为极低、低和中等危险度肿瘤超声大多数表现为体积较小(<5cm)(29/39,74.4%),形态规则(26/39,66.7%),内部回声均匀(9/39,23.1%)的实性低回声肿块(图1),其内及周边可探及血流信号(27/39,69.2%)(图2);病理为高度危险度肿瘤大多数体积较大(>10cm)(6/9,66.7%),形态不规则(5/9,55.6%),内部回声不均匀(6/9,66.7%),可见坏死液化(5/9,55.6%,图3)、钙化(3/9,33.3%,图4)及转移(3/9,33.3%)。
讨 论
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是消化道最常见的间叶组织源性肿瘤。由于组织分型不同,有着多种不同的组织学和形态学表现。GIST 多位于胃肠道,占所有消化道肿瘤的1% ~2%[4]。2013 年WHO 骨与软组织肿瘤学分类将GIST划分为单独的一类疾病,为软组织肿瘤分类中的第10 项[5]。此项结果得益于近年来免疫组化技术的飞速发展和分子生物学研究的重大突破。GIST 免疫表型通常表达CD117(Kit),表型向Cajal 细胞分化,大多数具有Kit 和PDGFRA 基因驱动突变,包括从良性至恶性的生物学行为谱。多年前诊断的胃平滑肌和神经源性肿瘤大多是GIST,以往诊断的平滑肌母细胞瘤和胃肠道自主神经瘤实际上也是GIST。Miettinen 等[5]在GIST 生物学行为的描述上最终达成一致意见,将GIST 描述为包括良性至恶性的肿瘤。至此,更正了以往认为GIST 均属恶性,不存在良性GIST 的不恰当说法[6]。

表1 GIST 的超声征象与病理危险度分级(n)
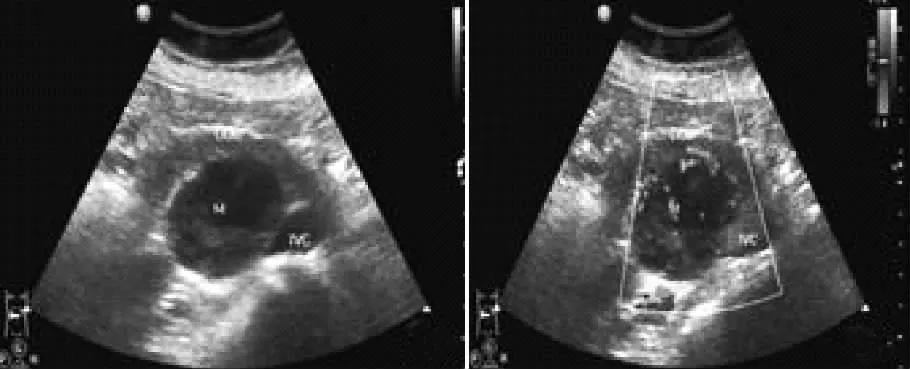
图2 十二指肠水平部间质瘤
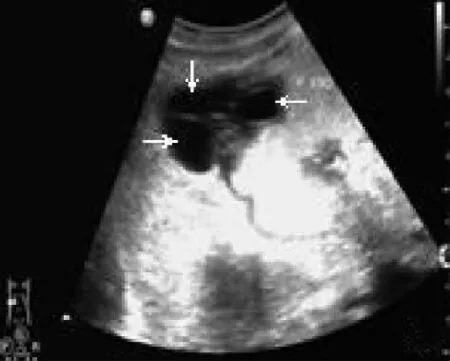
图3 胃体和胃窦小弯侧间质瘤

图4 空肠下段间质瘤
GIST 因缺乏肿瘤相关的临床症状和体征,临床对本病的早期诊断较为困难,容易误诊和漏诊。对于上消化道间质瘤,以前往往在胃镜检查时偶然发现[7]。随着超声仪器的发展和这项影像技术在胃肠道方面应用的不断成熟,超声诊断GIST 取得了初步的经验[8~10]。本研究结果显示GIST 的良恶性与肿瘤的形态、生长方式及其彩色血流的显示无明显相关性,与肿瘤直径、内部回声均匀与否、是否伴有液化坏死及转移相关。
GIST 的超声表现为,本组28 例极低和低危险度GIST,多呈圆形、椭圆形、分叶状或不规则形;起源于黏膜下,均呈低回声,周缘境界清晰,胃部GIST 多发于胃体部(8/19),直径一般<5cm,较小的肿块回声均匀。部分肿瘤黏膜面伴有溃疡凹陷,彩色多普勒显示部分病变内部血流丰富。高危险度GIST 肿块较大,肿块形态不规则,周缘不光滑,内部回声不均质,可见坏死液化区,部分伴有不规则强回声,肿块黏膜面伴较大溃疡,形态不规则,与液化区贯通,形成假腔,周围淋巴结肿大和肝转移(3/9)。GIST 的血流分布与危险度高低无明显相关性,这与张明智等[11]的报道一致。
本组48 例GIST 超声检出的最小的病例直径约0.6cm,超声能够分辨出消化道壁的各层结构,确定胃肠道黏膜下病变,特别是对较小的胃黏膜下肿瘤具有显著优势。对于直径<1. 5cm,尤其是直径<1.0cm 的胃部的GIST,在服用均匀有回声的造影剂后,超声很容易显示,但对于直径<0.6cm 的间质瘤超声显示困难;肠道由于解剖形态不规则以及受检查肠道气体和个体差异的影响,本组超声对肠道GIST的检出均≥1.5cm。本组病例定位诊断的符合率为93.8%。
超声虽能清晰地区分胃肠道壁的各层结构,对消化道黏膜下、黏膜外病变及周围结构进行观察,并可显示病变与腔壁的关系,但对瘤体内的细小钙化和较小的囊性变、较大肿瘤与周围脏器的关系及腹腔较小的转移灶的显示能力较差,对肿瘤胃肠道腔面的溃疡及溃疡内的气液平面、肿瘤旁的细小血管的显示都较差,从而削弱了超声的定性和定位能力。GIST 瘤体不大时,超声定位一般都很准确,但瘤体较大以及肿瘤与管壁相连部分较少或仅以蒂相连时,则定位困难,常误诊为其他器官来源的肿瘤,如左肾上腺肿瘤、胰腺肿瘤、肝脏肿瘤等。
本组胃底大弯侧腔外型GIST 误认为左肾上腺肿瘤,主要是该GIST 较大(9.8cm×9.6cm)且向胃外突出,突至左肾上腺区致左肾上极稍受压而误诊;左下腹空肠GIST 误认为乙状结肠肿瘤,是因为该GIST与乙状结肠粘连较重,导致超声定位错误,胃体小弯侧腔外型GIST,向胃外突出,压迫肝脏而误诊为肝脏肿瘤。因此,位于胃肠道周围的肿块,如果发现其与胃肠道管壁有少许粘连,且为中老年患者,就应该想到该肿瘤的可能。GIST 的超声与平滑肌类肿瘤、神经源性肿瘤、胃肠道癌以及淋巴瘤等有相似的表现,所以GIST 确诊主要依据病理检查和免疫组化检查。
总之,GIST 的临床表现缺乏特异性,早期诊断较为困难,容易漏诊。GIST 良恶性的超声表现有一定的特征,超声对GIST 的定性及定位的准确性均较高,尤其有利于胃部小间质瘤(<1.0cm)的检出。肿瘤的大小、内部回声、钙化、液化坏死及转移与其病理危险度高低相关;肿瘤的形态、生长方式及其彩色血流的显示与病理危险度高低无明显相关。彩色多普勒超声检查有助于GIST 的定性和定位诊断,可以作为GIST 的首选和主要影像检查手段。
1 Mazur MT,Clark HB.Gastric stromal tumors:reappraisal of histogenesis[J].Am J Sur Pathol,1983,7:507 -519
2 徐玉芸,何晓东,钟建国,等.胃肠道间质瘤的CT 表现与病变危险度分级的对照研究[J].医学影像学杂志,2013,23(2):255 -258
3 Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J]. Hum Pathol,2008,39:1411 -1419
4 Chandrasekhara V,Ginsberg GG.Endoscopic management of gastrointestinal stromal tumors[J]. Curt Gastroenterol Rep,2011,13(6):532 -539
5 Miettinen M,Debiec - Rychter M,Fletcher JA,et al. Gastrointestinal stromal turnouts[M]//Fletcher C D M,Hogendoorn P C W,Mertens F,et al.WHO classification of tumors of soft tissues and bone[J].Lyon :IARC Press,2013:163 -167
6 Faigel DO,Abdhawa S.Gastrointestinal stromal tumors:the role of the gastroenterologist in diagnosis and risk stratification[J]. Clin Gastroenterol,2012,46(8):629 -636
7 Zhou XX,Ji F,Xu L,et al. EUS for choosing best endoscopic treatment of mesenchymal tumors of upper gastrointestinal tract [J].World J Gastroenterol,2011,17(13):1766 -1771
8 王光霞,罗彦英,徐松,等.胃肠间质细胞瘤超声诊断与病理对照分析[J].中国超声医学杂志,2008,24(6):531 -535
9 周鸿,杨兴洲,张振玲,等.胃肠间质瘤的彩色多普勒超声诊断价值[J].成都医学院学报,2010,5(3):254 -256
10 班永光,栾钦花,李吉昌,等. 多种影像学检查方法对腔外型胃肠道间质瘤的诊断价值探讨[J]. 医学影像学杂志,2013,23(5):734 -737
11 张明智,庄华,彭玉兰.胃肠道间质瘤彩色多普勒超声诊断及临床分析[J].华西医学,2010,25(11):1956 -1959

