华法林基因导向的个体化抗凝研究进展*
沈为勤,刘 俊
1南京市浦口区中心医院药剂科,南京 210032;2皖南医学院弋矶山医院药剂科,芜湖 241001
华法林基因导向的个体化抗凝研究进展*
沈为勤1,刘 俊2**
1南京市浦口区中心医院药剂科,南京 210032;2皖南医学院弋矶山医院药剂科,芜湖 241001
华法林是临床广泛使用的抗凝药,但其疗效存在明显个体差异,其中基因多态性是导致华法林剂量差异主要影响因素。本文查阅相关文献,综述与华法林剂量相关的基因,为临床华法林个体化应用提供参考。
华法林;基因多态性;给药模型;个体化用药;研究进展
华法林是常用的口服抗凝药,其抗凝治疗的有效性和安全性成为影响患者治疗成功与否的重要因素。华法林安全范围窄,疗效影响因素复杂,剂量与效应之间存在明显的个体差异和种族差异。黄种人华法林平均剂量约3.0mg·d-1,白种人约4.5mg·d-1,黑种人约5.7 mg·d-1。华法林用量不足容易形成血栓,使用过量可增加出血风险,这使得临床不易掌握华法林剂量。华法林较为科学的给药方式是通过监测国际标准化比值(INR),使其控制在理想的抗凝强度范围内,从而达到发挥抗血栓作用且不增加出血风险的目的。目前已经证实华法林剂量受到基因多态性影响,本文即对华法林药物基因导向的个体化抗凝进展作一综述。
1 华法林抗凝作用及体内代谢
华法林由S-华法林和R-华法林组成消旋异构体,其中S-华法林的抗凝活性约为R-华法林的5倍,提供60%~70%华法林的抗凝活性。华法林体外抗凝无效,口服吸收后通过抑制肝脏维生素K的氧化还原酶,使无活性的氧化型维生素K无法转化为有活性的还原型维生素K,阻断维生素K的循环利用,干扰维生素K依赖性凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的合成,阻碍凝血因子氨基末端谷氨酸残基的γ羧化作用,使凝血因子停留在无活性的前体阶段而达到抗凝目的。S-华法林和R-华法林分别经肝细胞微粒体、细胞色素P450(CYP)代谢,主要通过CYP2C9、 CYP1A2和CYP3A4代谢为无活性代谢产物,其中S-华法林85%以上通过CYP2C9代谢为无活性6-羟基和7-羟基代谢产物;R-华法林主要通过CYP3A4、CYP1A2、CYP1A1和CYP2C19代谢。见图1。
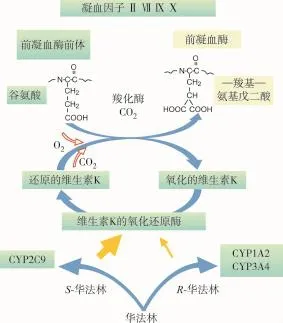
图1 华法林药理作用及体内代谢
2 基因多态性及其对华法林剂量的影响
2.1 细胞色素P450(CYP)2C9基因
CYP2C9是华法林代谢的关键酶,主要受到CYP2C9基因编码,该基因位于人类染色体10q24.2,全长约55 kb,含9个外显子和8个内含子,编码约490个氨基酸残基。CYP2C9基因具有高度遗传多态性,存在野生型CYP2C9*1和突变型CYP2C9*2~*13,其中与华法林代谢最密切的基因突变型为CYP2C9*2和CYP2C9*3。CYP2C9*2型突变发生在第3个外显子430位核苷酸胞嘧啶(C)被胸腺嘧啶(T)取代,致使相应氨基酸由精氨酸(Arg)转变为半胱氨酸 (Cys)。CYP2C9*3突变则在第7个外显子1075位核苷酸发生腺嘌呤 (A)突变为C,致使第359位氨基酸由异亮氨酸(Ile)突变为亮氨酸(Leu)。
CYP2C9基因存在明显种族分布差异。CYP2C9*2和CYP2C9*3变异在美国及欧洲裔美国人中更加普遍,分别为8%~20%和6%~10%,而包括中国汉族人群在内的亚洲人中发生频率较低,主要以 CYP2C9*3突变型为主,为 2%~4%,而CYP2C9*2突变型几乎阙如。CYP2C9基因发生突变可导致CYP2C9酶活性降低,尤其是CYP2C9*3突变可使编码的代谢酶活性明显降低,致使华法林的代谢及消除减少而导致出血风险的增加。高菲等[1]研究表明,与CYP2C9野生型相比,携带CYP2C9*3突变等位基因致华法林维持剂量减少35%,其抗凝过量比例明显增加(P<0.05)。与CYP2C9野生型相比,CYP2C9*2杂合子患者华法林剂量仅降低17%。娄莹等[2]研究CYP2C9基因多态性对心脏机械瓣膜置换术后华法林抗凝初始疗效的影响,结果表明,CYP2C9*1/*1基因型患者比携带*2或*3突变基因的患者,更容易在术后第6天进入治疗窗 (P<
0.05),前者进入治疗窗的机会是后者4.8倍。同时携带CYP2C9*2和CYP2C9*3等位基因患者出血危险提高2倍。研究表明[3],CYP2C9基因多态性可解释华法林剂量差异5%~22%。
2.2 维生素K环氧化物还原酶复合体亚单位1基因
华法林通过作用于维生素K环氧化物还原酶复合体亚单位1(VKORC1),阻碍维生素K由氧化型转化为有活性的氢醌型,阻断维生素K依赖性凝血因子Ⅱ、Ⅶ、Ⅸ和Ⅹ的活化而发挥抗凝作用,见图1。VKORC1主要由VKORC1基因编码,人类VKO-RC1基因位于染色体16p11.2,全长约4 kb,VKO-RC1在其启动子区存在-1639G>A及-1173C>T位点多态性。目前已经证实,-1639G>A及-1173C>T存在完全连锁,-1639G>A的多态性对华法林维持剂量有显著相关性[4]。
VKORC1-1639G>A基因分布频率亦具有明显种族差异。在中国人群中,主要以AA纯合型为主(69.0%~82.1%),而西方高加索人群中AA纯合型基因分布频率约14%。与VKORC1-1639A等位基因比较,VKORC1-1639G等位基因可使VKORC1基因启动子活性高出44%,亚洲人群VKORC1-1639AA、GA和GG基因型分布频率分别为80.4%、18.3%和1.3%,而西方高加索人群分别为16.3%、 48.9%和36.7%[5]。与AA基因型患者比较,携带G等位基因者可导致VKORC1 mRNA及蛋白表达水平提高,引起VKORC1活性增高,凝血因子合成增加,导致华法林维持剂量显著提高[6]。与携带-1639AA等位基因患者比较,携带-1639GA等位基因患者华法林日平均剂量增加61%[5]。Miao等[7]对中国人群研究认为,携带VKORC1-1639GG型和GA型患者华法林平均剂量(3.32±1.02)mg·d-1,明显高于AA型患者华法林平均剂量 (1.76±0.57)mg·d-1(P<0.001)。高菲等[1]研究认为,VKORC1-1639AA患者华法林剂量 (3.00±1.03)mg·d-1明显低于GA基因型(4.59±1.03)mg·d-1(P<0.05),且携带CYP2C9突变基因和VKORC1突变基因的患者华法林达稳态时间延长(P<0.05)。Johnson等研究[3]认为,VKO-RC1基因多态性可解释华法林剂量差异的6%~37%,其对华法林剂量解释力度明显高于CYP2C9。
美国AEI-BROOKINGS法规研究联合中心2006年发布的数据,美国每年新增200万患者使用华法林,若这些患者实施人均300美元的华法林相关基因检测,依据检测结果制定个体化的华法林治疗方案,每年可减少10万例华法林相关的严重不良反应,节约11.3亿美元的医疗费用。基于此,美国FDA于2007年8月对华法林药品说明书进行了修订(百时美施贵宝公司产,商品名:Coumadin),提示CYP2C9和VKORC1基因多态性对华法林疗效产生影响,建议用药前检测CYP2C9和VKORC1基因型。2009年FDA再次修改华法林用药标签,建议根据患者VKORC1和CYP2C9基因型确定其起始剂量,并提供一个简洁的剂量推荐表[8]。见表1。
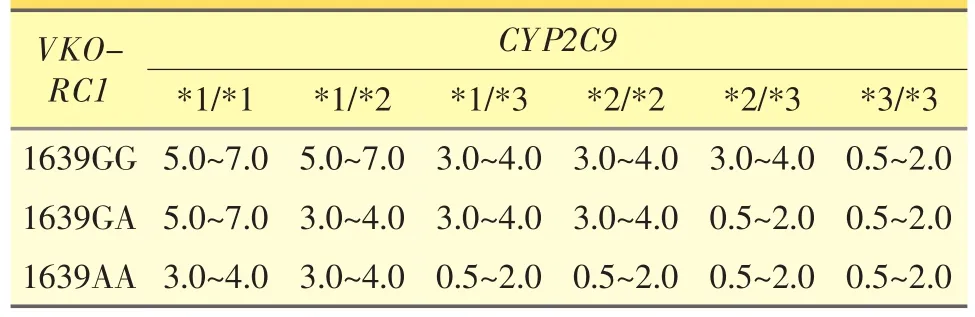
表1 美国FDA建议的华法林初始剂量/mg·d-1
2.3 CYP4F2基因
CYP4F2是人类细胞色素P450酶超家族成员之一,可将维生素K1氧化成ω-羟基衍生物,CYP4F2酶活性不同可影响维生素K1的含量,从而影响华法林抗凝效果。CYP4F2基因定位于染色体19p13.11,由13个外显子和12个内含子组成,编码520个氨基酸残基。CYP4F2变异型基因的携带者对维生素K代谢的能力降低,继而使维生素K水平升高,导致华法林剂量增加。Danese等[9]研究CYP2C9、VKORC1、CYP4F2基因型对华法林剂量的影响,认为与CYP4F2 CC型相比,杂合子CT型华法林剂量增加11%,纯合子TT型增加21%。Singh等[10]认为,CYP4F2 rs2108622能解释约11%的华法林剂量的个体差异。张海燕等[11]对苏南地区心脏机械瓣膜置换术后汉族人群中CYP4F2 rs2108622基因多态性研究表明,C等位基因分布频率为76.9%,T等位基因分布频率为23.1%;CC型、CT型和TT型患者华法林平均剂量分别为 (2.51±0.82)mg·d-1、(2.74± 0.96)mg·d-1和(3.20±1.22)mg·d-1。朱君荣等[12]研究表明,CYP4F2基因多态性对非瓣膜性房颤患者华法林剂量差异的贡献率为4.8%。娄莹等[13]研究,CYP4F2基因多态性对华法林稳定剂量的影响,结果证实,CYP4F2基因型仅能解释华法林个体剂量差异的0.6%。
2.4 γ谷氨酰羧化酶基因
γ谷氨酰羧化酶(GGCX)是维生素K依赖性凝血因子活化的关键酶,其编码基因GGCX具有遗传多态性,是导致华法林个体剂量差异的影响因素之一。Rieder等[14]认为,GGCX位于12970位点的单核苷酸多态性与华法林剂量存在关联性,可解释2%的剂量差异。另一项研究表明[15],日本患者GGCX8016G>A基因多态性与华法林剂量显著相关(P=0.022)。一项对中国人的研究表明[16],GGCX rs 6738645 GG型患者华法林维持剂量 (1.85±0.73)mg·d-1,明显低于TT型(3.13±0.87)mg·d-1和GT型(3.20±0.95)mg·d-1(P<0.01)。
2.5 载脂蛋白E基因
载脂蛋白E(ApoE)是血浆脂蛋白的主要成分,负责将脂类物质从消化道转运至血液循环中,也介导富含维生素K的载脂蛋白以受体特异性的方式向肝脏中转运。ApoE主要由ApoE基因负责编码,其主要有三种突变类型,即ε2、ε3和ε4。意大利人群中ε4基因突变频率<10%,瑞典人群中ε4基因突变频率>20%,而非裔美国人和高加索人该基因突变频率可高达37.8%和26.4%。Kohnke等[17]研究发现,携带ApoE ε4基因的患者华法林所需剂量较高,且认为ApoE基因可解释6%患者华法林剂量的个体差异。Kimmel等[18]研究认为,非裔美国人ApoE ε4携带者华法林需求剂量增加28.6%(P=0.014);而与高加索人则无显著性差异。黄盛文等[19]对249例中国人群研究认为,ApoE基因多态性并不是导致华法林剂量差异的主要影响因素。
2.6 其他基因对华法林剂量的影响
随着华法林相关药物基因研究深入,一些新的基因与华法林剂量关联性被证实。梁欣等[20]研究表明,中国人群STX4基因突变率可高达93.96%,与VKORC1基因高度连锁,且STX4基因多态性对华法林使用剂量有显著影响(P<0.05)。胡蓉等[21]研究发现,细胞色素P450氧化还原酶(POR)基因多态性与华法林维持剂量存在关联性,POR rs17685T等位基因携带者的华法林维持剂量(4.76±0.90)mg·d-1,明显高于CC型患者华法林维持剂量(4.08±1.03)mg· d-1(P=0.04)。NR1I2基因通过编码孕烷 X受体(PXR)来调控CYP3A4活性表达,参与华法林肝脏代谢,NR1I2 7635G/A基因多态性与华法林剂量上调有关,GA型和AA型患者华法林维持剂量明显高于GG型(P<0.05)[22]。
3 展 望
华法林药物基因检测在某种程度将有助于华法林剂量的制定和调整,但由于基因多态性只能解释30%~60%的华法林剂量的个体差异,仍有近50%患者华法林的剂量并无法得到有效验证,且缺乏随机试验证明通过基因确定华法林剂量可以改善临床治疗效果。正因为通过基因检测来预测华法林剂量存在诸多局限性,FDA并没有强制要求在使用华法林初始治疗的患者中进行药物基因检测,国外相关指南及《2013年华法林抗凝治疗的中国专家共识》也不推荐对所有服用华法林的患者常规进行基因检测来决定其剂量。目前,临床医生仍然主要通过监测INR值来调整华法林剂量。但毋容置疑的是,随着华法林相关的药物基因组学的不断发展和完善,以药物基因为导向的华法林个体化抗凝将是未来临床治疗的必然趋势,尤其对于需要采用高剂量或低剂量华法林抗凝患者而言,以基因导向的抗凝治疗,可以缩短患者抗凝达标时间,提高抗凝达标率,且可减少抗凝并发症的发生。相信未来华法林的治疗会变得更具有针对性、高效性和安全性。
[1]高 菲,宋洪涛,曾志勇,等.CYP2C9和VKORC1基因多态性对心脏瓣膜置换术后华法林维持剂量和抗凝效果的影响[J].中国药房,2010,21(22):2053-7.
[2]娄 莹,谢 爽,刘 红,等.CYP2C9基因多态性对中国心脏机械瓣膜置换患者华法林初始抗凝效果的影响[J].中国临床药理学杂志,2013,29(1):34-41.
[3]Johnson JA,Gong L,Whirl-Carrillo M,et al.Clinical pharmacogenetics implementation consortium guideline for CYP2C9 and VKORC1 genotypes and warfarin dos-ing[J].Clin Pharmacol Ther,2011,90(4):625-9.
[4]Botton MR,Bandinelli E,Rohde LE,et al.Influenceofgenetic,biologicaland pharmacologicalfactors on warfarin dose in a Sothern Brazilian population of Eu-ropean ancestry[J].Br Clin Pharmacol,2011,72(3): 442-50.
[5]Yang L,Ge W,Yu F,et al.Impact ofVKORC1gene polymorphism on inter-individual and interethnic war-farin dosage requirement-a systematic review and meta analysis[J].Thromb Res,2010,125(4):e159-66.
[6]Yuan HY,Chen JJ,Lee MT,et al.A novel functional VKORC1 promoter polymorphism is associated with in-ter-individual and inter-ethnic differences in warfarin sensitivity[J].Hum Mol Genet,2005,14(13):1745-51.
[7]Miao L,Yang J,Huang C,et al.Contribution of age,body weight andCYP2C9andVKORC1genotype to the anticoagulant response to warfarin:proposal for a new dosing regimen in Chinese patients[J].Eur J Clin Pharmacol,2007,63(12):1135-41.
[8]Finkelman BS,Gage BF,Johnson JA,et al.Genetic warfarin dosing tables versus algorithms[J].J Am Coll Cardiol,2011,57(5):612-8.
[9]Danese E,Montagnana M,Johnson JA,et al.Impact of theCYP4F2p.V433Mpolymorphism on coumarin dose requirement:systematic review and meta-analysis[J].Clin Pharamacol Ther,2012,92(6):746-56.
[10]Singh O,Sandanaraj E,Subramanian K,et al.Influ-ence ofCYP4F2 rs2108622(V433M)on warfarin dose requirement in Asian patients[J].Drug Metab Pharma-cokinet,2011,26(2):130-6.
[11]张海燕,罗万慰,马守梅,等.细胞色素P450酶4F2基因多态性对华法林剂量影响的研究 [J].药学与临床研究,2010,18(4):338-340.
[12]朱君荣,魏 荫,朱余兵,等.CYP4F2、CYP2C9和VKORC1基因多态性对中国汉族非瓣膜性房颤患者使用华法林剂量的影响 [J].中国药房,2012,23(44):4161-4.
[13]娄 莹,华 潞,韩璐璐,等.中国汉族人群华法林稳定剂量模型的建立与验证 [J].中华心血管病杂志,2014,42(5):384-8.
[14]Rieder MJ,Reiner AP,Rettie AE.Glutamyl carboxy-lase (GGCX)tagSNPs have limited utility for predict-ing warfarin maintenance dose[J].J Thromb Haemost, 2007,5(11):2227-34.
[15]Kimura R,Miyashita K,Kokubo Y,et al.Genotypes of vitamin K epoxide reductase,-glutamyl carboxylase, and cytochrome P450 2C9 as determinants of daily warfarin dose in Japanses patients[J].Thromb Res, 2007,120(2):181-6.
[16]刘寅强,杨百晖,夏健明,等.GGCX(rs6738645)基因多态性与华法林稳定剂量的关系 [J].重庆医学,2014,43(10):1184-6.
[17]Kohnke H,Scordo MG,Pengo V,et al.Apolipopro-tein E(APOE)and warfarin dosing in an Italian pop-ulation[J].Eur J Clin Pharmacol,2005,61(10):781-3.
[18]Kimmel SE,Christie J,Kealey C,et al.Apolipopro-tein E genotype and warfarin dosing among Cau-casians and African Americans[J].Pharmacogenomics J,2008,8(1):53-60.
[19]Huang S,Chen B,Xiang D,et al.Association be-tween apolipoprotein E gene polymorphism and the dose for warfarin maintenance[J].J Cent South Univ (Med Sci),2011,36(3):212-6.
[20]梁 欣,乔 彦,张亚同,等.中国人群STX4基因多态性对华法林应用剂量的影响 [J].中国药学杂志,2011,46(9):691-4.
[21]胡 蓉,许 哲,赵立子,等.POR基因多态性与华法林维持剂量关系的研究 [J].中国药理学通报,2014,30(5):706-10.
[22]郑绮姗,赵立子,曾武涛,等.NR1I2基因多态性对华法林维持剂量个体差异的影响 [J].中国临床药理学与毒理学杂志,2012,26(2):219-24.
Research Progressin Warfarin Individualized Anticoagulation Based on Pharmacogenomics*
SHEN Wei-qin1,LIU Jun2**
1Department of Pharmacy,Nanjing Pukou Central Hospital,Nanjing 210032,China;2Department of Pharma-cy,Yijishan Hospital of Wannan Medical College,Wuhu 241001,China
Warfarin is one of the most frequently prescribed anticoagulant and there is significant indi-vidual variability in dose requirement for the clinical effect.Gene polymorphisms are the important factors that can influence the anticoagulant effect of warfain.Recently,warfarin gene polymorphisms become a re-search topic and a large number of individualized medication algorithms have been established.This article reviews warfarin dosage related gene polymorphisms in order to offer some suggestions for warfarin individ-ualized medication.
Warfarin;Gene polymorphism;Algorithm;Individualized medication;Research progress
R973+.2
A
1673-7806(2015)05-475-04
皖南医学院中青年科研基金自然科学类项目(No.WK2014F20)
沈为勤,女,药师,研究方向:临床药学
* *通讯作者刘俊,男,临床药师 E-mail:xiaoyu234561@sina.com
2015-01-16
2015-02-02

