TGF-β3对体外培养的羊驼黑色素细胞的影响
刘 彧,石占全,姬凯元,杨姗姗,范瑞文
(山西农业大学动物科技学院,太谷 030801)
TGF-β3对体外培养的羊驼黑色素细胞的影响
刘 彧,石占全,姬凯元,杨姗姗,范瑞文*
(山西农业大学动物科技学院,太谷 030801)
为了研究转化生长因子β3(Transforming growth factor beta3,TGF-β3)对体外培养的羊驼皮肤黑色素细胞表型的影响。本研究在体外培养的羊驼皮肤黑色素细胞中添加不同浓度TGF-β3(6.25、12.5、25、50 ng·mL-1),通过实时监测和检测细胞增殖、毛色相关基因小眼畸形相关转录因子(Microphthalmia—associtated transcription factor,MITF)、酪氨酸酶(Tyrosinase,TYR)和酪氨酸酶相关蛋白2(Tyrosinase related protein 2,TYRP2)表达以及黑色素产量的变化。结果表明:(1)在羊驼皮肤黑色素细胞中添加50 ng·mL-1浓度的TGF-β3后,在前30 h内对细胞增殖有抑制效果,30 h后对细胞增殖有明显的长时程维持细胞数量作用,但对TGF-β3添加的剂量没有依赖性;(2)添加TGF-β3后,黑色素细胞内MITF、TYR和TYRP2的表达量均被下调,而且黑色素细胞产生黑色素的量也被下调,主要以添加50 ng·mL-1时下调最为显著。结果揭示,TGF-β3通过对羊驼黑色素细胞内MITF、TYR和TYRP2的表达的影响,并调控黑色素的产生,对黑色素细胞的生物学功能具有重要的影响。
转化生长因子β3; 黑色素;黑色素细胞; 羊驼
转化生长因子β(Transforming growth factor beta,TGF-β)有3个不同的家族成员,分别为TGF-β1、TGF-β2和TGF-β3[1-3]。TGFβ是一种多功能细胞因子,对细胞凋亡、细胞生长停滞以及其他生理和病理反应起着重要的诱导作用[4-8]。TGFβ及其受体还是黑色素细胞成熟分化时有效的抑制因子,主要通过有效的抑制MITF的表达,从而抑制黑色素细胞的成熟[9]。
黑色素细胞形状不规则大多数呈梭形或多边形,细胞核呈卵圆形,黑色素细胞内散在分布电子密度高,质地均匀,大小不等,形态规则,一般呈圆形或卵圆形的合成黑色素的细胞器-黑素体。黑色素细胞中散在分布黑素体,当黑素体成熟时,内含电子密度高的黑色素可从胞质内释放进入黑色素细胞外的结缔组织中,在其周围的胶原纤维束中含有大小不等,体积一般较黑素体小,没有规则形状的电子致密的黑色素颗粒,黑色素细胞内的黑素体与释放出的黑色素颗粒大小和形状完全不同[10]。
黑色素细胞分泌大量的TGF-β1、TGF-β2和TGF-β3,并且所有的亚型都在高发性黑色素瘤细胞中表达[11-13]。尽管已有研究报道TGF-β在黑色素细胞、黑色素瘤细胞发育和成熟过程中至关重要,但在黑色素细胞内TGF-β3作为外源的影响因子,调控其产生黑色素的机制还知之甚少,本课题组对TGF-β1在羊驼皮肤和黑色素细胞中的作用做了系列研究,为了揭示TGF-β3与羊驼皮肤黑色素合成中一些基因和蛋白的关系,拟将TGF-β3作用于体外培养的羊驼皮肤黑色素细胞,分析黑色素细胞的形态、毛色基因(MITF、TYR和TYRP2)表达以及色素产量的变化,旨在为研究TGF-β3对羊驼皮肤毛色黑色素生成的调控提供理论基础。
1 材料与方法
1.1 正常羊驼皮肤黑色素细胞的培养
无菌切取1~3岁羊驼的背部皮肤组织,用含双抗预冷的PBS溶液反复冲洗,去除皮下的结缔组织,切成宽约0.2 mm的小条,0.25% DispaseⅡ酶4 ℃过夜,即冷消化16~18 h,真皮与表皮分离,用1.5 g·L-1胰酶消化液将表皮于37 ℃消化5~8 min,吸管反复吹打,200目不锈钢筛网过滤,4 ℃ 1 000 r·min-1离心,用黑色素细胞培养液(MGM)重悬细胞,计数后以5×105个·mL-1的密度接种于6孔培养板中。MGM的组成:DMEM/F12基础培养基、庆大霉素200 U·L-1、CT 0.25 mg·L-1、胰岛素150 U·L-1、氢化可的松3 mg·L-1、bFGF 1 ng·mL-1。将细胞接种于6孔培养板中,其密度为2×104~4×104个·mL-1,于37 ℃培养箱中5% CO2条件下培养24 h,换液去除组织碎片与未贴壁的细胞,此后每3 d更换1次培养液。培养8~10 d,经传代所得到的羊驼皮肤黑色素细胞纯度为99%以上。本研究所用的羊驼皮肤黑色素细胞为第4代。黑色素细胞形状不规则,大多数呈梭形或多边形,细胞核呈卵圆形,黑色素细胞内散在分布黑素体。
1.2 方法1.2.1 细胞内添加TGF-β3 TGF-β3用去离子水溶解,制成储备液。制备不同浓度的TGF-β3(6.25、 12.5、25、50 ng·mL-1)用于添加到黑色素细胞培养基中,对照组添加去离子水,每组9个重复孔。1.2.2 TGF-β3对羊驼皮肤黑色素细胞活力的影响 对添加不同浓度TGF-β3的5组羊驼黑色素细胞计数,稀释到相同的细胞浓度,用RTCA实时无标记细胞功能分析仪做细胞增殖试验:E-plate每孔中加入50 μL的培养基,置于仪器检测台上测试基线;将计数稀释的羊驼黑色素细胞加入E-plate孔中,每孔5 000个细胞;室温放置30 min后将实验板放入仪器开始试验,每5 min检测1次细胞指数,记录细胞贴壁,生长过程至40 h。
1.2.3 细胞总RNA和蛋白质的提取 添加试验结束时,收集9孔细胞,3孔用于提取RNA,3孔用于提取总蛋白,3孔用于提取黑色素,并用NanoDrop 1000和BSA法分别检测RNA和蛋白质的质量和浓度。
1.2.4 RNA反转录和实时定量PCR 10 μL反应体系:5×Prime ScriptTMBuffer 2 μL,Prime ScriptTMRT Enzyme Mix 10.5 μL,Oligo dT Primer 25 pmol,随机引物50 pmol,Total RNA 1 μL,DEPC水加至10 μL。反应条件:37 ℃ 15 min,85 ℃ 5 s,反转录后cDNA可用于实时定量PCR。
qRT-PCR每个样本做4个重复,并且设立每个样本的阴性对照(以水代替模板),10 μL反应体系:SYBR®Premix Ex TaqTMII(2×) 5 μL,上下游引物(10 μmol·L-1) 各0.2 μL(引物序列见表1),ROX Reference Dye II 0.2 μL,Template DNA 1 μL,Rnase-free water 3.4 μL。扩增条件:95 ℃ 30 s;95 ℃ 5 s,55 ℃ 30 s,72 ℃ 10 s,40循环。内参基因为β-actin。基因的相对表达量用2-ΔΔCt法计算。
1.2.5 总蛋白的提取与Western blotting检测 用总蛋白提取试剂盒(碧云天)提取细胞总蛋白。用核酸蛋白仪测定蛋白浓度,每孔上样200 μg总蛋白进行SDS-PAGE电泳,转移至PVDF膜,经5%脱脂奶粉封闭液,室温封闭1.5 h。将转印膜放入平皿内,加入兔源目的基因多克隆抗体(封闭液1∶300稀释)。4 ℃摇床过夜孵育,TBST洗膜,加入二抗(HRP山羊抗兔IgG),37 ℃孵育1.5 h,加入ECL发光剂,2~3 min后甩去工作液,照相观察。免疫印迹信号用Image-proplus 6.0软件进行相对定量分析。
表1MITF、TYR、TYRP2、β-actin的引物序列
Table 1 The primer sequences ofMITF,TYR,TYRP2,β-actin

目的基因Gene引物序列(5'-3')Primersequence退火温度/℃TmMITFF:TCCCAAGTCAAATGATCCAGR:GAGCCTGCATTTCAAGTTCC52TYRF:GCTTTAGCAACTTCATGGGAR:CTTGTTCTTCTCTGGGACAC56TYRP2F:TGCTTTGCCCTACTGGAACR:ATCAGAGTCGATCGTCTG63β-actinF:CTAAGGAGAAGGGCCAGTCCR:CTCAAGTTGGGGGACAAAAA52~56
1.2.6 黑色素含量的测定 在羊驼黑色素细胞的培养基中添加不同浓度的TGF-β3,56 h后移去培养基,用1 mL预冷的PBS冲洗细胞3次,用0.25%胰蛋白酶消化8 min,加入终止液终止消化,吹打使其变为单细胞悬液后将细胞移入离心管中,取出一小部分进行台盼蓝染色计数。然后4 ℃,1 000 r·min-1,离心10 min,弃去终止液再次用PBS冲洗细胞,共冲洗3次。弃去PBS,每管加入0.5 mL 0.2 mol·L-1的NaOH溶解黑色素细胞。将细胞溶解液移到另一个干净的1.5 mL的EP管中,80 ℃加热5 min。取乌贼墨标准品溶解在0.2 mol·L-1的NaOH中,进行标准曲线的设置。使用酶标仪在475 nm波长处对黑色素标准品级所有样品进行吸光值的测量,每组重复3次,将同一条件下测得的样品吸光值与黑色素标准品吸光值进行比较即为各样品中的黑色素含量,最终获得黑色素含量用μg·10-6细胞表示。
1.3 统计学处理
数据用Microsoft Excel进行统计分析,结果用“平均值±标准差(Means±SD)”表示,采用SPSS16.0软件进行单因素方差分析检验。
2 结 果
2.1 TGF-β3对羊驼皮肤黑色素细胞形态学的影响
在体外培养的黑色素细胞中添加不同浓度的TGF-β3 56 h后,倒置显微镜下观察发现,对照组中黑色素细胞形态呈现正常培养黑色素细胞的梭形或多边形,而试验组黑色素细胞随着TGF-β3浓度增大,含两极突起的细胞明显增多,呈现椭圆形(图1)。
2.2 TGF-β3对羊驼皮肤黑色素细胞增殖的影响
各组细胞在4 h内均贴壁,10 h后各组的细胞增殖有了明显变化。与正常细胞相比,添加最高浓度TGF-β3(50 ng·mL-1)的黑色素细胞增殖在前30 h被抑制,而添加较低浓度的黑色素细胞增殖没有变化;30 h后,添加不同浓度的TGF-β3均对黑色素细胞有长时程维持细胞数量的作用,但没有剂量依赖性(图2)。
2.3 TGF-β3对羊驼皮肤黑色素细胞MITF、TYR、TYRP2基因表达变化量的影响
实时定量PCR结果表明,添加了TGF-β3的羊驼黑色素细胞中,MITF基因各试验组较对照组在转录水平分别下降到0.52、0.53、0.54和0.32倍,试验组与对照组均差异极显著(P<0.01)。在试验组中,TYR的转录水平分别较对照组下降到0.49、0.71、0.56、0.58倍,并呈显著或极显著差异;TYRP2各试验组的转录水平分别较对照组下降到0.41、0.40、0.46、0.51倍,并呈极显著差异(P<0.01)(图3)。2.4 TGF-β3对羊驼皮肤黑色素细胞MITF、TYR、TYRP2蛋白表达变化量的影响
Western blotting结果显示,羊驼黑色素细胞总蛋白中存在能与兔抗TYR、TYRP2、MITF多克隆抗体发生免疫阳性反应的蛋白条带(图4A)。对不同试验组羊驼黑色素细胞目的蛋白表达进行定量分析发现,添加TGF-β3的羊驼黑色素细胞中MITF、TYR和TYRP2均下调,且添加50 ng·mL-1TGF-β3下降的最为显著。4个试验组与对照组相比差异显著或极显著(图4B)。
2.5 TGF-β3对羊驼皮肤黑色素细胞黑色素产量的影响
用分光光度法对添加不同浓度TGF-β3的黑色素细胞内黑色素产量进行测定,结果显示,添加不同浓度的TGF-β3后,试验组黑色素细胞中黑色素产量比对照组均有不同程度的减少,且添加50 ng·mL-1TGF-β3下降的最为显著(图5)。

A.正常的羊驼黑色素细胞;B.添加6.25 ng·mL-1 TGF-β3的羊驼黑色素细胞;C.添加12.5 ng·mL-1 TGF-β3的羊驼黑色素细胞;D.添加25 ng·mL-1 TGF-β3的羊驼黑色素细胞;E.添加50 ng·mL-1 TGF-β3的羊驼黑色素细胞A.Normal alpaca skin melanocytes;B.Melanocyte with the addition of 6.25 ng·mL-1 TGF-β3;C.Melanocyte with the addition of 12.5 ng·mL-1 TGF-β3;D.Melanocyte with the addition of 25 ng·mL-1 TGF-β3;E.Melanocyte with the addition of 50 ng·mL-1 TGF-β3图1 TGF-β3处理56 h羊驼皮肤黑色素细胞的形态Fig.1 The effect of TGF-β3 with different concentrations on the morphology of alpaca melanocytes for 56 h

图2 TGF-β3添加对羊驼皮肤黑色素细胞增殖的影响Fig.2 The effect of TGF-β3 with different concentrations on the proliferation of alpaca melanocytes
3 讨 论
哺乳动物被毛的颜色主要由沉着在皮肤的黑色素的含量及其种类决定的,黑色素主要分为两类:真黑色素(Eumelanin)和褐黑色素(Pheomelanin)[14]。黑色素产生后,被运输到周围角质化细胞中,产生皮肤和被毛颜色。

不同小写字母表示差异显著;不同大写字母表示差异极显著。图4、图5同Different lowercase letters .P<0.05;Different uppercase letters.P<0.01.The same as Figure 4 and Figure 5图3 添加不同浓度TGF-β3对毛色相关基因mRNA表达的影响Fig.3 The effect of TGF-β3 with different concentrations on mRNA expression of hair color genes in alpaca melanocytes

A.Western blotting 结果;B.相对表达量分析A.Western blotting;B.Quantitative amount of protein expression图4 添加不同浓度TGF-β3对毛色基因蛋白表达的影响Fig.4 The effect of TGF-β3 with different concentrations on protein expression in alpaca melanocytes
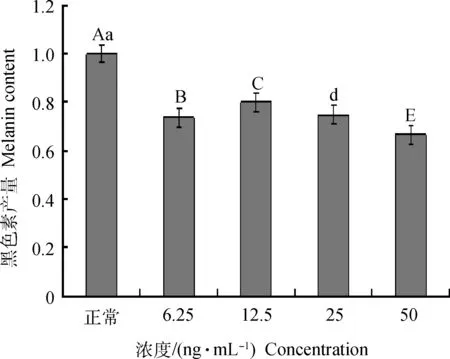
图5 添加不同浓度TGF-β3对黑色素细胞内色素产量的影响Fig.5 The effect of TGF-β3 with different concentrations on melanin production in alpaca melanocytes
目前发现,在哺乳动物黑色素细胞中,合成黑色素有两条信号路径,即受体酪氨酸激酶(KIT)和G蛋白偶联内皮素受体B(EDNRB)途径,其中任意一条路径上功能的丢失或突变都会导致胚胎中黑色素细胞前体的数量减少,最终导致毛色的改变[15]。在EDNRB路径中,促黑色素激素(α-MSH)与黑色素细胞膜上的黑皮激素受体(MC1R)结合后可激活Gs蛋白,Gs蛋白激活膜内侧的腺苷酸环化酶(AC),AC的活化使细胞内cAMP水平升高,后者能活化蛋白激酶A(PKA)导致CREB(cAMP-responsive element-binding)的磷酸化[16]。磷酸化的CREB可激活小眼畸形相关转录因子(MITF),MITF是毛色通路上一个重要的转录调控因子,通过调控形成黑色素的重要基因的表达而影响黑色素细胞的发育,如酪氨酸酶(TYR)及其相关蛋白1和2(TYRP1和TYRP2),而TYR是黑色素生成的关键酶,催化3步不同的反应;酪氨酸酶相关蛋白1(TYRP1)、酪氨酸酶相关蛋白2(TYRP2)在黑色素合成过程中各自催化特异的反应[16-17]。尽管有研究表明,TGF-β3是小鼠神经源色素细胞发育所必须的,但TGF-β3是否对黑色素细胞的生物学性质有影响尚不清楚。本试验通过在体外培养的黑色素细胞中添加不同浓度的TGF-β3,检测到黑色素细胞中MITF、TYR、TYRP2在mRNA 和蛋白水平均有不同程度的下调。MITF是TYR、TYRP2的转录因子,因此,TYR和TYRP2的表达水平的变化是由MITF引起的。TYRP2 在酪氨酸酶发挥作用过程中起重要的作用[18-21],是细胞增殖率和细胞内黑色素含量的指标[22]。在该试验中也检测到不同浓度的TGF-β3引起细胞表型的变化,导致了黑色素细胞内黑色素合成量的下调,这证实了TYRP2表达水平与黑色素含量之间的关系。综上所述,TGF-β3通过G蛋白偶联内皮素受体B路径调控黑色素细胞产生黑色素,而TGF-β3如何作用于MITF的机理有待于进一步研究。
黑色素细胞的突起或突起延伸对黑色素运输至周围的角质化细胞至关重要,影响皮肤和被毛颜色的形成。此外,还关系到黑色素细胞的其他功能,如张晖等[10]发现,多泡脂肪细胞靠近黑色素细胞,黑色素细胞合成的黑色素可以通过运输释放到多泡脂肪细胞,引起脂肪吸附。本试验中,高浓度TGF-β3可以促进黑色素细胞突起形成,引起黑色素细胞形态学的变化,因此,TGF-β3在黑色素转运至角质化细胞和多泡脂肪细胞过程中起重要作用,从而将对哺乳动物毛色形成和脂肪吸附有重要意义。
4 结 论
在黑色素细胞G蛋白偶联内皮素受体B路径中,TGF-β3通过调控MITF、TYR和TYRP2的表达,从而引起黑色素含量的变化;适当浓度的外源性TGF-β3可促进黑色素突起形成,以确保黑色素的运输。
[1] GRENSSNER A M,WEISKIRCHE N R.Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-β as major players and therapeutic targets[J].JCellMolMed,2006,10:76-99.
[2] WAHL S M,WEN J,MOUTSOPOULOS N.TGF-beta:a mobile purveyor of immune privilege[J].ImmunolRev,2006,213:213-227.
[3] LIM O,WANY Y,SANJABI S,et al.Transforming growth factor-beta regulation of immune responses[J].AnnuRevImmunol,2006,24:99-146.
[4] 曾 东,余文林,杨传红,等.TGF-β各亚型与其受体在猪皮肤及毛囊中的表达[J].中国美容医学,2009,18(5):641-643. ZENG D,YU W L,YANG C H,et al.Expression of TGF-β isoforms and their receptors in the pig skin and hair follicle[J].ChineseJournalofAestheticMedicine,2009,18(5):641-643.(in Chinese)
[5] FOITZIK K,PAUS R,DOETSCHMAN T,et al.The TGF-β2 isoform is both a required and sufficient 275 inducer of murine hair follicle morphogenesis[J].DevBiol,1999,212(2):278-289.
[6] BARTRA M U,SPEER C P.The role of transforming growth factor beta in lung development and disease[J].Chest,2004,125(2):754-765.
[7] PARK S H.Fine tuning and cross-talking of TGF-beta singal by inhibitory smads[J].BiochemMolBiol,2005,38(1):9-16.
[8] WILLERT K,NUSSE R.β-catenin:a key mediator of Wnt signaling[J].CurrOpinGenetDevt,1998,8(1):95-102.
[9] KUMASAKA M,GODING C R.β-catenin in the melanocyte lineage[J].PigmentCellRes,2003,16(3):312-317.
[10] 张 晖,戈婷婷,彭沙沙,等.泰和乌骨鸡皮肤黑色素与多泡脂肪细胞的超微结构研究[J].畜牧兽医学报,2014,45(5):815-820. ZHANG H,GE T T,PENG S S,et al.Ultrastructural studies Taihe Silky skin melanin and multivesicular fat cells[J].ActaVeterinariaetZootechnicaSinica,2014,45(5):815-820.(in Chinese)
[11] HIBINO T,NISHIYAMA T.Role of TGF-beta2 in the human hair cycle[J].JDermatolSci,2004,35(1):9-18,285.
[12] BURTD W,LAWA S.Evolution of the transforming growth factor-beta superfamily[J].ProgGrowthFactorRes,1994,5(1):99-107.
[13] LIMO-SANJABI S,FLAVELL R A.Transforming growth factor-βcontrols development,homeostasis,and tolerance of T cells by regulatory T cell-dependent and-independent mechanisms[J].Immunity,2006,25(3):455-471.
[14] SIMON J D,PELES D N.The red and the black[J].AccountsChemRes,2010,43(11):1452-1460.
[15] AOKI H,MOTOHASHI T,YOSHIMURA N,et al.Cooperative and indispensable roles of Endothelin 3 and KIT signalings in melanocyte[J].DevDynamics,2005,233:407-417.
[16] LIN J Y,FISHER D E.Melanocyte biology and skin pigmentation[J].Nature,2007,445(22):843-849.
[17] OTREBA M,ROK J,BUSZMAN E,et al.Regulation of melanogenesis:the role Of cAMP and MITF[J].PostepyHigMedDosw,2012,66:33-40.
[18] AB-MALEK Z,SWOPE V B,SUZUKI I,et al.Mitogenic and melanogenic stimulation of normal human melanocytes by melanotopicpeptides[J].ProcNatlAcadSciUSA,1995,92(51):1789-1793.
[19] HEARING V J.Biochemical control of melanogenesis and melanosomal organization[J].JInvestDermatol,1999,4(1):24-28.
[20] DEL MARMOL V,ITO S,JACKSON I,et al.TRP-1 expression correlates with eumelanogenesis in human pigment cells in culture[J].FebsLetters,1993,327(3):307-310.
[21] 高 莉,赵英虎,刘朝亮,等.酪氨酸酶相关蛋白1 调控黑色素形成的研究进展[J].畜牧与饲料科学,2010,31(10):114-116. GAO L,ZHAO Y H,LIU C L,et al.Progress tyrosinase-related protein 1 regulated the formation of melanin[J].AnimalHusbandryandFeedScience,2010,31(10):114-116.(in Chinese)
[22] VANCE K W,GODING C R.The transcription network regulating melanocyte development and melanoma[J].PigmentCellRes,2004,17(4):318-325.
(编辑 郭云雁)
The Effect of TGF-β3 on the Melanocyte Culturedinvitroof Alpaca
LIU Yu,SHI Zhan-quan,JI Kai-yuan,YANG Shan-shan,FAN Rui-wen*
(CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
The aim of this study was to investigate the effect of TGF-β3 on the phenotype of alpaca melanocyte culturedinvitro.The melanocyte proliferation,gene expression of MITF,TYR and TYRP2 at the transcript and translation level were detected and melanin production was analyzed after the addition of TGF-β3 with different concentrations of 6.25,12.5,25,50 ng·mL-1in melanocyte medium.The results showed that:Compared to the normal melanocyte,the proliferation of melanocytes was inhibited within 30 h by the addition of 50 ng·mL-1TFG-β3 and then the amount of cells could be maintained without dependence on the concentration of TGF-β3 after 30 h;MITF,TYRandTYRP2 expression were down-regulated and melanin production also reduced after the addition of TGF-β3.The dose of 50 ng·mL-1TGF-β3 caused more significant effects.The results suggested that TGF-β3 had the important effects on the biology of alpaca melanocyte by regulating the expression ofMITF,TYR,TYRP2 and melanin production.
TGF-β3;melanin;melanocyte;alpaca
10.11843/j.issn.0366-6964.2015.05.009
2014-06-25
国家自然科学基金(31201868);山西省科技攻关项目(20120311024-2)
刘 彧(1989-),女,山东安丘人,硕士生,主要从事羊驼毛色研究,Tel:0354-6288980,E-mail:18404966089@163.com
*通信作者:范瑞文,教授,主要从事动物解剖学与组织胚胎学教学与科研工作,E-mail:ruiwenfan@163.com
S852.2
A
0366-6964(2015)05-0746-06

