8-OHdG在不同级别胶质瘤中的表达及意义*
西安交通大学医学院第一附属医院神经外科(西安710061)
廉民学 冯鸿飞△ 姜海涛 梁 晨 郭世文▲
8-OHdG在不同级别胶质瘤中的表达及意义*
△陕西省洛南县医院神经外科
▲通讯作者
西安交通大学医学院第一附属医院神经外科(西安710061)
廉民学 冯鸿飞△姜海涛 梁 晨 郭世文▲
目的:探讨8-羟基脱氧鸟苷(8-OHdG)在不同级别胶质瘤中的表达及其意义。方法:采用免疫组化SP法检测45例不同级别胶质瘤组织中8-OHdG的表达,并结合临床资料分析其与胶质瘤临床特征之间的关系。结果:DNA氧化性损伤标志物8-OHdG在高级别(Ⅲ~Ⅳ级)胶质瘤中的表达强于低级别(Ⅰ~Ⅱ级)胶质瘤,在不同性别、年龄的胶质瘤患者中8-OHdG的表达差异无统计学意义。结论:高级别胶质瘤组织中的DNA氧化性损伤较低级别严重,8-OHdG可作为胶质瘤病理级别的辅助性诊断指标。
胶质瘤是颅内最常见的恶性肿瘤其预后与其病理级别关系密切,高级别胶质瘤尤其是间变性星型细胞瘤(WHO Ⅲ级)和胶质母细胞瘤(WHO Ⅳ级)平均生存期分别为30~36个月和10~15个月[1]。虽然低级别胶质瘤的预后较高级别胶质瘤好,但胶质瘤复发时往往伴有病理级别的进展,这种病理级别进展的机制目前尚不明确,可能与基因组的改变有关[2-3]。由于脑组织的特殊性,使其容易遭受氧化性损伤,尤其是胶质瘤术后脑组织的出血、小血管痉挛、脑水肿、再灌注损伤及炎症反应等,更是加重了细胞的氧化性损伤。在DNA 氧化损伤中,8-羟基脱氧鸟苷﹙8-hydroxy deoxyguanosine,8-OHdG﹚是最具代表性的损伤产物,已成为目前评估氧化应激和DNA氧化损伤的常用敏感生物标志物[4]。8-OHdG在胶质瘤组织中的表达国内外尚未见报道。本研究采用免疫组化SP法检测不同级别胶质瘤组织中8-OHdG的表达情况,并结合临床资料分析其与胶质瘤临床特征的关系及意义。
材料与方法
1 材 料 ①标本:选取我院2011年1月至2011年12月行手术治疗的胶质瘤标本共45例,经病理证实均为胶质瘤。其中星型细胞瘤38例,少突胶质细胞瘤4例,胶质母细胞瘤3例。男26例,女19例,年龄25~72岁,平均年龄49.40±12.74岁。按WHO胶质瘤分级标准(2007年)分级,Ⅰ级7例、Ⅱ级22例、Ⅲ级12例、Ⅳ级4例。②试剂:8-OHdG单克隆抗体N45.1购自亚诺法生技股份有限公司(Abnova, Taiwan),DAB显色试剂盒、SP试剂盒均购自福州迈新生物技术公司。
2 方 法 标本常规石蜡包埋制成4μm切片,采用免疫组化SP法进行染色。石蜡切片常规脱蜡水化,微波抗原修复,依次滴加过氧化物酶阻断液(37℃封闭10min)、10%非免疫性动物血清(37℃孵育40min)、8-OHdG一抗工作液(1∶200稀释,4℃孵育过夜)、生物素标记的二抗(37℃孵育20min)、S-A/HRP(37℃孵育20min),DAB显色,苏木精复染,脱水透明,中性树胶封片。用已知表达8-OHdG蛋白阳性的皮肤组织作为阳性对照,用磷酸盐缓冲液(PBS)代替一抗作为阴性对照。
3 结果判定 细胞核出现棕黄色颗粒为阳性细胞,每张切片400倍光镜下连续观察5个视野,计数细胞,根据阳性细胞的比率和染色深度分别评估,最后综合评定。阳性细胞的比率评分:0分为阳性细胞数占总细胞数<10%,1分为阳性细胞占总细胞数11%~25%,2分为阳性细胞数占总细胞数26%~50%,3分为阳性细胞数占总细胞数>50%。染色深度评分:0分为无染色,1分为淡黄色,3分为棕黄色,2分为染色强度介于1分和3分之间。总分=阳性细胞比率评分+染色深度评分:0分为阴性(-),1~2分为弱阳性(+),3~4分为中强阳性(),5~6分为强阳性()。
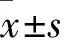
结 果
1 不同级别胶质瘤临床特征比较 见表1。高级别组和低级别组胶质瘤患者的性别构成差异无统计学意义(P>0.05);而且,高级别组胶质瘤患者年龄(51.00±12.65岁)与低级别组患者年龄(48.00±12.68岁)之间亦无统计学差异(P>0.05)。

表1 不同级别胶质瘤患者年龄、性别的比较
注:年龄的比较采用t检验,性别比较采用卡方检验
2 8-OHdG在不同级别胶质瘤中的表达 见表2。8-OHdG定位于细胞核,阳性着色为黄色或棕黄色核着色(见附图)。低级别(Ⅰ~Ⅱ级)组8-OHdG表达强度中度或强阳性(~)者占13.79%(4/29),而高级别(Ⅲ~Ⅳ级)组占50%(8/16),两组间的差异具有统计学意义(P<0.05)。
3 8-OHdG表达与胶质瘤临床特征之间的关系 见表3。在男性胶质瘤患者中,8-OHdG表达中度或强阳性(~)者占26.92%(7/26),在女性胶质瘤患者中占26.31%(5/19),两者之间的差异无统计学意义(χ2=0.020,P=0.964)。50岁以下患者8-OHdG表达强度中度或强阳性(~)者占33.33%(7/21),50岁以上患者占20.83%(5/24),两者之间差异也无统计学意义(χ2=0.895,P=0.344)。

表2 8-OHdG在不同级别胶质瘤中表达的比较
注:χ2=6.912,P=0.014
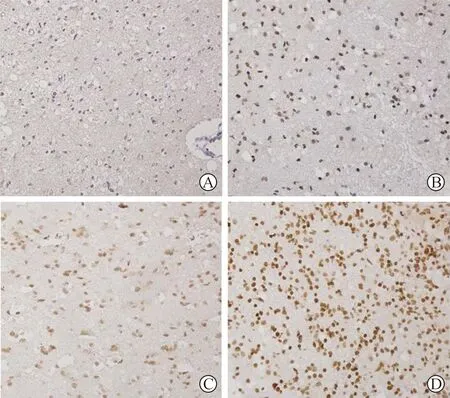
A:Ⅰ级; B:Ⅱ级; C:Ⅲ级; D:Ⅳ级
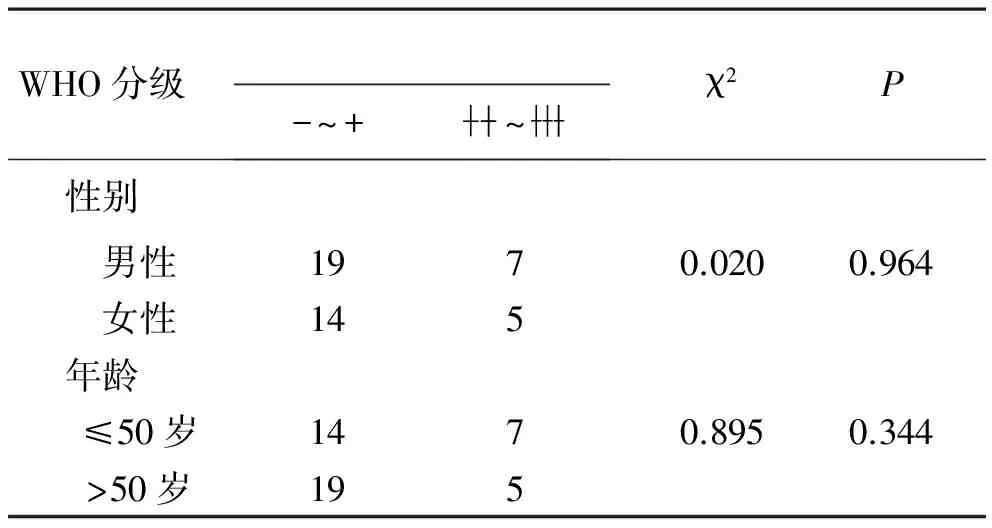
表3 8-OHdG在不同性别、年龄组中表达的比较
注:年龄、性别比较均采用卡方检验
讨 论
活性氧(ROS)是氧化应激主要的表现形式,过多的自由基可以直接引起生物脂质膜的过氧化、细胞内蛋白质变性、DNA损伤,从而导致细胞受损,其中活性最强的ROS表现形式是羟自由基(HO.)。DNA中所有的嘌呤和嘧啶均可能受到ROS的攻击,但以鸟嘌呤(G)最易被修饰。羟自由基攻击DNA链上的鸟嘌呤碱基,使C-8位发生羟化而生成8-羟基脱氧鸟苷(8-OHdG),后者是DNA氧化损伤的主要产物之一[5]。
8-OHdG代表DNA氧化性损伤程度,意味着细胞内ROS产生过多、抗氧化系统异常或DNA修复系统缺陷。内源性的ROS产生主要来源于线粒体,与呼吸链的电子传递有关,当该过程受到抑制时细胞内ROS会明显升高[6]。ROS的促肿瘤作用体现在直接或间接两方面。前者指ROS对基因组DNA的直接损伤,比如所形成的8-OHdG可以与C以外的其他碱基配对形成点突变,其中GC-TA突变的发生已被大量研究证实[7]。另外ROS可以作为信号转导的分子,激活包括NF-κB、AP-1等在内的转录因子,导致与细胞生长相关的基因转录异常,间接导致肿瘤的发生[8]。机体的抗氧化系统分为酶和非酶系统两大类,前者包括超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化氢酶,后者包括维生素C、维生素E、谷胱甘肽、硫氧还原蛋白等,在维持细胞内氧化还原平衡状态中具有重要意义。在一般情况下机体修复机制正常时,8-OHdG等DNA氧化性损伤产物可以在人8-羟基鸟嘌呤糖苷酶(hOGG1)等的作用下从DNA链上切除并重新掺入正常的鸟嘌呤碱基,避免由于错配导致的基因突变[9]。
目前,8-OHdG在胶质瘤组织中的表达国内外尚未见报道。本研究采用免疫组化法检测胶质瘤组织中的8-OHdG表达水平,结果表明:8-OHdG在高级别(Ⅲ~Ⅳ级)胶质瘤中的表达强于低级别(Ⅰ~Ⅱ级)胶质瘤,提示8-OHdG所代表的DNA氧化性损伤在胶质瘤的发生、病理级别进展中具有重要意义。胶质瘤的病理级别与其预后密切相关,研究显示低级别胶质瘤较高级别胶质瘤无进展生存期长28个月[10]。但是初发胶质瘤并非停滞不前,复发的胶质瘤往往伴随有病理级别的进展。这种病理级别进展的机制目前尚不明确,通过基因芯片等多方面的研究表明胶质瘤病理级别的进展可能与肿瘤基因组改变有关。黄强等通过基因芯片发现197条在恶性进展胶质瘤中高表达的基因,并通过生物信息学方法分析出其中17条与胶质瘤发生发展相关[3]。而8-OHdG形成所导致的碱基错配是基因突变的一个重要原因,因此胶质瘤的进展可能与细胞内持续性的DNA氧化性损伤相关。
由于大脑的高代谢活性、相对性低抗氧化系统、低DNA修复能力,导致胶质细胞容易受到氧化性损伤。尤其是对于胶质瘤术后患者,手术创伤导致的出血、小血管痉挛、脑水肿、再灌注损伤及炎症反应,均可以加重氧化性损伤[11]。另外脑组织较其他组织含有更多的金属离子(比如铁离子),这些金属离子在催化过氧化氢形成高活性的羟自由基中是必需的,羟自由基是最具损伤性的活性分子,这也是脑组织容易遭受氧化性损伤的重要原因[12]。本研究从氧化损伤方面揭示了胶质瘤的发生、发展机制,同时也提示对于胶质瘤术后患者给予自由基清除剂、抗氧化剂等药物可能减轻胶质瘤术后氧化性损伤,防止DNA损伤加重导致疾病恶化。另一方面,本研究结果提示8-OHdG可作为胶质瘤进展的辅助性生物标记物。
[1] 陈忠平.胶质瘤治疗的困惑与思考[J].中华神经外科杂志,2008,24(4):310-311.
[2] Masica DL,Karchin R.Correlation of somatic mutation and expression identifies genes important in human glioblastoma progression and survival[J].Cancer Res,2011,71(13):4550-4561.
[3] 黄 强,董 军,王爱东,等.建立人脑胶质瘤恶性进展相关基因表达谱[J].中华肿瘤杂志,2003,25(5):437-440.
[4] Ock CY, Kim EH, Choi DJ,etal. 8-Hydroxydeoxyguanosine:not mere biomarker for oxidative stress, but remedy for oxidative stress-implicated gastrointestinal diseases[J].World J Gastroenterol,2012,18(4):302-308.
[5] Valavanidis A,Vlachogianni T,Fiotakis C.8-hydroxy-2'-deoxyguanosine (8-OHdG): A critical biomarker of oxidative stress and carcinogenesis[J].J Environ Sci Health C Environ Carcinog Ecotoxicol Rev,2009,27(2):120-139.
[6] Indo HP,Davidson M,Yen HC,etal. Evidence of ROS generation by mitochondria in cells with impaired electron transport chain and mitochondrial DNA damage[J].Mitochondrion,2007,7 (1-2):106-118.
[7] Kryston TB,Georgiev AB,Pissis P,etal.Role of oxidative stress and DNA damage in human carcinogenesis[J].Mutation Research,2011,711(1-2):193-201.
[8] Park SA, Na HK, Surh YJ. Resveratrol suppresses 4-hydroxyestradiol-induced transformation of human breast epithelial cells by blocking IκB kinaseβ-NF-κB signaling [J]. Free Radic Res, 2012,46(8):1051-1057.
[9] Karger S,Krause K,Engelhardt C,etal.Distinct pattern of oxidative DNA damage and DNA repair in follicular thyroid tumours[J].J Mol Endocrinol,2012,48(3):193-202.
[10] 王春琳,卢亦成,陈菊祥,等.胼胝体胶质瘤的预后影响因素(附60例分析)[J].中华神经医学杂志,2009,8 (8):820-824.
[11] Dokic I,Hartmann C,Herold-mende C,etal.Glutathione peroxidase 1 activity dictates the sensitivity of glioblastoma cells to oxidative stress[J].Glia,2012,60(11):1785-1800
[12] Deng X, Vidal R, Englander EW. Accumulation of oxidative DNA damage in brain mitochondria in mouse model of hereditary ferritinopathy[J].Neurosci Lett,2010,479(1):44-48.
(收稿:2014-09-22)
Expression and significance of 8-OHdG in different graded glioma
Department of Neurosurgery, The First Affiliated Hospital of Medical College of Xi’an Jiaotong University(Xi’an 710061)
Lian Minxue Feng Hongfei Jiang Haitao et al
Objective:To evaluate the expression and significance of 8-hydroxy deoxyguanosine (8-OHdG) in different degraded glioma.Methods:SP immunohistochemistry was employed to detect the expression of 8-OHdG in forty-five different degraded glioma,and the relationship between the expression of 8-OHdG and clinical features of glioma was analyzed.Results:The expression of 8-OHdG was stronger in high grade glioma (Ⅲ~Ⅳ grade) group than that in low grade glioma (Ⅰ~Ⅱ grade) group, and there was no statistical significance of 8-OHdG expression in different age and gender glioma patients. Conclusion:DNA oxidative damages is much serious in high grade glioma tissues. 8-OHdG can be a marker for the pathological diagnosis of glioma.
Glioma Immunohistochemistry @Oxidative damage @8-hydroxy deoxyguanosine
神经胶质瘤 免疫组织化学 @氧化损伤 @8-羟基脱氧鸟苷
R739.41
A
10.3969/j.issn.1000-7377.2015.02.009
*陕西省科学技术研究发展计划项目(2012K13-02-14)

