孕激素对人绒毛滋养层细胞表达ADAM10、Ob-R 及分泌SLR、LEP 的影响
甘 蕾,李 真,吴晓华,应德美,陈莉萍 (第三军医大学新桥医院妇产科,重庆400037)
黄体和胎盘组织分泌的孕激素(progesterone,P)对维持妊娠有至关重要的作用,在对孕激素与代谢相关性疾病的研究中发现,孕激素可引起糖耐量降低,增加胰岛素抵抗(insulin resistance,IR)[1],还可调控脂蛋白脂酶活性,促进脂质合成[2],引起糖脂代谢失衡。本课题组前期研究发现妊娠期糖耐量异常的患者血瘦素(leptin,LEP)浓度变化与孕激素水平相关[3]。孕激素水平增高,可否引起瘦素功能异常,参与妊娠期糖尿病(gestational diabetes mellitus,GDM)发生,尚待探讨。孕期胎盘组织可合成瘦素[4],瘦素的生物功能除了与瘦素浓度的相关外还与瘦素受体密切相关,其中可溶性的瘦素受体(soulbe leptin receptor,SLR)被认为是瘦素敏感性的标志[5]。SLR 参与体内瘦素的运输、调控瘦素的浓度,影响瘦素的生物活性[6]。而对SLR 的研究,并未发现编码SLR 生成的基因片段[5],有学者提出SLR 可能是基质金属蛋白酶10 (a disintegrin and metalloprotease 10,ADAM10)介导长型瘦素受体(leptin receptor,Ob-R)胞外区脱落产生[5]。基于此,本实验通过体外培养早孕人绒毛细胞滋养层细胞,探讨不同浓度孕激素对人绒毛滋养层细胞表达的ADAM10、Ob-R及分泌SLR、LEP 的影响。
1 材料与方法
1.1 材料
绒毛组织采集于第三军医大学新桥医院妇产科门诊,正常妊娠6 ~10 周,经超声证实为宫内妊娠,自愿选择人工流产终止妊娠的健康妇女,经负压吸宫术获得的绒毛组织。将其置于预冷的含有双抗的无菌DMEM-F12 培养基内,迅速转移至超净工作台中分离培养细胞。本研究遵循第三军医大学附属新桥医院生物医学研究伦理委员会所制定的伦理学标准,得到该委员会的批准。
1.2 人早孕绒毛滋养层细胞的分离、培养
用DMEM-F12 培养基反复冲洗绒毛组织,去除血污、蜕膜及肉眼可见的血管组织,用眼科剪剪碎为1 mm ×1 mm 左右大小的碎屑。加入适量的0.25% 的胰蛋白酶在常温下消化20 min,其间进行适当地吹打,任其自然沉淀,按1∶1 的体积加入含有20%胎牛血清的DMEM-F12 培养基中和胰酶作用,吸出上清液,未消化组织重复消化2 次,将吸取的上清液经200目筛网滤过,吸取滤过液于离心管中,以800 r/min ×5 min 离心,倒掉上清液,加入含有20%胎牛血清的DMEM-F12 培养基,反复吹打,吸入培养瓶内,放入37 ℃、5%CO2的培养箱。培养24 h后,换掉一半的培养基,继续培养72 h,换液,以后每隔48 h 换液1 次。
1.3 人绒毛滋养层细胞鉴定
培养的第一代细胞,采用S-P 法检测细胞内抗-细胞角蛋白7 抗体和抗-细胞波形蛋白抗体,进行滋养层细胞鉴定。
1.4 不同浓度孕激素培养人绒毛滋养层细胞
采用胰蛋白酶消化后生长状态良好的滋养层细胞,台盼蓝染色、计数、按每孔1 ×106/mL 接种于12 孔板中。使用无血清的DMEM-F12 培养基培养24 h 后,观察细胞贴壁情况,吸掉培养基,分为4 组,分别加入含有0、100、150、200 ng/mL 孕激素的培养基,培养24 h 后收集细胞及上清液。
1.5 WB 法检测细胞内ADAM10、Ob-R 的表达
采用PMSF/RIPA 裂解液说明书上的步骤提取蛋白,用BCA 试剂盒检测蛋白含量,计算上样量,取蛋白样品50 μg 进行电泳、转膜、封闭、孵育一抗,4 ℃冰箱隔夜孵育,TBST 洗膜,孵育二抗,洗膜,ECL 发光液反应,曝光。凝胶成像系统扫描仪成像。用Image J 软件进行定量分析。
1.6 ELISA 法检测上清液中SLR、LEP 的表达量
根据ELISA 试剂盒上的相关操作说明,检测细胞上清液中SLR 及LEP 的表达量。
1.7 统计学处理
采用SPSS 19.0 软件进行统计学分析,单因素方差分析比较各物质组间差异性,结果用均数±标准差表示。采用Pearson 检验各物质间的相关性。P <0.05 表示差异具有统计学意义,P <0.01 表示具有显著性差异。
2 结果
2.1 胰蛋白酶消化法培养人绒毛滋养层细胞
倒置显微镜下见细胞呈上皮细胞样生长,细胞体积大呈长多边形,胞浆丰富,核呈卵圆形,个别细胞呈纤维细胞样,生长成片(图1)。
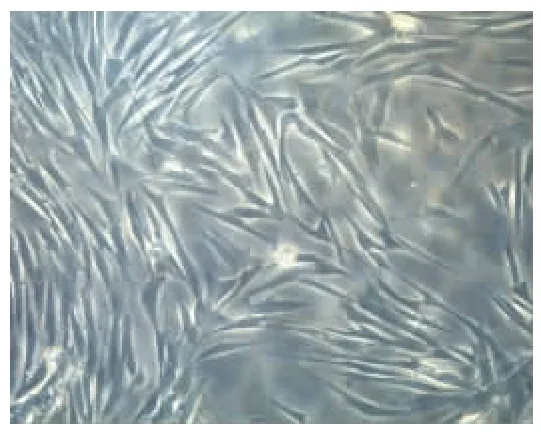
图1 倒置显微镜下观察体外培养的人绒毛滋养层细胞(×200)
2.2 免疫组化法鉴定人绒毛滋养层细胞
DAB 显色后的阳性信号为胞浆中呈棕黄色颗粒,胎盘组织滋养层细胞的角蛋白染色阳性,着色于胞浆(图2a),波形蛋白染色阴性(图2b)。体外培养的细胞中细胞角蛋白阳性率约90%。

图2 免疫组化法鉴定人绒毛滋养层细胞
2.3 孕激素影响细胞内ADAM10 和Ob-R 的表达
人胎盘绒毛滋养层细胞表达ADAM10 的含量随着与激素浓度的增加而增加(P <0.05)。孕激素对Ob-R 随着孕激素浓度的增高组间两两比较无显著性差异(P >0.05),但仍可看出随着孕激素浓度的增高,Ob-R 的表达有逐渐上升趋势(图3,表1)。

图3 WB 法检测不同浓度孕激素对ADAM10 及Ob-R 的影响
2.4 孕激素影响细胞对SLR、LEP 的分泌
胎盘组织合成和分泌的SLR 随着孕激素浓度增加而逐渐减少(P <0.01),而LEP 含量随着孕激素浓度的增加而增加(P <0.01),见表2。
表1 不同浓度孕激素对胎盘人绒毛滋养层细胞表达ADAM10、Ob-R 的影响(±s)

表1 不同浓度孕激素对胎盘人绒毛滋养层细胞表达ADAM10、Ob-R 的影响(±s)
* :与对空白组(0 ng/mL)比较,P <0.05;#:与对空白组(0 ng/mL)比较,P <0.01
?
表2 不同浓度孕激素对胎盘人绒毛滋养层细胞分泌SLR 及LEP 的影响(±s)

表2 不同浓度孕激素对胎盘人绒毛滋养层细胞分泌SLR 及LEP 的影响(±s)
* :与对空白组(0 ng/mL)比较,P <0.01
?
2.5 Pearson 检验各因素之间相关性结果
采用SPSS 19.0 软件分析比较人绒毛滋养层细胞表达的各物质之间的相关性。SLR 的表达与LEP 的表达存在显著性负相关(R= -0.949,P <0.01),ADAM10 与Ob-R 的表达不存在明显相关性(R= -0.425,P >0.05)。
3 讨论
3.1 孕激素与GDM 发生的相关性
妊娠期糖尿病是指妊娠期首次发生或者发现的任何程度的糖耐量异常,其病理特征是高胰岛素血症、高瘦素血症所伴随的糖脂代谢紊乱。国内外对孕激素与妊娠期糖尿病的相关性研究发现,妊娠期糖耐量异常的患者血孕激素水平显著高于正常妊娠产妇[3,7]。而关于口服避孕药与GDM 相关性的研究,发现孕龄期女性孕前使用口服避孕药GDM 发生率增高[8],有GDM 史女性服用孕激素类避孕药产后5 ~10 年发生2型糖尿病风险约为20% ~60%[9]。此外,关于孕激素治疗复发性流产人群,研究发现其可导致糖耐量降低和GDM 的发生率增加[8,10]。
孕激素参与GDM 发生主要是通过影响糖脂代谢所致。孕激素可导致空腹血糖升高及胰岛素抵抗。Yeung 等[11]发现人黄体期胰岛素抵抗稳态模式(HOMA-IR)与血清孕激素水平增加相关。动物实验研究发现,外源性地给予大鼠孕激素可导致胰岛素敏感性下降而血糖增高[12-13],此外,Sissan 等[14]研究发现孕激素可通过抑制肝脏苹果酸脱氢酶和6-磷酸葡萄糖脱氢酶的活性,导致葡萄糖利用障碍,血糖升高。而关于孕激素影响脂代谢主要表现为影响脂蛋白酯酶的活性[1]。Sissan 等[14]研究还发现孕激素可增加脂肪组织脂蛋白酯酶的活性,使脂肪组织分解增加,血脂升高。
3.2 孕激素调控瘦素功能发挥影响GDM 发病
GDM 的发病通常在孕激素水平很高的妊娠中期[15],说明孕激素在GDM 发生和发展进程中起着某种作用。而目前临床上对于孕激素参与糖脂代谢异常的发病机制尚不清楚,早期研究发现孕激素对胰岛素的分泌及信号传导有重要作用[8]。近年来随着对瘦素的深入研究发现,瘦素与胰岛素存在着复杂的关系,他们共同参与调节糖脂代谢,与妊娠期糖尿病、肥胖、2 型糖尿病等代谢综合征密切相关。女性妊娠状态下血瘦素浓度约为非孕时期的2 ~3 倍,且在孕28 周达到高峰[16]。在对瘦素与GDM 相关性研究发现,血清瘦素每增加10 ng/mL,GDM 发生风险相应增加20%[17]。
妊娠期瘦素的合成和分泌受到胎盘组织合成和分泌的多种激素(如人绒毛膜促性腺激素、胎盘泌乳素、雌激素、孕激素等)的影响,关于孕激素与瘦素之间的相关性存在许多矛盾性研究[3,18-20]。目前临床研究上暂无文献表明孕激素可通过某种具体的路径影响瘦素分泌参与GDM 发生,而瘦素功能的发挥不仅仅受到瘦素浓度的影响还受到瘦素受体的影响。孕激素是通过调控瘦素的分泌还是通过调控瘦素受体表达参与GDM 发生,尚不清楚。
瘦素与瘦素受体结合参与细胞信号传导,瘦素受体的表达是维持正常妊娠所必需的[21]。瘦素受体属于I 类细胞因子受体家族,其中重要的瘦素受体包括长型受体(Ob-R)-参与细胞内信号转导和SLR-调控瘦素浓度及瘦素生物活性。人的胎盘滋养层细胞表达瘦素及瘦素受体[22]。从瘦素受体表达来看,GDM 孕妇胎盘上的瘦素受体表达高于正常妊娠孕妇[17]。而对瘦素基因的研究发现,瘦素受体Gln223Arg 与胰岛素抵抗、高瘦素血症及肥胖密切相关[23-25]。瘦素受体的表达与GDM 发生相关,而孕激素可否通过某种路径作用于瘦素受体,目前尚无相关文献报道。我们的研究发现孕激素影响早孕人绒毛滋养层细胞ADAM10的表达及SLR、LEP 分泌,而对Ob-R 的表达无显著影响。
关于SLR 的研究,并未发现编码SLR 合成的特异mRNA,有学者认为SLR 可由金属蛋白酶参与长型瘦素受体(Ob-R)脱落的产生[26]。Schaab 等[5]发现ADAM10 参与了SLR 的产生。国外学者在对SLR 与一系列代谢性疾病的研究中发现,SLR 与肥胖、IR、2 型DM及其他代谢相关危险因子(血压、甘油三酯浓度、低密度脂蛋白浓度、空腹血糖浓度)呈显著的负相关,SLR与高密度脂蛋白(HDL)呈正相关,SLR 被认为可以预测糖尿病及代谢综合征发生的因子[5]。基于此,本实验探讨孕激素与人绒毛滋养层细胞内的ADAM10、Ob-R 及上清液中LEP 及SLR 表达的相关性,寻求可能存在的GDM 发病机制。我们研究发现SLR 的表达与LEP 的表达存在显著性负相关(R= -0.949,P=0.000),ADAM10 与Ob-R 的表达无明显相关性(R = -0.425,P >0.05)。因此,本课题组认为孕激素增高可通某种路径,调控ADAM10 的表达,影响SLR 的生成,引起瘦素功能发挥异常,导致糖脂代谢紊乱,参与GDM 发生。而关于孕激素通过何种路径影响ADAM10,是本课题组下一步将探讨的问题。
[1]Kuhl C.Insulin secretion and insulin resistance in pregnancy and GDM.Implications for diagnosis and management[J].Diabetes,1991,40 (S2):18 -24.
[2]Miko E,Halasz M,Jericevic-Mulac B,et al.Progesterone-induced blocking factor (PIBF)and trophoblast invasiveness[J].J Reprod Immunol,2011,90(1):50 -57.
[3]陈正琼,成 娅,陈浩波,等.妊娠期糖耐量异常患者血清E2、P、PRL 水平变化及其与瘦素水平的关系[J].重庆医学,2006,35(6):528 -529
[4]Linnemann K,Malek A,Sager R,et al.Leptin production and release in the dually in vitro perfused human placenta[J].J Clin Endocrinol Metab,2000,85(11):4298 -4301.
[5]Schaab M,Kausch H,Klammt J,et al.Novel regulatory mechanisms for generation of the soluble leptin receptor:implications for leptin action[J].PLoS One,2012,7(4):e34787.
[6]Cohen SE,Kokkotou E,Biddinger SB,et al.High circulating leptin receptors with normal leptin sensitivity in liver-specific insulin receptor knock-out (LIRKO)mice[J].J Biol Chem,2007,282(32):23672 -23678.
[7]Park S,Kim MY,Baik SH,et al.Gestational diabetes is associated with high energy and saturated fat intakes and with low plasma visfatin and adiponectin levels independent of prepregnancy BMI[J].Eur J Clin Nutr,2013,67(2):196 -201.
[8]Rebarber A,Istwan NB,Russo-Stieglitz K,et al.Increased incidence of gestational diabetes in women receiving prophylactic 17alphahydroxyprogesterone caproate for prevention of recurrent preterm delivery[J].Diabetes Care,2007,30(9):2277 -2280.
[9]Xiang AH,Kjos SL,Takayanagi M,et al.Detailed physiological characterization of the development of type 2 diabetes in Hispanic women with prior gestational diabetes mellitus[J].Diabetes,2010,59(10):2625 -2630.
[10]Waters TP,Schultz BA,Mercer BM,et al.Effect of 17alpha-hydroxyprogesterone caproate on glucose intolerance in pregnancy[J].Obstet Gynecol,2009,114(1):45 -49.
[11]Yeung EH,Zhang C,Mumford SL,et al.Longitudinal study of insulin resistance and sex hormones over the menstrual cycle:the BioCycle Study[J].J Clin Endocrinol Metab,2010,95(12):5435 -5442.
[12]Gonzalez C,Alonso A,Alvarez N,et al.Role of 17beta-estradiol and/or progesterone on insulin sensitivity in the rat:implications during pregnancy[J].J Endocrinol,2000,166(2):283 -291.
[13] Picard F,Wanatabe M,Schoonjans K,et al.Progesterone receptor knockout mice have an improved glucose homeostasis secondary to beta-cell proliferation[J].Proc Natl Acad Sci USA,2002,99 (24):15644 -15648.
[14]Sissan MA,Leelamma S.Influence of components of oral contraceptive on lipid metabolism[J].Indian J Exp Biol,1996,34(2):131 -134.
[15]Kim C,Newton KM,Knopp RH.Gestational diabetes and the incidence of type 2 diabetes:a systematic review[J].Diabetes Care,2002,25(10):1862 -1868.
[16]Schubring C,Englaro P,Siebler T,et al.Longitudinal analysis of maternal serum leptin levels during pregnancy,at birth and up to six weeks after birth:relation to body mass index,skinfolds,sex steroids and umbilical cord blood leptin levels[J].Horm Res,1998,50 (5):276 -283.
[17]Perez-Perez A,Maymo JL,Gambino YP,et al.Activated translation signaling in placenta from pregnant women with gestational diabetes mellitus:possible role of leptin[J].Horm Metab Res,2013,45(6):436 -442.
[18]Stelmanska E,Kmiec Z,Swierczynski J.The gender-and fat depot-specific regulation of leptin,resistin and adiponectin genes expression by progesterone in rat[J].J Steroid Biochem Mol Biol,2012,132(1 -2):160 -167.
[19]Kumar L,Panda RP,Hyder I,et al.Expression of leptin and its receptor in corpus luteum during estrous cycle in buffalo (Bubalus bubalis)[J].Anim Reprod Sci,2012,135(1 -4):8 -17.
[20]Lin Q,Poon SL,Chen J,et al.Leptin interferes with 3’,5’-cyclic adenosine monophosphate (cAMP)signaling to inhibit steroidogenesis in human granulosa cells[J].Reprod Biol Endocrinol,2009,7:115.
[21]Ramos MP,Rueda BR,Leavis PC,et al.Leptin serves as an upstream activator of an obligatory signaling cascade in the embryo-implantation process[J].Endocrinology,2005,146(2):694 -701.
[22]Koshiba H,Kitawaki J,Ishihara H,et al.Progesterone inhibition of functional leptin receptor mRNA expression in human endometr ium[J].Mol Hum Reprod,2001,7(6):567 -572.
[23]Yang GP,Peng SH,Zuo SY,et al.Meta-analysis on the relationship between leptin receptor Gln223Arg and Pro1019Pro gene polymorphism and obesity in the Chinese population[J].Zhonghua Liu Xing Bing Xue Za Zhi,2011,32(10):1037 -1042.
[24]Aijala M,Santaniemi M,Bloigu R,et al.Leptin receptor Arg109 homozygotes display decreased total mortality as well as lower incidence of cardiovascular disease and related death[J].Gene,2014,534(1):88 -92.
[25]Okada T,Ohzeki T,Nakagawa Y,et al.Impact of leptin and leptin-receptor gene polymorphisms on serum lipids in Japanese obese childr en[J].Acta Paediatr,2010,99(8):1213 -1217.
[26]Hamnvik OP,Liu X,Petrou M,et al.Soluble leptin receptor and leptin are associated with baseline adiposity and metabolic risk factors,and predict adiposity,metabolic syndrome,and glucose levels at 2-year follow-up:the Cyprus Metabolism Prospective Cohort Study[J].Metabolism,2011,60(7):987 -993.

