罗格列酮对高糖环境下人脐静脉内皮细胞作用的研究
杨明璨,熊鸿燕,林 辉 (.第三军医大学基础部人体解剖学教研室,重庆40008;.第三军医大学军事预防医学院流行病学教研室,重庆40008;.第三军医大学军事预防医学院热带研究所,重庆40008)
糖尿病是一种严重威胁人类健康的代谢性疾病,糖尿病的心血管病变是其最常见的一种并发症,也是导致患者死亡的重要原因[1-3]。因此糖尿病患者对组织工程血管的需求十分大,然而高糖引起的血管内皮细胞受损使得组织工程血管在糖尿病患者手术移植后通畅率很低,因此维持内皮细胞在高糖状态下的正常功能对于保持组织工程血管的通畅具有十分重要的意义[4]。AKT 通路是血管生成过程中至关重要的一个信号通路,研究表明它的阻断可以抑制内皮细胞分泌VEGF 和SDF-1 等促血管生成因子[5]。罗格列酮(Rosiglitazone)是一种降血糖药物,研究表明其具有控制血糖和改善胰岛素抵抗的作用[6],此外也有文献报道罗格列酮可减轻心肌缺血、抑制炎症,减少氧化应激反应,并对糖尿病慢性并发症有一定的预防和治疗作用[7-8]。然而目前还没有文献报道罗格列酮对高糖环境下内皮细胞功能的影响。内皮细胞具有抑制血栓形成和内膜增生的重要作用,然而高血糖环境下血管内皮细胞受到直接损伤,致使其功能发生紊乱,因此维持内皮细胞的正常功能对于组织工程血管的替代治疗具有十分重要的意义。本实验使用人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC),通过观察罗格列酮对高糖环境下内皮细胞促血管生成功能的影响,探讨其对糖尿病条件下病变血管替代治疗的潜在意义。
1 材料与方法
1.1 实验主要试剂
罗格列酮(Sigma),RPMI-1640 基础培养基(Hyclone 公司,美国),胎牛血清(Hyclone 公司,美国),血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质细胞衍生因子-1(SDF-1)、ELISA 试剂盒皆购于厦门慧嘉生物科技有限公司,Transwell 细胞培养小室(Corning 公司),4%多聚甲醛(Boster 公司),0.5%结晶紫(Sigma),AKT 抑制剂triciribine(Sigma)。
1.2 实验方法
1.2.1 细胞培养及实验分组 人脐静脉内皮细胞(HUVEC)购自ATCC (美国)。使用RPMI-1640 培养基,10%胎牛血清作为基础培养基,含5.6 mmol 和30 mmol 葡萄糖做为HUVEC 低糖和高糖培养基[8],5%CO2孵箱常规培养。采用加入低糖培养基常规培养方法为对照组、加入高糖培养基为高糖组、高糖组加入10 μmol 罗格列酮[9]为罗格列酮组,AKT 信号通路抑制组为在加入罗格列酮的同时加入5 μmol 的triciribine。
1.2.2 细胞增殖实验 我们采用MTT 实验检测HUVEC 的增殖能力[10]。取对数生长期的HUVEC,用胰酶消化后,按照4 000个/孔的密度传代到96 孔板中。细胞贴壁后,根据对HUVEC的分组给予因子刺激。24 h 后,每孔加入20 μl 的5 mg/mL MTT,37 ℃孵育4 h,去上清后每孔加入150 μl DMSO。使用Emax 酶标仪(Molecular Devices),OD490 nm 处测量各孔的吸光值。
1.2.3 细胞划痕实验 将HUVEC 种植于6 孔板中,待其长满,除对照组采用0.1%FBS 的正常培养基外,其余3 组均用0.1%FBS的高糖培养基培养24 h。取已消毒的P1000 枪头,垂直进行细胞划痕[11],清洗去除划下的细胞。按照实验分组给予因子刺激,之后放入37 ℃,5%CO2孵箱继续培养24 h。PBS 洗3 次后,用4%多聚甲醛固定后0.5%结晶紫对其染色。OLYMPUS BX50 显微镜(Japan)拍摄划痕图像(40 ×),使用IPP 软件(Media Cybernetics)测量0 h 以及24 h 的细胞创痕面积。
1.2.4 培养基中细胞因子检测 3 组HUVEC 于5%CO2孵箱常规培养48 h 后,将各组培养基用0.22 μm 针式滤器抽滤,采用RD 公司生产的ELISA 试剂盒,检测各组培养基中VEGF、SDF-1 的含量,进行的各种操作严格按照说明书上进行。
1.3 统计学方法
每组实验至少重复3 次。采用SPSS 18.0 统计软件进行统计分析,描述性数据采用平均值和百分比分析表示,实验数据采用t 检验或χ2检验闭合率,以P <0.05 为差异有统计学意义。
2 结果
2.1 罗格列酮对HUVEC 增殖的影响
从图1 可以看出相对于对照组,高糖可以显著抑制HUVEC的增殖,使细胞的增殖速率下降了55%;罗格列酮可以降低高糖对HUVEC 增殖的抑制作用,使细胞的增殖速率增加了102%;而AKT 抑制剂阻断了罗格列酮对HUVEC 增殖的影响,使其增殖速率下降了58%,各组之间差异明显,结果均具有统计学意义(P <0.05)。
2.2 罗格列酮对HUVEC 迁移的影响
我们采用划痕实验研究罗格列酮对HUVEC 迁移的影响。图2 结果显示,相对于对照组,高糖组的HUVEC 的划痕闭合面积下降了52%。罗格列酮降低了高糖对HUVEC 迁移功能的影响,使HUVEC 的划痕闭合面积相对于高糖组增加了64%。AKT 信号通路在这一过程中发挥着十分重要的作用,AKT 信号通路的阻断降低了罗格列酮对HUVEC 迁移的促进作用,HUVEC 的划痕闭合面积是罗格列酮组的21%。各组之间差异明显,结果均具有统计学意义(P <0.05)。
2.2 培养基中VEGF、SDF-1 含量的测定结果
用ELISA 试剂盒对各组培养基中VEGF、SDF-1 进行检测,结果见图3,从图中可以看出罗格列酮组培养基里VEGF、SDF-1的含量分别是高糖组的3.2 倍和3 倍。而AKT 抑制组中VEGF、SDF-1 的含量分别是罗格列酮组的1/2 和1/3。各组之间差异明显,结果均具有统计学意义(P <0.05)。这提示在高糖环境中,罗格列酮药物可以促进HUVEC 分泌细胞因子VEGF、SDF-1 分泌。AKT 信号通路的阻断抑制了罗格列酮对HUVEC 细胞因子的作用效果。

图1 罗格列酮对HUVEC 增殖的影响

图2 罗格列酮对HUVEC 迁移的影响划痕实验
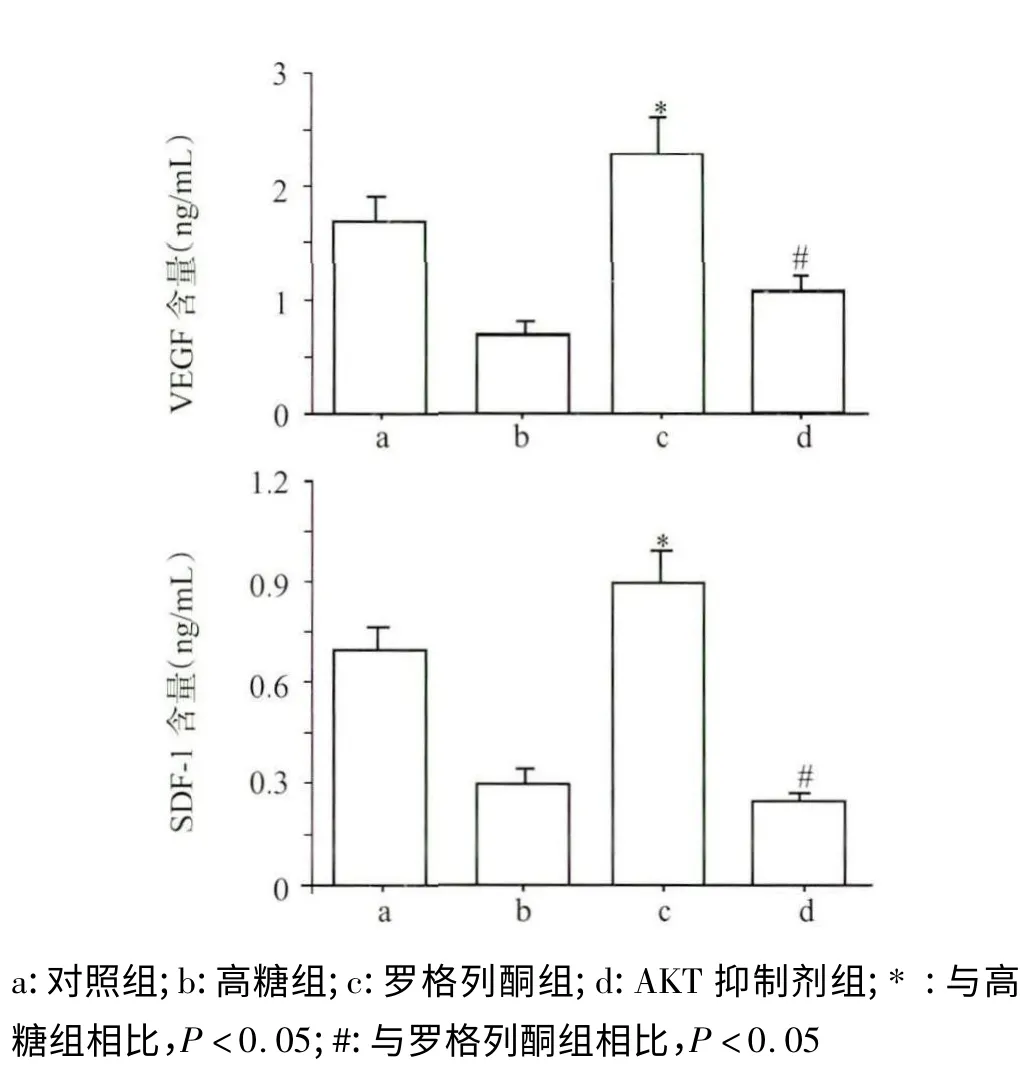
图3 培养基中VEGF、SDF-1 含量
3 讨论
目前全球糖尿病并发症的发病率逐年升高,而它在微血管病变和动脉硬化的基础上能产生多种慢性并发症,糖尿病的血管病变则是引起患者致残甚至致死的首要原因[12]。研究表明内皮细胞具有抑制血栓形成和内膜增生的重要作用,因此在组织工程血管移植后长期通畅的维持中发挥着关键性作用。然而高血糖环境下内皮细胞受到直接的损伤,使其功能发生紊乱,所以维持血管内皮细胞的正常功能对于组织工程血管的替代治疗具有十分重要的意义。在心血管系统的发生和重建过程中,PI3K-Akt 信号转导通路是至关重要的,研究[13]表明它的阻断可以抑制内皮细胞分泌VEGF 和SDF-1 等促血管生成因子,通过研究证实AKT 信号通路发挥着重要作用。
罗格列酮作为降血糖药物,已经广泛应用于糖尿病的治疗缓解,国外文献[14-15]报道罗格列酮可以具有减轻心肌缺血、抑制炎症、减少氧化应激反应,并对糖尿病慢性并发症有一定的预防和治疗作用,然而在高糖环境下罗格列酮对血管内皮细胞的影响尚不明确。在实验中,我们使用降糖药物罗格列酮作用于高糖环境培养的HUVEC,研究发现在罗格列酮组在药物作用的影响下,HUVEC 的增殖明显高于高糖组。在细胞划痕实验中,罗格列酮组的HUVEC 划痕闭合率同样高于高糖组,并且效果十分明显。可见在高糖环境下,降糖药物罗格列酮能够促进HUVEC 的增殖和迁移,而增殖、迁移以及旁分泌是血管内皮细胞发挥促血管生成功能的重要机制。国外已有研究[16]表明,VEGF(血管内皮生长因子)、SDF-1(基质细胞衍生因子-1)均能刺激血管的形成,其中VEGF 是血管内皮细胞的特异性生长因子,是现阶段最有效的血管生成因子,能增加血管通透性,促进HUVEC 分裂和增殖,和血管新生密切相关。SDF-1 可以促进HUVEC 增殖,加速血管生成[17]。各组培养基采用ELISA 检测的方法,显示出罗格列酮组VEGF、SDF-1 含量明显高于高糖组。这再次证实了相关结论,并且提示我们高糖环境下罗格列酮不仅能够促进HUVEC 的增殖和迁移,同时在旁分泌方面也起着促进HUVEC 分泌相应的细胞分子的作用,对血管新生有着重要的影响。通过本研究我们发现降糖药物罗格列酮可以在高糖环境下保护血管内皮细胞免受高糖环境的损伤,维持内皮细胞的正常促血管生成功能。因此,我们认为罗格列酮可以作为组织工程血管移植后的一种治疗药物,在降低血糖的同时保护迁移到组织工程血管表面的内皮细胞正常功能。
综上所述,通过罗格列酮对高糖环境下血管内皮细胞的作用研究表明,此药物对高糖环境下的HUVEC有着活化作用,ATK 信号通路在这一过程中发挥着关键性作用,而这种活化作用的具体机制有待进一步研究。
[1]代庆红,王忠东.中国糖尿病的现状调查[J].中国医药指南,2011,9(13):206 -208.
[2]王鑫蕾,崔世维.2 型糖尿病患者糖尿病防治知识认知程度与控制现状分析[J].交通医学,2012,26(6):587 -589.
[3]钱寒光,朱栋晓,祝建中,等.骨髓间充质干细胞自体移植促进缺血肢体血管生成的实验研究[J].中国微循环,2007,11(5):303 -305.
[4]Cavanagh PR,Lipsky BA,Bradbury AW,et al.Treatment for diabetic foot ulcers[J].Lancet,2005,366(9498):1725 -1735.
[5]Shiojima I,Walsh K.Role of Akt signaling in vascular homeostasis and angiogenesis[J].Circ Res,2002,90(12):1243 -1250.
[6]钱红霞,李新胜,付冬霞,等.罗格列酮对2 型糖尿病患者血脂、血糖及炎症因子的作用[J].中国中西医结合肾病杂志,2009,10(4):340 -342.
[7]Gao XQ,Li HW,Ling X,et al.Effect of rosiglitazone on rabbit model of myocardial ischemia-reperfusion injury[J].Asian Pac J Trop Med,2013,6(3):228 -231.
[8]Petrazzi L,Grassi D,Polidoro L,et al.Cardiovascular risk and cardiometabolic protection:role of glitazones[J].J Nephrol,2008,21(6):826 -835.
[9]Ji Y,Liu J,Wang Z,et al.PPARγ agonist rosiglitazone ameliorates LPS-induced inflammation in vascular smooth muscle cells via the TLR4/TRIF/IRF3/IP-10 signaling pathway [J].Cytokine,2011,55(3):409 -419.
[10]Zeng W,Yuan W,Li L,et al.The promotion of endothelial progenitor cells recruitment by nerve growth factors in tissue-engineered blood vessels[J].Biomaterials,2010,31(7):1636 -1645.
[11] Shen L,Zeng W,Wu YX,et al.Neurotrophin-3 accelerates wound healing in diabetic mice by promoting a paracrine response in mesenchymal stem cells[J].Cell Transplant,2013,22(6):1011 -1021.
[12]Zucchi P,Ferrari P,Spina ML.Diabetic foot:from diagnosis to thera py[J].G Ital Nefrol,2005,22 (31):20 -22.
[13]Zimny S,Dessel F,Ehren M,et al.Early detection of microcirculatory impairment in diabetic patients with foot at risk[J].Diabetes Care,2001,24(10):1810 -1814.
[14]Jeffcoate WJ,Price P,Harding KG.Wound healing and treatments for people with diabetic foot ulcers[J].Diabetes Metab Res Rev,2004,20(1):78 -89.
[15]Jaquinandi V,Mahe G,Leftheriotis G,et al.Reference value of transcutaneous oxygen measurement in diabetic patients compared with nondiabetic patients[J].J Vasc Surg,2009,49(1):279 -280.
[16]Tullavardhana T,Akranurakkul P,Ungkitphaiboon W,et al.Vascular endothelial growth factor-C expression as a biomarker of poor prognosis in esophageal squamous cell carcinoma:a meta-analysis[J].Oncol Res Treat,2015,38(3):110 -114.
[17]Gillitzer R,Goebeler M.Chemokines in cutaneous wound healing[J].Leukoc Biol,2001,69(4):513 -521.

