液相色谱串联质谱法分析马尿中司坦唑醇代谢产物
曹玉萍 徐友宣
1 国家体育总局反兴奋剂中心(北京100029)
2 北京体育大学
司坦唑醇(stanozolol)是蛋白同化激素中的一员,具有促进蛋白质合成、抑制蛋白质异生等作用,在临床上用于慢性消耗性疾病、再生障碍性贫血等,能使体力增强、食欲增进、体重增加,因此常被用于兴奋剂来提高运动员或马的运动能力。 国际奥委会于1974年开始禁用司坦唑醇[1],但这种药物仍然被许多运动员滥用。根据近十年的相关国际马术组织发布的年度报告可知, 司坦唑醇也是马术运动中最常用的蛋白同化激素之一。
关于司坦唑醇在人体内的代谢已经有一些研究,Thevis等[2]和Pozo等[3]先后在2006年和2009年对司坦唑醇在人体内的代谢进行了研究, 其中Pozo等通过人体试验和小鼠实验确定了司坦唑醇在人体内的19种代谢产物, 并对其代谢途径、 代谢时间等进行了系统的研究。 最早的关于司坦唑醇在马体内的代谢研究是1990年的Mück等利用大气压化学电离(APCI)的LC-MS方法检测出口服司坦唑醇后马尿中C3’、C4、C6和C16位的羟基化代谢产物[4],但是这项研究没有对II相代谢产物进行研究[5]。随后的一些研究进一步证实了16β-羟基司坦唑醇(16β-hydroxystanozolol)是肌肉注射司坦唑醇后马尿中的最主要的代谢产物。基于以上研究,研究人员建立了GC-MS检测司坦唑醇的方法[6],但是这种方法需要经过固相萃取、酶解、液液萃取净化和衍生化等步骤,过程较为繁琐。2004年,McKinney等[5]利用液相色谱离子阱质谱(LC-ITMS)对肌肉注射司坦唑醇后的马尿进行了分析,得到4种包括司坦唑醇原型在内的代谢产物, 其他三个为16β-羟基司坦唑醇以及可能是16α、15-羟基司坦唑醇(15-hydroxystanozolol)这两种代谢产物, 最后又对这四种代谢产物在Ⅱ相代谢中葡萄糖醛酸化结合物和硫酸化结合物的比例进行了分析。
上述实验虽然对马尿中司坦唑醇的代谢产物进行了分析, 但是未能提供各主要代谢产物的浓度变化曲线,使得司坦唑醇的检测窗口期不明确。在建立本类药物检测方法的基础上, 本实验对单次剂量口服司坦唑醇马的尿样进行了采集,用LC-MS/MS仪器对尿样中代谢物进行了分析, 并通过建立药物浓度标准曲线得到了司坦唑醇主要代谢产物的浓度随时间变化曲线,方法的灵敏度和选择性明显优于前人的单级质谱方法,为马术运动中检测司坦唑醇提供更灵敏可靠的方法。
1 材料与对象
1.1 仪器和材料
Agilent Techonologies 6410A 三重四级液相色谱串联质谱仪器(美国Agilent公司);Milli-Q超纯水系统(美国Millipore公司);Mettler PM200电子天平 (感量0.001 g,瑞士Mettler公司);Genie Vortex-2漩涡混合器(美国Scientific Industries 公 司);XMTD-2MA 恒 温 水 浴 箱;Techne氮吹仪(英国Bibby公司)。
标准品司坦唑醇、16β-羟基司坦唑醇、3’-羟基司坦唑醇(3’-hydroxystanozolol)、4α-羟基司坦唑醇(4αhydroxystanozolol)、甲基睾酮(methyltestosterone)(国家体育总局反兴奋剂中心检测实验室);甲醇、乙腈、叔丁基甲醚(Dima公司);三氯甲烷、磷酸二氢钠、磷酸氢二钠、碳酸钾、碳酸氢钠、甲酸(国药集团化学试剂有限公司);β-葡萄糖醛酸苷酶(Sigma公司)。
色谱条件:色谱柱为Agilent Zorbax XDB-C18柱(2.1×100 mm, 3.5 μm);流动相A为0.1%甲酸-水溶液(含0.2 M的甲酸铵),流动相B为0.1%甲酸-甲醇溶液;流速为0.2 mL/min;进样量10 μL;柱温40℃。质谱条件:毛细管电压为4000 V;干燥气温度为330℃;干燥气流速:10 L/min分钟;雾化气压力为35 psi。
1.2 空白尿样与阳性尿样
实验选用马匹为新疆伊犁马,公马,年龄为5岁(相当于人的20岁左右),体重为280 kg,体质健康,无药物滥用史。 首先采集服药前尿样作为空白尿样;然后让马匹单次口服文献中推荐剂量(0.55 mg/kg体重)的司坦唑醇, 采集服药后前3天所有尿样、30天内的晨尿以及第33、38、45、56天的晨尿。
2 实验方法与结果
2.1 代谢产物分析
分析司坦唑醇的代谢产物, 首先要对司坦唑醇原型的结构进行分析, 推算出可能得到的代谢产物的分子量。
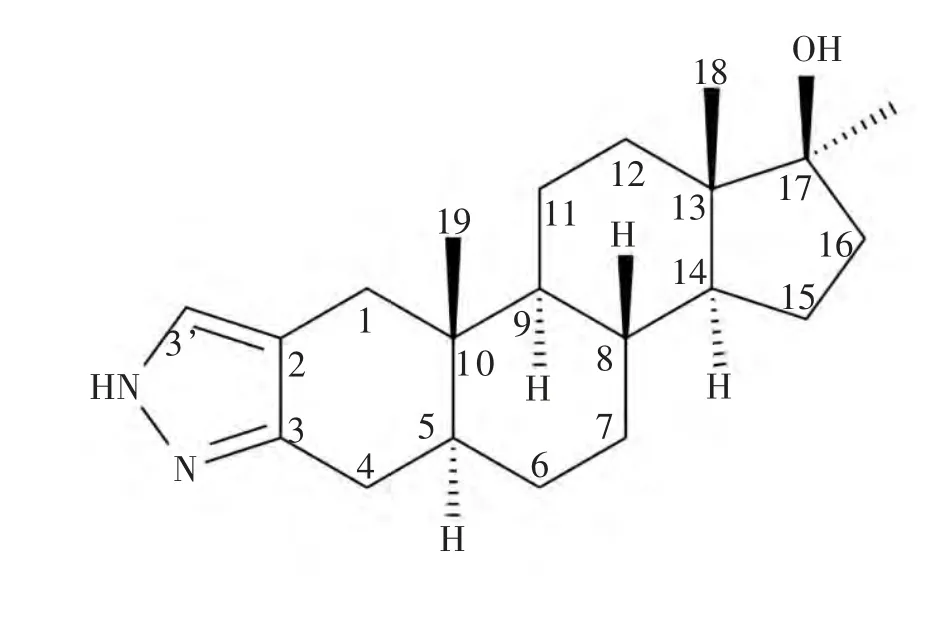
图1 司坦唑醇的化学结构式
司坦唑醇的相对分子量为328.49,根据其化学结构式(见图1)以及药物代谢理论,推测其在尿液中的代谢产物主要以脱氢化合物、羟基化合物、原型及它们的差向异构形式存在。 因此,在质谱中可能出现m/z为327、329、343、345、359、361等为准分子离子的司坦唑醇代谢物。
2.1.1 LC-MS/MS的子离子扫描模式
用甲醇配制500 μL的浓度为1 μg/mL的16β-羟基司坦唑醇、3’-羟基司坦唑醇、4α-羟基司坦唑醇和司坦唑醇的标准品混合液,运用LC-MS/MS仪器的子离子扫描模式进行分析,扫描结果如下(图2)。
根据子离子扫描结果图, 选择出特征子离子m/z 81、95、97、107、109、121、137和145。
2.1.2 LC-MS/MS的母离子扫描模式
色谱质谱条件同上。 质谱扫描范围:m/z 320~400;扫描时间:200ms;碰撞能量:根据子离子扫描选择每个代谢物子离子最合适的CE;聚焦电压:120~150 V。
采用β-葡萄糖醛酸酶酶解、叔丁基甲醚液液提取的方式进行前处理之后, 用LC-MS/MS仪器分别对m/z81、95、97、107、109、121、137、145进行母离子扫描。
2.1.3 对比空白尿样和阳性尿样的谱图
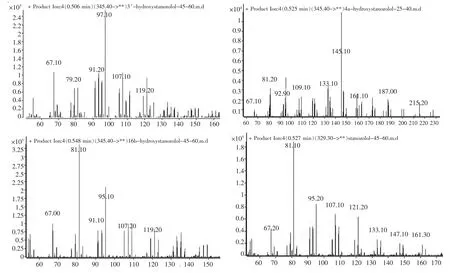
图2 3’、4α、16β-羟基司坦唑醇和司坦唑醇的子离子扫描图
通过母离子扫描得到的服药后尿样谱图及空白尿样谱图进行对比,找出空白尿样中没有的、与推算出的代谢物分子量相同的化合物,记录保留时间。其中对比结果最优的是m/z 81的结果图(见图3)。 而其他几个子离子的母离子扫描效果不太理想, 其中m/z 95、97只得到代谢物②,且响应值较低,谱图效果较差;m/z 137谱图在保留时间10.5和10.8处有两个疑似代谢物,但是相同浓度的空白尿样中也含有相同分子质量的杂峰,因此不能判定这两个疑似就是司坦唑醇的代谢产物。
为发现更多代谢物, 研究又将服药后尿样进行子离子扫描,在化合物①~⑤对应的保留时间范围内选取子离子,再进行一次前体离子扫描,但没有新的发现。
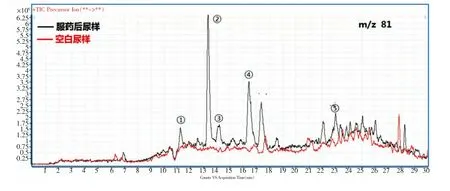
图3 服药后尿样及空白尿样的母离子扫描图(m/z 81)
2.2 代谢产物浓度-时间变化曲线
2.2.1 标准曲线建立
通过加入司坦唑醇、16β-羟基司坦唑醇、3’-羟基司坦唑醇、4α-羟基司坦唑醇标准品到2mL空白尿样中,使尿样浓度范围为0.01 ng/mL~200 ng/mL,取8个浓度点。
得出的数据以药物的浓度X(ng/mL)为横坐标,药物峰面积和内标峰面积比值Y为纵坐标, 运用Agilent定量分析软件进行线性回归, 求得线性回归方程,相关系数均大于0.996。 司坦唑醇、16β-羟基司坦唑醇、3’-羟基司坦唑醇、4α-羟基司坦唑醇的检测限LOD分别为0.1 ng/mL、0.2 ng/mL、0.1 ng/mL和2 ng/mL,线性范围是0.1~200 ng/mL。
2.2.2 代谢产物浓度-时间变化曲线的建立
将采集的阳性尿样按照已制定的前处理方法和仪器检测条件对司坦唑醇及其代谢物进行检测, 并根据已建立的线性方程计算出相应的浓度(见表1),然后以尿样采集日期为横坐标,代谢物浓度为纵坐标,得出每种化合物的浓度随时间变化曲线(见图4)。
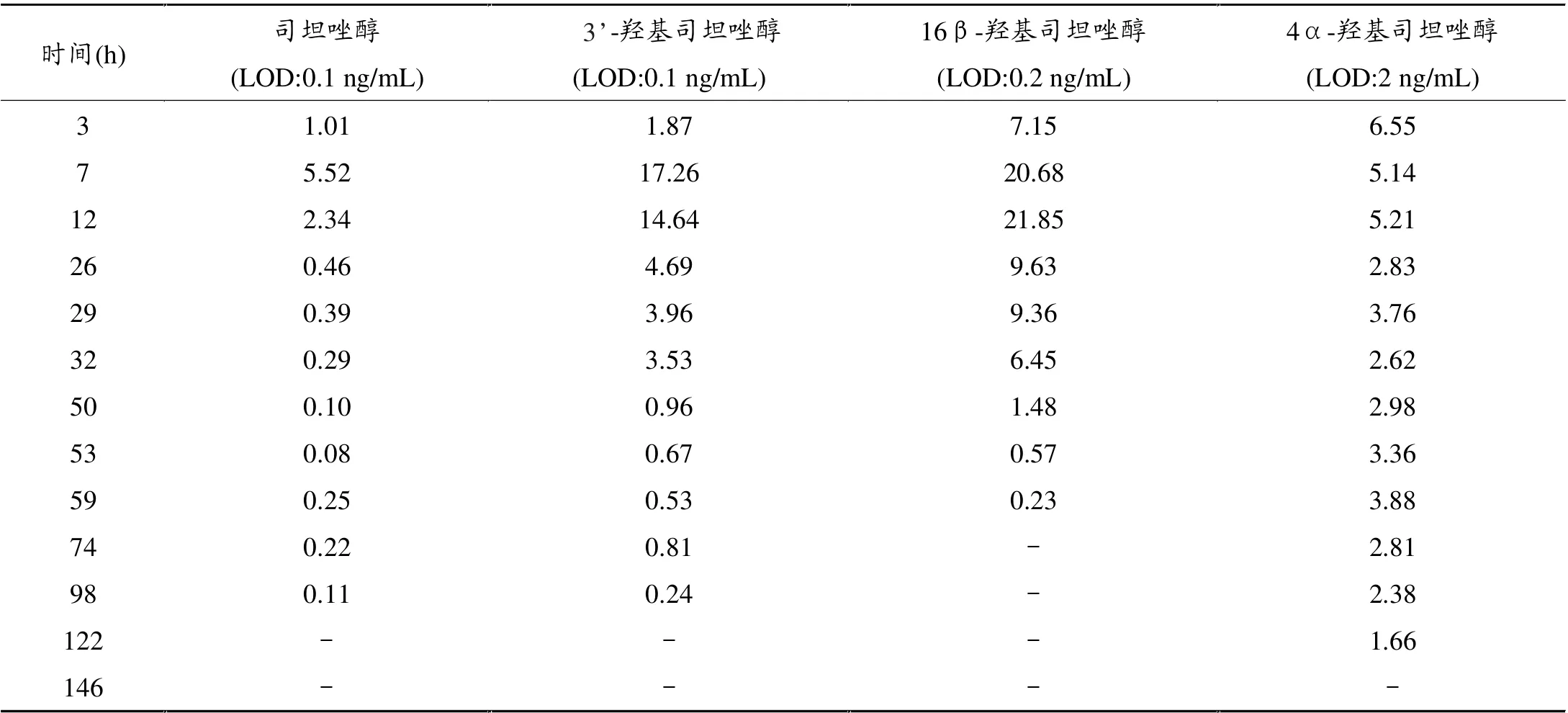
表1 四种代谢物的浓度时间变化
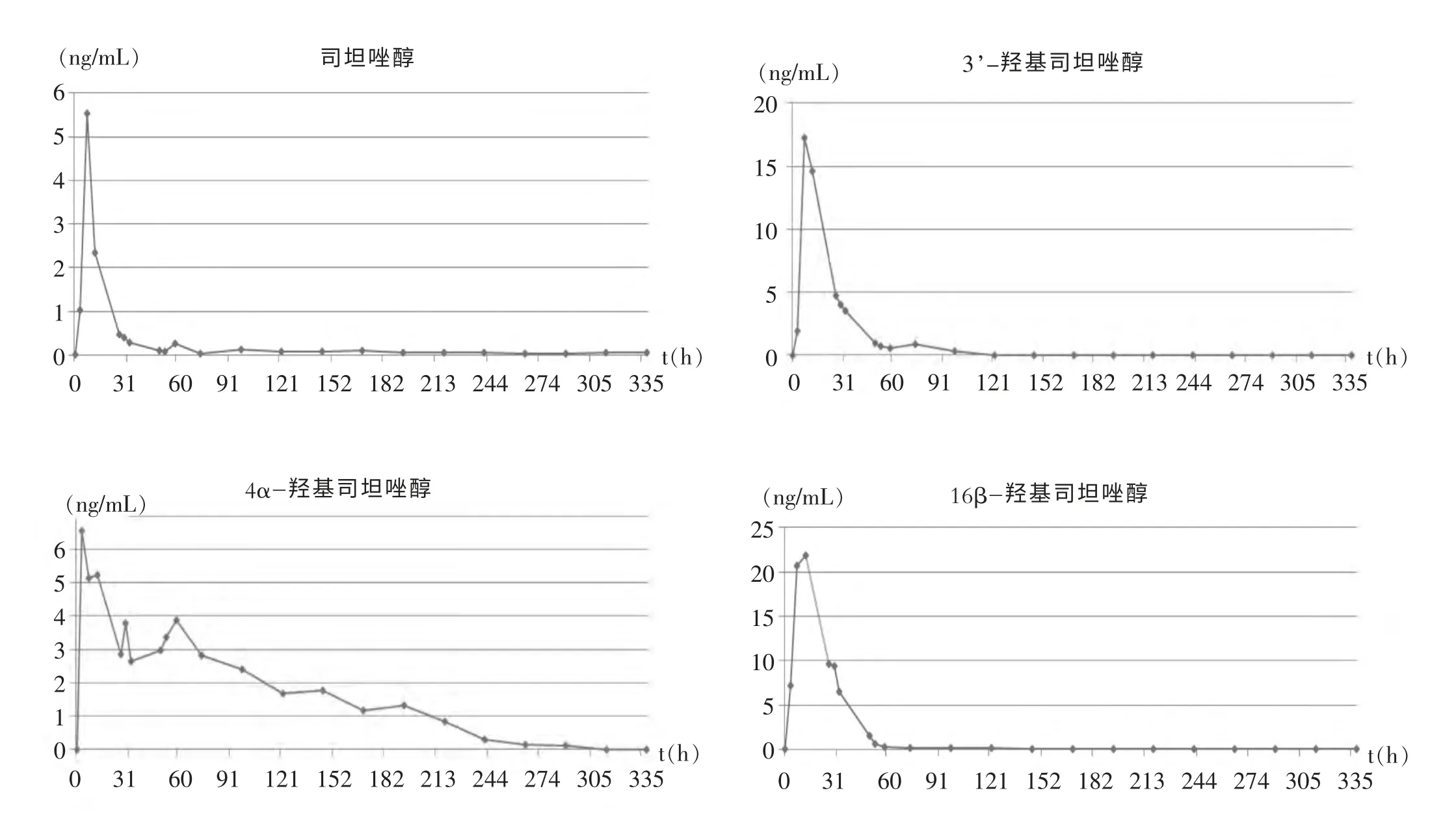
图4 司坦唑醇原型及三种代谢产物的浓度-时间变化曲线图
3 分析与讨论
3.1 代谢产物结果的分析与讨论
本实验用同样的前处理方法和分析方法对司坦唑醇和3’、4α、16β-羟基司坦唑醇标准品进行了分析,得到了四种化合物标准品的保留时间, 分别为23.03、14.88、13.36和16.21。
将标准品谱图和图3进行对比, 可确定图3中检出的化合物②为4α-羟基司坦唑醇, 化合物④为16β-羟基司坦唑醇。 化合物⑤与司坦唑醇标准品的保留时间虽然符合WADA_TD2010IDCR技术文件中关于保留时间的规定,即同一分析物的保留时间(RT)波动不能超过2%或0.1 min,但是谱图的峰形较差,响应值低,不能判定其为司坦唑醇,需进一步验证。将阳性尿样用MRM模式进行扫描后,能检测到司坦唑醇的存在,且在浓度为10ng/mL时也能清晰地辨认且符合WADA判据。 因此,代谢物⑤为司坦唑醇药物原型。造成这个问题的原因是因为MRM方式扫描的灵敏度要高于母离子扫描,它们之间存在着数量级差异。
同上, 虽然图2的母离子扫描谱图未出现3’-羟基司坦唑醇, 但对阳性尿样进行MRM检测后发现了与3’-羟基司坦唑醇标准品相同的代谢物,且保留时间符合WADA_TD2010IDCR技术文件中关于保留时间的规定。因此,可以把3’-羟基司坦唑醇定为代谢物⑥(图5)。

图5 空白尿添加标准品和服药后尿样中3’-羟基司坦唑醇的MRM图
代谢物①、③的相对分子质量均为345,为司坦唑醇的一羟基代谢物。 为判断①③的结构式,研究对服药后尿样在m/z 345进行了子离子扫描, 期望通过相对应保留时间处的子离子来推算其化学结构式。
代谢物①含特征子离子m/z 81和137, 只有在C4、C6、C7发生羟化作用以及C19位的羟甲基化作用才会产生这个子离子。 但谱图中没有更多的特征子离子可供判断,这有可能是检测时CE过高,造成子离子碎片太多,而忽略了其他可能存在的子离子,因此代谢物①到底是哪种代谢形式还需要再确证, 但本实验缺少相关标准品对照,因此无法进一步验证。
代谢物③含特征子离子m/z 81、271和285, 在司坦唑醇的一羟化代谢产物中, 只有C16和C17处羟化才能产生这三个子离子,但是C17本身含有一个-OH,若再增加一个-OH就会不稳定发生脱水。 因此,这个化合物只能是C16位上发生了羟化。 而且,这个代谢物与前文检测出的16β-羟基司坦唑醇保留时间不同,是16β-羟基司坦唑醇的同分异构物, 因此代谢物③可能为16α-羟基司坦唑醇。 但本实验缺少相关标准品对照,因此无法进一步验证。
综上, 本实验分析得到的代谢产物一共有6个,具体结果见表2。
由于待测组分存在响应值低的缺点, 因此本实验对代谢产物的分析并不完善。 这种现象是否可以通过加大浓度和采用更高分辨率仪器进行改善还有待研究。
3.2 代谢产物浓度-时间变化曲线分析与讨论
通过分析服药后马尿中药物浓度, 可以根据这几个代谢物代谢时间和浓度等的不同得出一些结论和启示。
(1)服药后3小时,马尿中均有目标药物出现且浓度均高于LOD,尤其是4α-羟基司坦唑醇,服药后3小时就已到达峰值水平。
(2)16β-羟基司坦唑醇在尿中的峰值浓度高于其他三个代谢物。
(3)司坦唑醇有一定浓度的药物原型残留在尿中。(4)司坦唑醇原型、3’、4α-羟基司坦唑醇在第98小时仍有高于LOD的药物残留, 而16β-羟基司坦唑醇在58小时后的尿样中便不能检出高于LOD的浓度。

表2 马尿中司坦唑醇代谢产物结果
以上结论提示兴奋剂检测工作者们选择目标代谢物时要充分考虑药物在尿中的残留浓度和持续时间这两方面的因素; 本实验可作为马尿中检测司坦唑醇的参考,将本实验中所得结果列入检测方法中。
4 总结
本实验对单次剂量口服司坦唑醇后马的尿样进行了采集, 用LC-MS/MS仪器对尿样中代谢物进行了分析,检出了药物原型以及5种代谢产物;并通过建立药物浓度标准曲线得到了司坦唑醇主要代谢产物的浓度随时间变化曲线, 为马术运动中检测司坦唑醇提供了更多的参考。 本实验还存在一些不足,如进行药物代谢分析时待测组分浓度值低、质谱响应值不理想等情况。
[1] Ferchaud V, Le Bizec B, Montrade MP, et al. Gas chromatographic-mass spectrometric identification of main metabolites of stanozolol in cattle after oral and subcutaneous administration[J]. J Chromatogr B Biomed Sci Appl,1997,695(2):269-277.
[2] Thevis M, Fuβhller G, Geyer H, et al. Detection of stanozolol and its major metabolites in human urine by liquid chromatography -tandem mass spectrometry [J].Chromatographia, 2006,64(7-8):441-446.
[3] Pozo OJ, Van Eenoo P, Deventer K, et al. Detection and structural investigation of metabolites of stanozolol in human urine by liquid chromatography tandem mass spectrometry[J].Steroids,2009,74(10-11):837-852.
[4] Mück WM, Henion JD. High‐performance liquid chromatography/tandem mass spectrometry: Its use for the identification of stanozolol and its major metabolites in human and equine urine[J]. Biomed Environ Mass Spectrom,1990,19(1):37-51.
[5] McKinney AR, Suann CJ, Dunstan AJ, et al. Detection of stanozolol and its metabolites in equine urine by liquid chromatography-electrospray ionization ion trap mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2004,811(1):75-83.
[6] World Anti-Doping Agency.WADA Technical Document-TD2010IDCR [EB/OL]. https://www.wada- ama.org/ en/resources/science-medicine/td2010-idcr, 2010.

