低氧预处理对人脂肪来源干细胞增殖和分化潜能影响的研究
刘林奇, 鲁 峰, 王 量, 黄书鹏, 李 乐, 李世荣
低氧预处理对人脂肪来源干细胞增殖和分化潜能影响的研究
刘林奇, 鲁 峰, 王 量, 黄书鹏, 李 乐, 李世荣
目的 探讨低氧(1%氧浓度)对脂肪来源干细胞增殖及分化潜能的影响。方法 用酶消化法培养脂肪来源干细胞;低氧预处理人脂肪来源干细胞于1%氧浓度下,48 h后检测脂肪来源干细胞的增殖情况及MTT法检测处理后各时间点的细胞活性,流式细胞仪检测细胞表面标志物,三系诱导后检测成脂、成软骨、成骨分化潜能。结果 低氧预处理促进脂肪来源干细胞增殖、并不改变其间充质干细胞表面标志CD90(99.92%±0.30%)和CD105(99.91%±0.04%),低表达血管内皮细胞的表面标志CD31(0.48%±0.32%),低氧预处理能促进成脂、成软骨,但对成骨无影响。结论 缺氧预处理能提高脂肪来源干细胞的增殖及活性,间充质干细胞特性,为细胞疗法临床运用及组织工程运用提供了新的思路。
低氧; 预处理; 脂肪来源干细胞; 分化潜能
干细胞移植在再生医学中的运用是目前研究的热点,而作为干细胞的重要成员----脂肪来源干细胞是从脂肪组织中分离得到的一种能够多向分化的干细胞,具有体内储存量大、易于获取、增殖稳定等特点,逐渐成为利用干细胞治疗及组织工程的种子细胞[1]。目前,对于脂肪来源干细胞的培养通常是在体积分数21%氧分压条件下完成的,而研究表明,人体各组织器官的氧分压存在较大差异,文献报道脂肪组织的氧分压通常在3%以下,这提示脂肪来源干细胞很可能处在一个低氧浓度环境中[2-3]。因此,低氧条件下培养脂肪干细胞成为人们关注的焦点[4-6]。自2013-2014年,我们对低氧预处理对人脂肪来源干细胞的增殖分化潜能的影响进行了研究。
1 对象与方法
1.1 实验仪器及材料 高糖DMEM,FBS,PBS液,胰蛋白酶-EDTA、青链霉素原液,DMSO,MTT,Ⅰ型胶原蛋白酶,抗人 CD31、CD90、CD105流式抗体,离心管,培养皿,吸管,96及6孔培养板,过滤器,普通CO2及三气培养箱,流式细胞仪,超净工作台,倒置显微镜,离心机,37 ℃恒温水箱,ELX800型通用酶标仪,血细胞计数仪等,WH-2微型漩涡混合仪。
1.2 组织来源 脂肪来自于20~50岁要求去除腰腹部及大腿多余脂肪行抽脂术的健康成人,供体无传染病及内分泌疾病,男女比例为1∶3。共24例患者。术前均签署知情同意书。
2 实验方法
2.1 脂肪来源干细胞的培养 将抽吸脂肪经过178 r/min,离心3 min后在超净台中转移入50 ml离心管中,加入等体积的Ⅰ型胶原酶(0.25%),微型漩涡混合仪混匀,放入37 ℃的水浴箱内,每10 min漩涡10~12 s,消化30 min。加入等体积完全培养基(DMEM+10%胎牛血清(FBS)+1%双抗),48 h后更换培养基,培养至第2代备用(生长至80%~90%)。
2.2 低氧和常氧预处理人脂肪来源干细胞 胰蛋白酶-EDTA消化第2代细胞,以1∶2传代接种在100 mm培养皿内,每100 mm皿加入7.5 ml完全培养基,待细胞贴壁8 h后分别随机移入低氧培养箱(1%O2,5%CO2,37 ℃)和常氧培养箱(5%CO2,37 ℃)。待氧气浓度平衡至1%后处理48 h,常氧组细胞放入普通CO2培养箱内培养48 h。
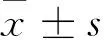
2.4 细胞增殖测定(MTT法) 消化法收集经低氧和常氧处理的脂肪来源干细胞,制成单细胞悬液,接种于96孔板,1×103/孔,体积200 μl/孔,在常氧培养条件下培养,8、24、48、72、96 h后分别加入5 g/LMTT溶液,20 μl/孔,继续孵育4 h,终止培养。小心吸去孔内上悬液,每孔加入150 μl DMSO,振荡10 min,使结晶物充分溶解。酶联免疫检测仪490 nm波长下读取吸光值(OD)值。每次每组检测6个孔,并根据OD值绘制细胞生长曲线。
2.5 流式细胞仪鉴定其分子表达 取两种方法处理后的第3代细胞分别作流式细胞仪鉴定。胰酶消化细胞,每管细胞2×105,用含有0.1%叠氮钠和0.5% BSA的PBS洗两遍,用PBS重悬细胞。加入一抗,4 ℃30 min,PBS洗2遍。加入异硫氰酸荧光素(fluorescein isothiocyanate, FITC)或藻红蛋白(phycoerythrin, PE)标记的小鼠抗人IgG二抗,4 ℃30 min,PBS洗2遍。用不含BSA的PBS重悬细胞,流式细胞仪检测CD31、CD90、CD105的表达。
2.6 脂肪来源干细胞向脂肪细胞、软骨细胞、成骨细胞的定向诱导分化 成脂诱导分化:为了检测其成脂分化潜能,将两组细胞分别接种于普通培养基的12孔培养皿培养。培养过夜细胞贴壁后,更换成脂诱导培养基。每隔3 d更换诱导培养基,1周后用油红O染色评估成脂分化程度,细胞所含脂质染成红色。显微镜照相。实验在重复孔中进行。油红O染色的脂质用异丙醇萃取,并在510 nm处测定吸光度。
成软骨诱导分化:细胞用胰蛋白酶消化并以10 000细胞/孔重新接种在12孔培养皿。过夜细胞贴壁后,更换软骨诱导培养基,在第3周的细胞进行漂洗在0.1 mol/L的盐酸(pH 1.0)平衡pH。将其放置在含有的1%阿尔新蓝-8 GX的 0.1 mol/L盐酸(pH 1.0)30 min,然后再洗涤2遍以除去非特异性染色。细胞作核固红。最后测定结果是由两个双盲的学者用Image-Pro Plus 6.0分析而得。
成骨诱导分化:细胞用胰蛋白酶消化并以10 000细胞/孔重新接种在12孔培养皿,过夜细胞贴壁后,更换成骨诱导培养基。茜素红染色和定量3周后进行,在后期的成骨分化过程中,茜素红进行钙沉积检测。将培养的细胞用PBS洗涤,固定在100%乙醇中15 min,并用0.2%茜素红溶液(pH 6.4)处理30 min,去离子水洗涤以除去非特异性沉淀,红色代表细胞分化的钙沉积。用于晚期成骨分化的分析。对钙的沉积进行定量的茜素红染色用100 mM氯化十六烷基吡啶萃取,在室温下搅拌3 h。所提取茜素红在570 nm处测定吸光度。
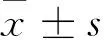
3 结果
3.1 低氧处理的脂肪来源干细胞形态 脂肪来源干细胞是从脂肪获取之后,经过酶消化法,得到血管基质片段(stromal vascular fraction, SVF),经过贴壁培养即可得脂肪来源干细胞,从我们的实验中,低氧预处理未改变人脂肪来源干细胞的形态,成纤维细胞样长梭形。表明低氧预处理并不会对细胞形态学形成明显影响。
3.2 低氧预处理对脂肪来源干细胞增殖能力影响 人脂肪来源干细胞处于第2代时采取随机方式进行分组,细胞进行随机低氧预处理和常氧培养。在经过48 h的低氧预处理和常氧培养后,结果表明,低氧处理组的细胞数量超过常氧处理组的细胞,两组相比较,差异有统计学意义(P<0.05,图1)。说明在低氧处理的过程中,人脂肪来源干细胞细胞增殖更快。经过低氧预处理后,通过MTT检测不同时间点的OD值反应了细胞的增殖活性情况,我们的实验结果表明,在低氧预处理之后24、48、72、96h脂肪来源干细胞的增殖能力有统计学意义(P<0.05,图2)。表明在低氧预处理的人脂肪来源干细胞后,低氧预处理组人脂肪来源干细胞的增殖能力较常氧组强,表明低氧预处理能提高其增殖能力。
3.3 低氧预处理对人脂肪来源干细胞表面标志的影响 流式细胞仪检测结果表明,低氧处理的人脂肪来源干细胞仍然高表达干细胞的相关标志物CD90(99.92%±0.30%)和CD105(99.91%±0.04%),低表达血管内皮细胞的表面标志CD31(0.48%±0.32%),见图3。同时,进行常氧培养的人脂肪来源干细胞同样高表达间充质干细胞表面标志,低表达血管内皮细胞的表面标志:CD90(99.90%±0.4%)和CD105(99.87%±0.2%),CD31(0.52%±0.29%),此结果证明,在低氧预处理的脂肪来源干细胞未改变其干细胞的特性,持续高表达间充质干细胞相关表面标志物,维持了间充质干细胞的特性,在48h的低氧处理过程中,脂肪来源干细胞并无明显的向血管内皮细胞分化趋向。
3.4 低氧预处理对人脂肪来源干细胞三向分化潜能的影响 经过低氧预处理的人脂肪来源干细胞经过一定时间的诱导培养,均能向成脂、成骨及成软骨方向分化,同时将低氧预处理的脂肪来源干细胞和一直以常氧浓度培养的人脂肪来源干细胞三向分化能力对比,低氧预处理的人脂肪来源干细胞其成脂能力(P<0.05)、成软骨能力(P<0.05)较常氧培养的强。低氧处理组有较常氧组多的脂滴被染色,更多的胶原被阿辛蓝染色;其成骨能力并无明显的统计学意义(P>0.05)。
4 讨论
氧是生物生存的必要条件,大部分组织需要氧来产生足够的ATP以供组织代谢,氧浓度也是调节生物功能的重要因素[7]。传统实验的组织培养多在常氧下进行,氧浓度约为21%,但事实上,人体各组织细胞生理环境的氧浓度并不一致,人体血液中氧浓度为10%~13%,人类软骨细胞(无血管组织)生长环境的氧浓度为0~7%,人脑组织氧浓度为3%~14%,肺泡血管氧浓度约为14%,骨髓腔内氧分压为1%~7%[2]。因此,常氧环境培养细胞并不能完全符合细胞的生理特性,于是有研究者提出低氧培养的概念:即模拟细胞生理性低氧环境下对细胞进行培养,这样的实验条件更符合生理环境。
目前已经有实验证实,对于缺氧的组织,移植前在体外对间充质干细胞进行低氧预处理,可能将更有利于移植后组织损伤的修复,这一现象在心肌梗死等的动物模型中已初步得到证实[8-9]。经过低氧预处理的细胞再进入体内后更容易耐受移植受区缺血、缺氧的环境,可能是因为在低氧预处理过程中激活人脂肪来源干细胞的缺氧诱导因子1α,从而导致其下游的促血管生长因子,如血管内皮生长因子及碱性成纤维细胞生长因子等分泌增加,从而更有利于移植后保证移植细胞的存活,更好的发挥细胞的生物学效应。但我们也发现,目前对于低氧预处理的氧浓度及时间未形成广泛的共识,氧浓度0.5%~10%,处理时间24~72 h[10-14]。从而得出了不完全一致的结果,但是主要研究结果表明,低氧预处理间充质干细胞能促进间充质干细胞的生物活性[15],对于细胞分化潜能方面存在一定差异。 Valorani等[6]同样证明,低氧培养不会改变脂肪来源干细胞的形态,他们在获得血管基质片段开始即采用两种不同的方式对脂肪来源干细胞进行培养,发现其成脂和成骨能力得到了增强。同时也有学者研究结果显示,2%氧气浓度会抑制鼠脂肪来源间充质干细胞的成骨和成软骨分化。也有学者研究结果显示,2%的氧气浓度会抑制人脂肪间充质干细胞的成骨和成脂分化。然而氧浓度5%则表现出抑制细胞增值,但是表现出增强的成软骨分化能力。因为开始预处理的阶段、低氧预处理时间及细胞的不同可能导致了不完全相同的结论。本实验采取1%氧浓度预处理人脂肪来源干细胞,到达细胞表面的氧气浓度约为0.14%,使细胞更接近于其体内的正常生理环境[16]。
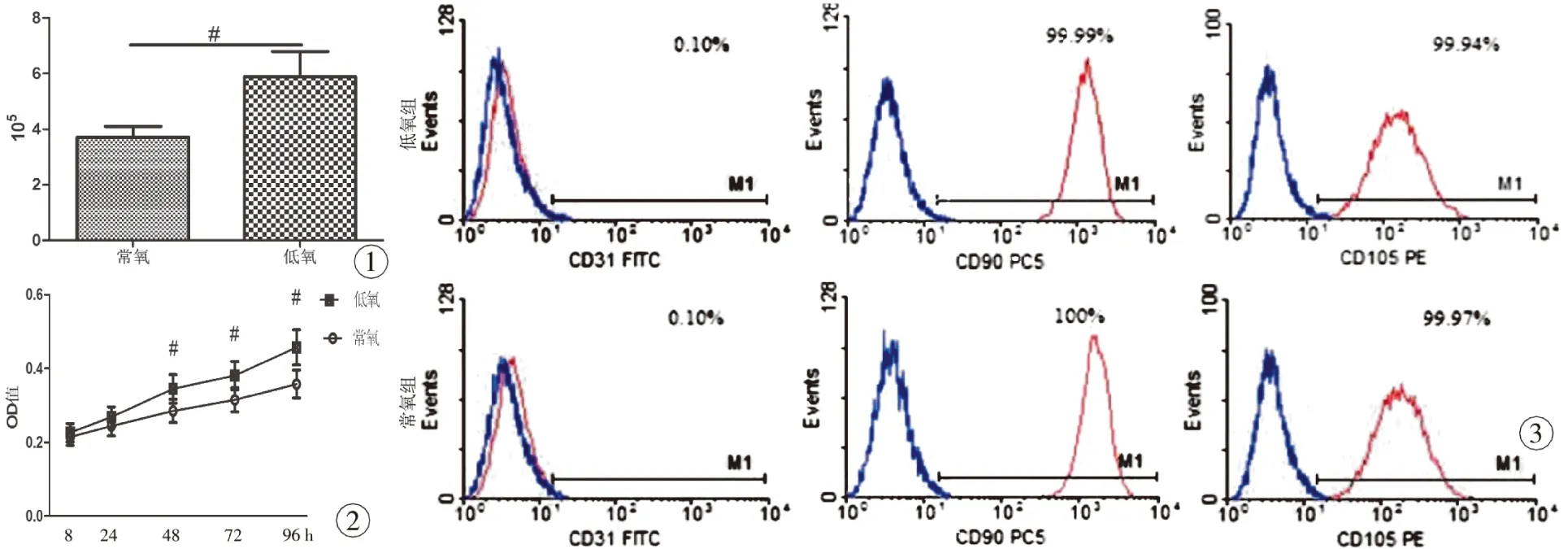
图1 常氧组和低氧组细胞数量 图2 细胞的增殖曲线 图3 流式细胞仪检测细胞表面标记
Fig 1 Number of hASCs in the hypoxia and normoxia groups. Fig 2 Growth curve of hASCs. Fig 3 Surface markers of hASCs by flow cytometry.
本研究证实了低氧预处理能促进脂肪来源干细胞增殖、细胞活性,且能维持脂肪来源干细胞的间充质干细胞特性,具有良好的三向分化潜能,从而为人脂肪来源干细胞移植进入体内及组织工程中发挥更好地生物学效应提供了更为有利的条件,但是,低氧预处理脂肪来源干细胞的氧浓度及处理时间需要进一步深入系统的研究及规范,需要研究者更加全面地研究干细胞的周围环境因素对其影响,从而为提高干细胞移植效率提供新的实验和理论依据。
[1] Matsuda K, Falkenberg KJ, Woods AA, et al. Adipose-derived stem cells promote angiogenesis and tissue formation for in vivo tissue engineering[J]. Tissue Eng Part A, 2013,19(11-12):1327-1335.
[2] Mohyeldin A, Garzon-Muvdi T, Quinones-Hinojosa A. Oxygen in stem cell biology: a critical component of the stem cell niche[J]. Cell Stem Cell, 2010,7(2):150-161.
[3] Chung HM, Won CH, Sung JH. Responses of adipose-derived stem cells during hypoxia: enhanced skin-regenerative potential[J]. Expert Opin Biol Ther, 2009,9(12):1499-1508.
[4] Hsiao ST, Lokmic Z, Peshavariya H, et al. Hypoxic conditioning enhances the angiogenic paracrine activity of human adipose-derived stem cells[J]. Stem Cells Dev, 2013,22(10):1614-1623.
[5] Yamamoto Y, Fujita M, Tanaka Y, et al. Low oxygen tension enhances proliferation and maintains stemness of adipose tissue-derived stromal cells[J]. Biores Open Access, 2013,2(3):199-205.
[6] Valorani MG, Montelatici E, Germani A, et al. Pre-culturing human adipose tissue mesenchymal stem cells under hypoxia increases their adipogenic and osteogenic differentiation potentials[J]. Cell Prolif, 2012,45(3):225-238.
[7] Chacko SM, Ahmed S, Selvendiran K, et al. Hypoxic preconditioning induces the expression of prosurvival and proangiogenic markers in mesenchymal stem cells[J]. Am J Physiol Cell Physiol, 2010,299(6):C1562-C1570.
[8] Volkmer E, Kallukalam BC, Maertz J, et al. Hypoxic preconditioning of human mesenchymal stem cells overcomes hypoxia-induced inhibition of osteogenic differentiation[J]. Tissue Eng Part A, 2010,16(1):153-164.
[9] Hu X, Yu SP, Fraser JL, et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis[J]. J Thorac Cardiovasc Surg, 2008,135(4):799-808.
[10] Thangarajah H, Vial IN, Chang E, et al. IFATS collection: adipose stromal cells adopt a proangiogenic phenotype under the influence of hypoxia[J]. Stem Cells, 2009,27(1):266-274.
[11] Rubina K, Kalinina N, Efimenko A, et al. Adipose stromal cells stimulate angiogenesis via promoting progenitor cell differentiation, secretion of angiogenic factors, and enhancing vessel maturation[J]. Tissue Eng Part A, 2009,15(8):2039-2050.
[12] Lee EY, Xia Y, Kim WS, et al. Hypoxia-enhanced wound-healing function of adipose-derived stem cells: increase in stem cell proliferation and up-regulation of VEGF and bFGF[J]. Wound Repair Regen, 2009,17(4):540-547.
[13] Liu L, Gao J, Yuan Y, et al. Hypoxia preconditioned human adipose derived mesenchymal stem cells enhance angiogenic potential via secretion of increased VEGF and bFGF[J]. Cell Biol Int, 2013,37(6):551-560.
[14] 彭阳红, 顾春虎, 易定华, 等. 低氧对小鼠骨髓间质干细胞增殖及黏附的影响[J]. 中华实验外科杂志, 2008,25(11):1472-1474.
[15] Kubo M, Li TS, Kurazumi H, et al. Hypoxic preconditioning enhances angiogenic potential of bone marrow cells with aging-related functional impairment[J]. Circ J, 2012,76(4):986-994.
[16] Fink T, Abildtrup L, Fogd K, et al. Induction of adipocyte-like phenotype in human mesenchymal stem cells by hypoxia[J]. Stem Cells, 2004,22(7):1346-1355.
Effects of hypoxia preconditioning on the proliferation and differentiation potentials of human adipose-derived stem cells
LIULin-qi,LUFeng,WANGLiang,etal.
(TheSouthwesternPlasticandAestheticSurgeryHospital,TheThirdMilitaryMedicalUniversity,Chongqing400038,China)
Objective To study the effects of hypoxic preconditioning (1% O2) on the proliferation and differentiation potentials of human adipose-derived stem cells. Methods The method of enzymatic digestion was employed to isolate and culture adipose-derived stem cells.After hypoxia preconditioned (1%O2) for 48 hours, cell number was counted. MTT method was applied to evaluate the proliferation on different time points after hypoxia preconditioned for 48 hours. Flow cytometry cell was used to measure the surface markers and adipogenic, chondrogenic and osteogenic differentiation potential were also measured after induction detected. Results Hypoxia preconditioning enhanced cell proliferation, after that hypoxia preconditioned adipose-derived stem cells have higher proliferation compared to normoxia group. We also observed that hypoxia increases their adipogenic and chondrogenic differentiation potentials not including osteogenic differentiation. Conclusion Hypoxia preconditioning can improve the proliferation of adipose-derived stem cells. At the same time maintain mesenchymal stem cell characteristics of adipose-derived stem cells. This may provides a new way of thinking for the clinical use of cell therapy and tissue engineering.
Hypoxia; Preconditionings; Adipose-derived stem cells; Differentiation potential
400038 重庆,第三军医大学西南医院整形美容医院(刘林奇,王 量,黄书鹏,李 乐,李世荣);南方医科大学南方医院 整形外科 (鲁 峰)
刘林奇(1987-),四川德阳人,医师,硕士研究生.
李世荣, 400038,第三军医大学西南医院整形美容医院,电子信箱:zhengxing@vip.163.com
10.3969/j.issn.1673-7040.2015.04.014
R318.5
A
1673-7040(2015)04-0231-04
2014-11-26)

