驱铜治疗对肝豆状核变性患者脑组织磁共振波谱的影响☆
吴舒梅胡文彬韩咏竹胡纪源王训李凯王共强吴君霞苏增锋杨任民
驱铜治疗对肝豆状核变性患者脑组织磁共振波谱的影响☆
吴舒梅*胡文彬△韩咏竹△胡纪源△王训△李凯△王共强△吴君霞△苏增锋※杨任民△
目的观察肝豆状核变性(wilson disease,WD)患者脑组织氢质子磁共振波谱(1H-MRS)的改变及患者在驱铜治疗前后脑组织1H-MRS的变化情况,为WD的评价预后提供参考。方法选择39例WD患者,分为非脑型组18例;脑型疗前组及短期治疗组均为21例,其中长期治疗组20例。分别利用1.5T超导磁共振诊断仪对患者进行1H-MRS单体素信号采集,在驱铜治疗后再次检测,比较治疗前后各指标的变化。20例均无血缘关系的健康志愿者作为对照组。结果患者的年龄、性别与对照组有可比性。39例WD患者左侧壳核、尾状核头部NAA/Cr较丘脑部位明显降低(P<0.01)。非脑型组左侧壳核部位、丘脑部位NAA/Cr及Cho/Cr的均值较对照组明显降低(P<0.01)。脑型疗前组左侧壳核、尾状核头及丘脑部位NAA/Cr、Cho/Cr及NAA/Cho的均值较对照组明显降低(P<0.01或P<0.05)。短期治疗组左侧壳核、尾状核头及丘脑部位NAA/Cr、Cho/Cr及NAA/Cho的均值较脑型疗前组无统计学差异(P>0.05);长期治疗组左侧壳核、丘脑部位NAA/Cr及NAA/Cho的均值较脑型疗前组明显升高(P<0.01或P<0.05),尾状核头Cho/Cr的均值与脑型疗前组比较明显升高(P<0.05)。患者左侧壳核、尾状核头及丘脑NAA/Cr的均值与病程呈负相关(P<0.05)。结论不同类型的WD患者之间的1H-MRS表现也存在着差异,短期驱铜治疗对WD患者1H-MRS的影响不明显,而长期、正规的综合驱铜治疗能使WD患者的脑代谢得到显著改善。NAA/Cr比值可能作为观察疗效的可逆性非侵袭性指标。
肝豆状核变性 磁共振波谱 驱铜治疗
肝豆状核变性(Wilson disease,WD)是一种常染色体隐性铜代谢障碍性疾病,主要病理改变是豆状核变性及肝硬化,MRI可以明确的显示WD患者脑组织的病灶[1]。胡文彬等[2-4]对安徽省含山县、金寨县和利辛县WD的流行病学进行了研究,结果发现WD的发病率为1.96/10万,患病率为5.87/10万,故推测WD在我国并非少见。近年来,磁 共 振 波谱(magnetic resonance spectroscopy,MRS)技术发展很快,其临床应用已经使影像学检查深入到细胞生化代谢水平,目前文献关于HLD患者MRS表现的报道较少且存在争议,本研究通过对WD患者驱铜治疗前后探讨脑组织MRS的变化。
1 对象与方法
1.1对象
1.1.1研究组 39例WD患者,均为2012年2月至2015年3月期间安徽中医药大学神经病学研究所附属医院的住院患者,全部病例均符合WD的诊断标准[1]。临床分型参照2011年杨任民[5]的分型标准。
1.1.2对照组 20例均无血缘关系的健康志愿者,所有志愿者无神经精神病史,神经系统及血清铜、铜蓝蛋白、铜氧化酶等铜代谢检查均正常,并无影响波谱测的其它疾病。其中男10例,女10例,年龄6岁~30岁,平均(21.5±6.2)岁。
1.2研究方法
1.2.1研究分组 选择39例WD患者,共分为4组研究:①未经驱铜治疗或未经正规系统驱铜治疗的初诊非脑型患者18例,即非脑型组;②未经驱铜治疗或未经正规系统驱铜治疗的初诊脑型患者21例,即脑型疗前组;③上述21例患者住院行正规驱铜治疗2个月左右后,即短期治疗组;④上述21例患者住院行正规驱铜治疗2个月左右并在出院后综合驱铜治疗近1年及1年以上的复诊患者20例,即长期治疗组;⑤短期治疗组在驱铜治疗2个月后再次行MRS检查,长期治疗组在驱铜治疗近1年及1年以上复诊时再次行MRS检查。长期治疗组的疗程为10~14个月。
其中非脑型组男10例,女8例,年龄8岁~36岁,平均(20.1±7.9)岁,病程5个月~4年不等,平均(25.6±13.2)个月。脑型疗前组男11例,女10例,年龄9岁~32岁,平均(21.2±7.1)岁,病程6个月~5年不等,平均(24.3±14)个月。治疗予DMPS(20 mg/kg·d)加入50 g/L葡萄糖注射液500 mL中静脉滴注,每日1次,连用6 d为1个疗程,间歇2 d补充钙、锌、铁等微量和宏量元素,再行下一疗程,共治疗8个疗程。长期治疗组予DMPS驱铜治疗8个疗程,并在出院后继续行青霉胺(PCA)、二巯基丁二酸(DMSA)、葡萄糖酸锌和肝豆片等综合驱铜治疗近1年及1年以上。研究组和对照组的年龄、性别等具有可比性。
1.2.2检测设备 磁共振信号采用1.5T超导磁共振诊断仪,磁共振诊断仪参数设置、自旋回波(SE)扫描图像观察及感兴趣区选择由影像中心医师与神经内科医师共同协作完成,所有研究对象扫描参数和感兴趣区选择一致。
1.2.3检测方法 ①普通扫描:采用Symphony Simens Germany 1.5T成像系统,使用标准正交头线圈,受试者仰卧,并用真空枕固定头部以减少头部运动。矢状位T1WI和水平轴位图像自旋回波序列(spin-echo sequence,SE):TR=500 ms,TE=7.7 ms,T2WI快速自旋回波序列(fast spin-echo sequence,FSE):TR=4000 ms。TE=110 ms。水平层厚5.0 mm。观察MRI普通扫描图像判断受试者脑组织有无血肿、水肿、血管畸形及占位病变等异常改变,对无异常发现者进行波谱扫描。②感兴趣区(volume of interest,VOI)的确定:磁共振波谱信号采集层厚为10mm,采样区域包括左侧的壳核(putamen)、尾状核头(head of caudate nucleus)及丘脑(cerebral ganglion),选取正方体感兴趣区,每一体素大小为10 mm×10 mm×10 mm。③获取MRS信号:在感兴趣区内进行匀场,在此基础上进行波谱数据采集,检查采用Symphony Simens Germany 1.5 T磁共振svs-se-135序列(TR=1500 ms,TE=135 ms)进行单体素信号采集。收集壳核、尾状核头及丘脑部位1H-MRS信号,每个研究对象均在相同层面同一部位获取MRS信号,在选定层面内每个部位采集1个体素信息。④MRS数据采集:将NAA、Cho、Cr等混合物的磁共振信号经傅里叶转换或二维波谱图形,并计算波峰下面积。本研究所获得的二维图形中,NAA、Cho、Cr三个主峰分别位于2.0 ppm、3.2 ppm、3.0 ppm位移处,其峰下面积积分即是感兴趣区内该物质的相对浓度,已经由计算机自动计算给出,并自动计算出NAA/Cr、Cho/Cr和NAA/Cho比值,此数据作为统计分析数据。
1.3统计学方法 所有数据用SPSS11.5进行统计学处理,分类变量资料数据统计采用卡方检验,计量资料数据分析结果以(±s)表示,各变量间相关分析采用Person相关分析,多个均数间比较采用方差分析,两样本比较采用t检验,分别比较患者组与对照组间脑组织各部位代谢物含量是否有统计学差异。检验水准α为0.05。
2 结果
2.1WD患者与对照组性别构成及年龄的比较表1将患者组与对照组的性别构成及年龄进行了比较,比较结果显示患者组与对照组间的性别构成及年龄的差异均无统计学意义(P>0.05)。
2.2脑代谢产物相对浓度的比较
2.2.1非脑型组、脑型疗前组及对照组不同部位脑代谢物相对浓度的比较 表1显示非脑型组左侧壳核、丘脑部位NAA/Cr及Cho/Cr的均值与对照组比较明显降低(P<0.01),而壳核部位NAA/Cho均值较对照组明显升高(P<0.05);丘脑部位NAA/ Cho的均值均无统计学差异(P>0.05);尾状核头部位NAA/Cr、Cho/Cr及NAA/Cho的均值与对照组均无统计学差异(P>0.05)。脑型疗前组壳核NAA/ Cr及NAA/Cho的均值较非脑型组明显降低(P<0.01),Cho/Cr的均值明显升高(P<0.05);尾状核头Cho/Cr的均值明显降低(P<0.05),NAA/Cr及NAA/ Cho的均值无统计学差异(P>0.05);丘脑NAA/Cho的均值明显升高(P<0.01),而NAA/Cr及Cho/Cr的均值无统计学差异(P>0.05)。而脑型疗前组壳核、尾状核头及丘脑部位NAA/Cr、Cho/Cr及NAA/ Cho的均值与对照组比较均明显降低(P<0.01或P<0.05)。

表1 患者组与对照组性别构成及年龄的比较
2.2.2短期治疗组、长期治疗组与脑型疗前组及对照组不同部位脑组织代谢产物相对浓度的比较表3显示短期治疗组壳核部位NAA/Cr、Cho/Cr、NAA/Cho及丘脑部位NAA/Cr、Cho/Cr的均值与对照组比较明显降低(P<0.01),其余各项代谢产物的的均值与对照组比较无显著性差异(P>0.05);长期治疗组与对照组各部位脑代谢产物的均值比较均无显著性差异(P>0.05)。短期治疗组壳核、尾状核头及丘脑部位NAA/Cr、Cho/Cr及NAA/Cho的均值与脑型疗前组比较均无显著性差异(P>0.05)。长期治疗组壳核部位NAA/Cr、Cho/Cr、NAA/Cho、尾状核头部位及Cho/Cr的均值丘脑部位NAA/Cr、Cho/Cr的均值较短期治疗组明显升高(P<0.01或P<0.05),其余各项代谢产物的均值较短期治疗组无显著性差异(P>0.05)。长期治疗组壳核部位NAA/Cr及NAA/Cho、尾状核头Cho/Cr的、丘脑部位NAA/Cr及Cho/Cr的均值与脑型疗前组比较明显升高(P<0.01或P<0.05);而壳核部位的Cho/Cr、尾状核头部位的NAA/Cr、NAA/Cho、丘脑部位的NAA/Cho的均值均较脑型疗前组无显著性差异(P>0.05)。

表2 非脑型组、脑型疗前组与对照组不同部位脑代谢物相对浓度比较
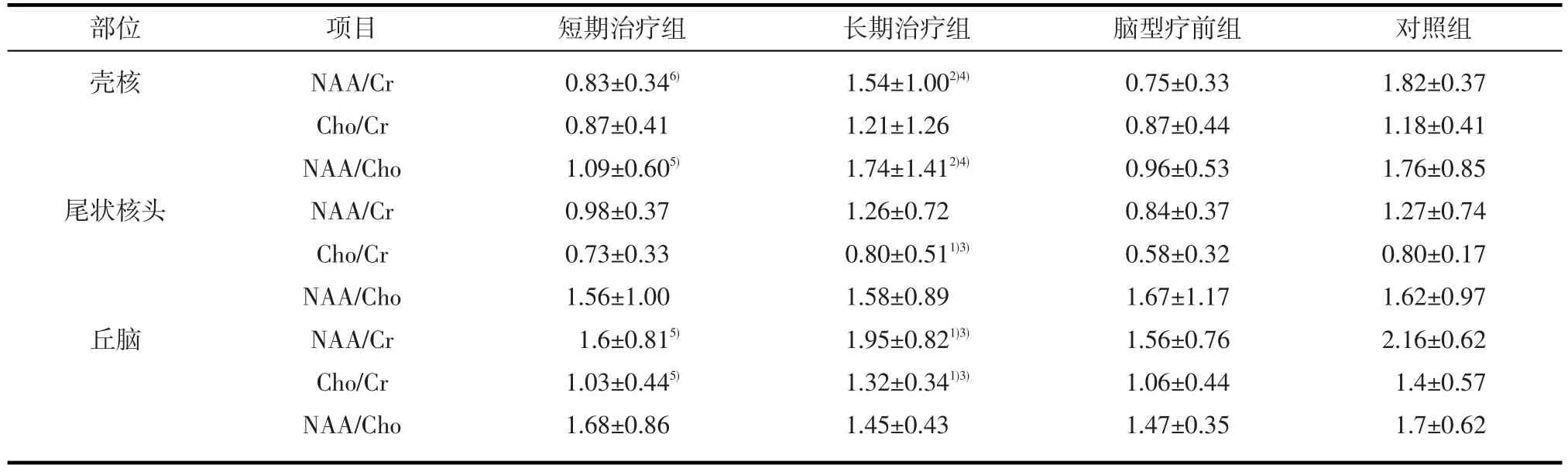
表3 短期治疗组、长期治疗组、脑型疗前组与对照组不同部位脑代谢物相对浓度比较
2.3脑型疗前组及非脑型组壳核、尾状核头和丘脑部位NAA/Cr的比较 表4显示非脑型组尾状核头NAA/Cr的均值较丘脑部位明显减少(P<0.01),脑型疗前组壳核及尾状核头NAA/Cr的均值均较丘脑部位明显减少(P<0.01)。
2.4NAA/Cr均值与病程的相关性 表5显示本文39例WD患者左侧壳核、尾状核投及丘脑NAA/Cr的均值与病程呈负相关(P<0.05)。
3 讨论
肝豆状核变性患者的MRS改变文献报道不一。Kraft等[6]报告病变的基底节NAA/Cr和Cho/Cr与对照正常儿童无差异。Sinha等[7]报告WD基底节的NAA/Cr比值较正常对照组减低,Cho/Cr比值与正常对照组比较无差异。Leandro等[8]研究认为WD患者基底节、顶枕叶皮质和额叶白质的NAA/Cr的比值较对照组明显降低,基底节m I/Cr的比值较对照组明显升高,Cho/Cr和Glx/Cr的均值与对照组无统计学差异。Jayasundar等[9]复习文献结合个案报道后提出是否驱铜治疗和选择的感兴趣区是MRS的结果出现差异的原因,认为未经治疗或致死性的肝豆状核变性患儿较治疗后患儿的NAA/Cr和Cho/Cr明显降低,同时NAA/Cho比值在双侧基底节差异显著,存在非对称性。

表4 脑型疗前组及非脑型组左侧壳核、尾状核头和丘脑部位NAA/Cr均值的比较

表5 病程与左侧壳核、尾状核头及丘脑NAA/Cr均值的相关性
本研究选择左侧壳核、尾状核头及丘脑作为VOI,因铜在广泛分布时具有高度选择性的亲和作用,在脑组织中以基底节神经核团受累为主,尤以豆状核积聚最多、最为常见,其次为尾状核、丘脑、脑干、小脑齿状核,病变广泛时大脑皮质亦可受累,病变常呈双侧、对称性分布。WD脑部的组织病理学改变主要包括脑水肿、坏死以及海绵状变性、脑萎缩等:由于过量蓄积的铜离子具有细胞毒性作用并可引起脑组织慢性缺血,导致脑部神经细胞变性肿胀、坏死消失,神经纤维髓鞘脱失,病变区出现软化、囊变及空腔,继而星形胶质细胞增生肥大,晚期出现脑萎缩、组织结构疏松[10]。NAA是中枢神经系统内浓度最高的代谢物,分布于神经元与轴索,它是标记神经元和轴索生存能力与密度的指标[11]。Cho是磷脂代谢的成分,参与细胞膜的合成与降解,其峰值的高低是由膜磷脂中的胆碱浓度决定的,它可以反映细胞膜磷脂的稳定状态及细胞的增殖程度[12]。Wilson病中Cho增高与病变区星形胶质细胞广泛增生密切相关[13]。且因为Cr作为高能磷酸盐的储备形式及ATP、ADP的缓冲剂,能够直接反映能量代谢情况。Cr值一般不会随病理变化而变化,所以临床上通常用它作为参考值,对代谢信号强度进行标准化,即计算NAA/Cr、Cho/Cr等,作为统计分析数据。Kraft等[6]已将Cr作为内部参照用于WD患者的研究。本研究20例脑型疗前组WD患者壳核、尾状核头及丘脑部位NAA/Cr、Cho/Cr及NAA/Cho的均值与对照组比较均明显降低。与Leandro等[8]研究结果一致。提示上述部位存在明显的神经元丢失或机能损害。证实了研究中发现的NAA/Cr均值的降低与NAA的减少有关。且NAA/Cr比值降低的程度与病程呈负相关,病程越长NAA/Cr比值降低越明显。
将壳核、尾状核头及丘脑部位的NAA/Cr均值比较,发现壳核、尾状核头部位较丘脑部位明显降低,由此可见基底节神经元神经损伤最严重,与MRI提示的受累部位一致,可能与铜离子沉积相关。非脑型组患者临床无神经系统损害表现,MRI多无损害病灶,本研究20例非脑型WD患者1H-MRS结果显示壳核、丘脑NAA/Cr及Cho/Cr的均值与正常对照组比较明显降低,尾状核头部位NAA/Cr、Cho/Cr、NAA/Cho的均值与对照组均无显著性差异。提示在MRI基底节、丘脑部位未出现特征性长T1长T2改变时,已出现神经元丢失或机能受损的代谢性改变,NAA浓度的减低反映出病变兴趣区神经细胞结构损伤、神经元数量减少及神经元代谢异常[11]。而脑型疗前组左侧壳核NAA/Cr及NAA/Cho、尾状核头部位Cho/Cr的均值较非脑型组降低更加明显,故认为脑型WD患者的脑组织损害更加明显。
正规驱铜治疗前后脑组织各部位代谢产物也存在显著性变化。在予DMPS、PCA、DMSA、葡萄糖酸锌和肝豆片等综合驱铜治疗后其临床表现可明显改善[14]。胡瑞琅等[15]报告经治疗后沉积的铜排出,不但临床症状可以好转,而且头颅的MRI也可有相应的好转。本研究发现长期治疗组壳核部位NAA/Cr及NAA/Cho、尾状核头Cho/Cr、丘脑部位NAA/Cr及Cho/Cr的均值与脑型疗前组比较明显升高;而短期治疗前后各部位NAA/Cr、Cho/Cr及NAA/Cho的均值均无统计学差异;且长期治疗组各部位脑代谢产物与正常对照组均无显著性差异。据此推测长期治疗后脑代谢能够明显改善。有研究显示,NAA/Cr比值的降低在某些疾病中是可逆的,可能是由于神经元功能性可逆性的紊乱,而不是神经元坏死[13]。而WD脑部病变的异常信号是铜沉积后引起细胞水肿及神经细胞坏死、海绵状变性和脱髓鞘改变所致[10],有别于不可逆的神经元坏死、囊腔形成和胶质增生。本研究选择的研究对象为病程在6个月~5年的患者,研究结果与之相符。故认为NAA/Cr比值可能作为观察疗效的可逆性非侵袭性指标。
[1]中华医学会神经病学分会神经遗传病学组和运动障碍学组.肝豆状核变性的诊断与治疗指南[J].中华神经科杂志,2008,41(8):566-567.
[2]胡文彬,韩咏竹,薛本春,等.安徽省含山县肝豆状核变性的流行病学研究[J].中华医学杂志,2011,91(13):894-897.
[3]Cheng N,Wang K,Hu WB,et al.Wilson disease in the south Chinese Han population[J].Can J Neurol Sci,2014,41(3): 363-367.
[4]Zhang Y,Wu ZY.Wilson’s disease in Asia[J].Neurol Asia,2011,16(2):103-109.
[5]孙怡,杨任民,韩景献.实用中西医结合神经病学[M].2版.北京:人民卫生出版社,2011:736-746.
[6]Kraft E,Trenkwalder C,Then Bergh F,et al.Magnetic resonance proton spectroscopy of the brain in Wilson’s disease[J].J Neurol,1999,246(8):693-699.
[7]Sanjib S,Taly AB,Ravishankar S,et al.Wilson's disease:31P and 1H MR spectroscopy and clinical correlation[J].Neuroradiology,2010,(11):977-985.
[8]Leandro T,Lucato,Maria Concepción G,et al.Proton MR Spectroscopy in Wilson's Disease:Analysis of 36 Cases[J].American Journal of Neuroradiology,2005,26(5):1066-1071.
[9]Jayasundar R,Sahani AK,Gaikwad S,et al.Proton MR spectroscopy of basal ganglia in Wilson’s Disease:case report and review of literature[J].Magnetic Resonance Imaging,2002(20): 131-135.
[10]Prashanth LK,Sinha S,Taly AB,et al.Do MRI features distinguish Wilson's disease from other early onset extrapyramidal disorders?Ananalysis of 100 cases[J].Movement Disorders,2010,25:672-678.
[11]Tallantyre EC,Bø L,Al-Rawashdeh O,et al.Greater loss of axons in primary progressive multiple sclerosis plaques compared to secondary progressive disease[J].Brain,2009,132(Pt5): 1190-1199.
[12]De Stefano N.Guidelines for using proton MR spectroscopy in multicenter clinical MSstudies[J].Neurology,2007,69: 1942-1952.
[13]Kirov II,Patil V,Babb JS,et al.MR spectroscopy indicates diffuse multiple sclerosis activity during remission[J].Journal Neurol Neurosurg Psychiatry,2009,80:1330-1336.
[14]胡纪源,杨任民,韩咏竹,等.六种金属中毒解毒药治疗肝豆状核变性的临床研究[J].安徽医学,2004,25(5):361-365.
[15]胡瑞琅,张国华.肝豆状核变性[J].实用内科杂志,1988,8(8):444.
Brain1H-MRS study on the effects of copper chelation therapy on WD patients.
WU Shumei,HU Wenbin,HAN Yongzhu,HU Jiyuan,WANG Xun,LI Kai,WANG Gongqiang,WU Junxia,SU Zengfeng,YANG Renmin.Department of Neurology,The Eighth People’s Hospital of Hefei,Hefei 23800,China.Tel:0551-64469234.
Objective To examine the brain metabolic changes in WD patients receiving copper chelation by using1H-MRS.M ethod Thirty-nine patients with WD was random ly divided into four groups:non-brain type group(18 cases),brain type prior-treatment group and short-term treatment group(21 cases),long-term treatment group(20 cases)from short-term treatment group,and 20 healthy volunteers served as a control group.1H-MRS and MRI were performed on patients on 1.5/MR/MRS system to detect these above-mentioned items before and after treatment.Result The mean of NAA/Cr was significantly lower in the left putamen and head of the caudate nucleus than in the left basal ganglion in the 39 patients with WD.The mean of NAA/Cr and Cho/Cr in the left putamen and basal ganglion was significantly lower in non-brain type group than in control group(P<0.01).The mean of NAA/Cr Cho/Cr and NAA/Cho in the left putamen,head of the caudate nucleus and basal ganglion were significantly lower in brain type group than in control group(P<0.01 or P<0.05).The mean of NAA/Cr in the left putamen was much lower in brain type group than in non-brain type group(P<0.01).The mean of NAA/Cr,Cho/Cr and NAA/Cho of short-term treatment group in the left putamen,head of the caudate nucleus and basal ganglion was not significantly different between brain type group and short-term treatment group(P>0.05).The mean of NAA/Cr and NAA/Cho in the left putamen and basal ganglion was much higher in long-term treatment group than in brain type group(P<0.01 or P<0.05).The mean of Cho/Cr in the left head of caudate nucleus were much higher after treatment compared with prior-treatment group(P<0.05).The mean of NAA/Cr in the left putamen,head of the left caudate nucleus and basal ganglion in all groups was negatively correlated with course of the disease.Conclusion There are significant differences in brain metabolism among different type of WD.The long-term but not short-term copper chelation significantly improves brain metabolism.NAA/Cr may be used as a non-invasive indicator to examine the efficacy of treatment.
Wilson disease(WD)Magnetic resonance spectroscopy(MRS)Copper chelation therapy
R742.4
A
2015-03-11)
(责任编辑:李立)
10.3969/j.issn.1002-0152.2015.10.005
☆国家自然科学基金资助项目(编号:81473535)
*合肥市第八人民医院神经内科(238000合肥)△安徽中医药大学神经病学研究所附属医院
※合肥市滨湖医院干部病房神经内科

