一种耐酸热普鲁兰酶生产菌种的分子构建及发酵研究
陈 超,刘校函,俞 峰,纪明华,史吉平,4,孙俊松,4,*(1.天津科技大学生物工程学院,天津00457;.中国科学院上海高等研究院,生物炼制实验室,上海0110;.白银赛诺生物科技有限公司,甘肃白银70914;4.上海科技大学生命科学学院,上海0110)
一种耐酸热普鲁兰酶生产菌种的分子构建及发酵研究
陈超1,2,刘校函3,俞峰3,纪明华2,史吉平2,4,孙俊松2,4,*
(1.天津科技大学生物工程学院,天津300457;2.中国科学院上海高等研究院,生物炼制实验室,上海201210;3.白银赛诺生物科技有限公司,甘肃白银730914;4.上海科技大学生命科学学院,上海201210)
将长野芽胞杆菌的普鲁兰酶基因经密码子优化后,组建了人工合成的二联启动子Pga2,并将它克隆到枯草芽胞杆菌穿梭质粒pMK4-BPB以及自杀质粒pGE-BPB中;经转化和筛选获得了中性蛋白酶基因nprE被敲除的普鲁兰酶生产菌株CH-1;该重组菌在基础培养基中所产普鲁兰酶的酶活达到30.3 U/mL;经过对培养基组分及发酵条件(培养温度、起始pH,起始接种量等)进行优化,确定了发酵的最适碳源为45 g/L的蔗糖,氮源为60 g/L的麸皮+豆粕时,设定初始培养基的pH为6.2,在培养温度为32℃时进行发酵,CH-1发酵产重组普鲁兰酶酶活高达268 U/mL。
普鲁兰酶,枯草芽胞杆菌,基因合成,串联启动子,发酵优化
普鲁兰酶(Pullulanase,EC 3.2.1.41)是一种能够水解糖苷键的解支酶[1-3],在食品行业中主要用于提高淀粉的利用率。此外,普鲁兰酶还可以与其他糖苷水解酶类协同作用于多种多糖底物,获得不同类型的降解产物。因此,普鲁兰酶在化工和制药等行业中也是一种用途广泛的酶类。根据作用位点的不同,普鲁兰酶可以分为Ⅰ型及Ⅱ型酶[4-6]。Ⅰ型普鲁兰酶只能水解多糖的α-1,6糖苷键,而Ⅱ型普鲁兰酶不仅可以水解α-1,6糖苷键,也可以内切α-1,4糖苷键,兼具α-淀粉酶和普鲁兰酶两种酶的活性。与Ⅱ型普鲁兰酶相比,Ⅰ型普鲁兰酶的作用位点更加特异,添加效果显著,目前已得到广泛的工业应用[7-9]。但目前外资企业申请了大量的生产技术专利,基本垄断了普鲁兰酶的生产。因此,开发具有自主知识产权的普鲁兰酶生产技术十分必要,并可带来巨大的经济效益。
来自长野芽胞杆菌(Bacillus naganoensis)的普鲁兰酶(Bn PulB)最适温度62.5℃,最适pH在5.0以下,稳定催化温度在60℃左右,非常适合糖化加工,目前江南大学的实验组已利用大肠杆菌对该酶成功地进行了分泌生产[10-12],酶活表达量达到1156 U/mL。然而枯草芽胞杆菌因分泌能力强大,被列为安全微生物之一,显然更适于食品级普鲁兰酶的工业生产。本研究利用化学合成技术获得了含串联启动子的人工操作子盒Bn PulB Cassette(BPB),经质粒构建、同源重组、无痕基因敲除等分子生物学技术,获得了分泌表达Bn PulB的枯草芽胞杆菌稳定生产菌株,并对培养基及其发酵条件进行了初步的探索,旨为进一步的工业菌株制备及放大生产研究奠定基础。
1 材料与方法
1.1材料与仪器
枯草芽胞杆菌Bacillus subtilis 168(Bs 168)购自美国菌种保藏中心ATCC;穿梭质粒pMK4由美国芽胞杆菌保藏中心(BGSC)馈赠[13];大肠杆菌Escherichia coli DH5α本实验室传代保存;质粒pGENE-nprLR本实验室构建并保藏;质粒及基因组DNA提取试剂盒、PCR清洁回收试剂盒以及DNA凝胶回收等试剂盒均由AxyGEN公司提供;T4连接酶、去磷酸化酶以及DNA限制性内切酶等由TakaRa公司生产;Taq DNA聚合酶购自Fermentas;高保真DNA聚合酶TOYOBO公司的KOD-Plus-;其他生化试剂均为国产或进口分析纯;引物合成、PCR产物的TA克隆、DNA测序和拼接以及DNA合成等服务由苏州金唯智生物科技有限公司完成;所用的引物对名称及序列分别为BPB-F(GGACAAGGCTCAACCCG AACGG)/BPB-R1(GGAAACCGTCAACGTGGTACTC ATTG)、NPR-L(TCATTCGGTTAGACAGCGG)/NPRR(CGTAAGC-AAGACGATAGCTGCCGTC)以及NPRL/BPB-R2(GCGAAAACAGGCTGAAGCTGAACATG AG);LB培养基1.0%NaCL,1.0%胰蛋白胨,0.5%酵母浸取物;初始发酵培养基2.0%玉米淀粉,1.0%蛋白胨,0.5%(NH4)2SO4,0.1%KH2PO4,同时每升补加0.25 g MgSO4,0.001 g FeSO4。
ZHWY-2102控温摇床上海志诚设备厂;TU-1810型紫外分光光度计北京普析通用仪器有限责任公司;SHA-B水浴恒温振荡器江苏国华仪器厂;Mastercycler梯度PCR仪德国Eppendorf;NanoDrop 2000微量分光光度计美国Thermo Scientific。
1.2实验方法
1.2.1普鲁兰酶表达操作子的设计如图1(A)所示,用于普鲁兰酶表达的基因操纵子(BPB)包括一个由串联启动子Pga2以及进行了密码子优化的编码Bn PulB(GenBank:AEV53626.1)的基因序列和一个短的终止子序列,其中Pga2是由启动子PyxiE[14]及RNA稳定因子CryIIIA[15-16]构成,编码淀粉酶基因amyL的分泌肽[17]是SPamyL,以上序列文件可见于补充文件。
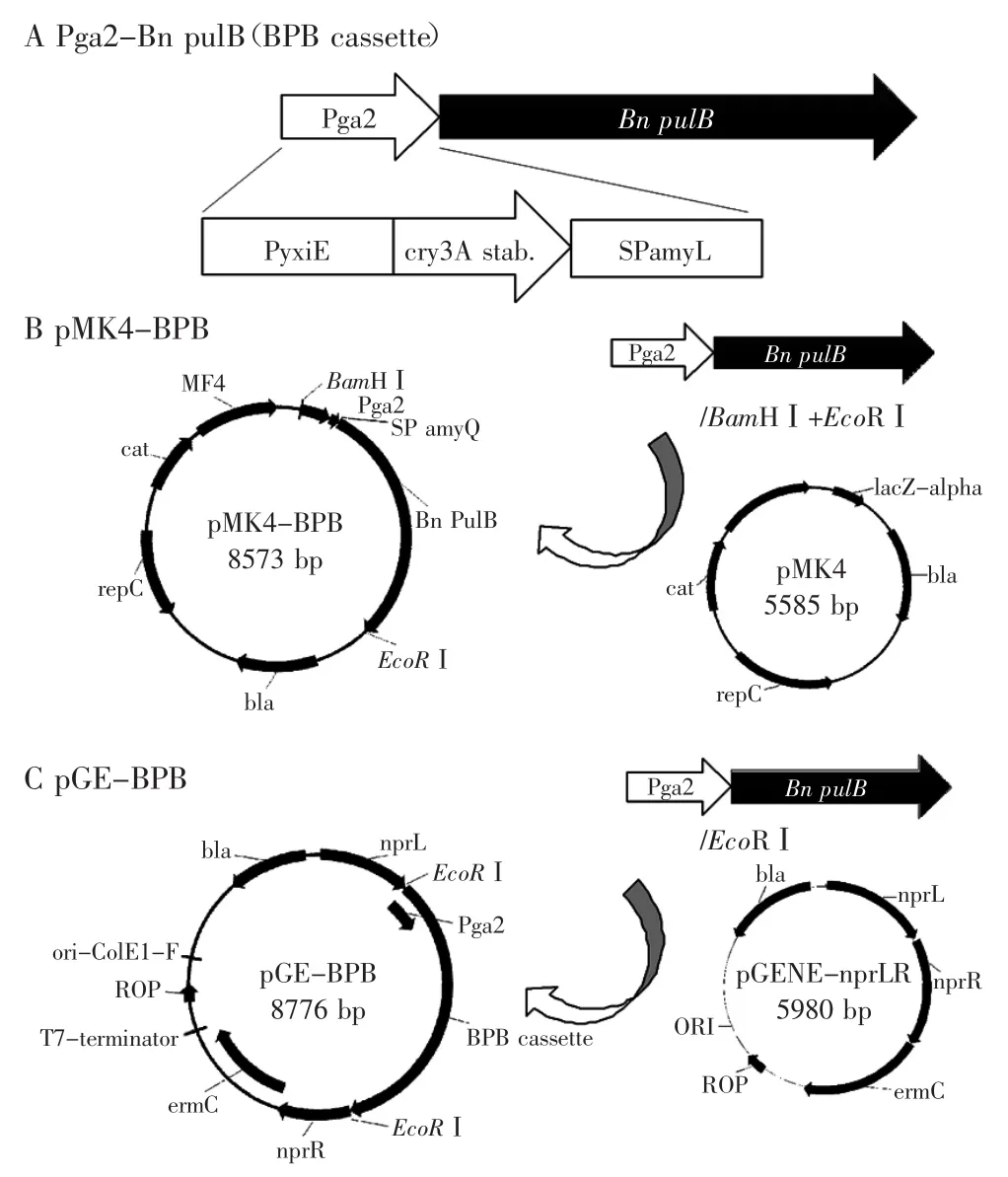
图1 编码普鲁兰酶的人工操作子及其表达质粒的构建Fig.1 Construction of plasmids for expression of recombinant pullulanase
1.2.2表达质粒、重组质粒的构建及枯草芽胞杆菌的转化和二次重组筛选如图1(B)所示,表达Bn PulB的完整操纵子BPB全长3011个碱基,经BamHⅠ和EcoRⅠ酶切后,构建到枯草芽胞杆菌质粒pMK4中,得到表达质粒pMK4-BPB;而两端带有EcoRⅠ位点的BPB由PCR获得,产物经纯化后,以EcoRⅠ酶切,与经EcoRⅠ和去磷酸化处理的线性质粒DNA pGENE-nprLR连接,得到重组质粒pGE-BPB(图1C)。将pGEBPB转入枯草芽胞杆菌168感受态细胞,其制备由两次培养方式完成[18],先将枯草芽胞杆菌168在LB琼脂板活化,取单克隆在LB中培养,以5%的体积比转接到SPⅠ培养基中,200 r/min,37℃振动培养大约3 h到对数生长期,然后同样稀释转接到SPⅡ培养基中同样方式培养大约4 h到对数生长期,2500×g、离心10 min收集形成OD600大约为5.0的浓缩感受态细胞;转化168感受态细胞时,取1.0 μg的质粒DNA,与50 μL细胞混匀后冰浴30 min,加入5 mL LB培养基于37℃振动培养2 h,最后将细胞浓缩至500 μL,取100 μL涂板到含有筛选标记的培养板上,37℃培养至菌体克隆生成。
如图2所示,筛选标记的去除通过二次重组完成[19]:首先取2株经验证已整合有重组质粒的单菌体细胞(168/pGE-BPB),接种到不含抗生素的培养基中,12 h后传代一次,4~5次传代后,稀释并涂到无抗生素的培养板上,取100~200左右的单个菌体克隆,将它们分别在无抗及含有5 μg/mL红霉素的LB平板上进行抗生素的耐受鉴定,在得到10个左右不耐受抗生素的克隆后,对其进行基因组型的PCR鉴定,最终获得重组了单拷贝普鲁兰酶基因的菌株CH-1。
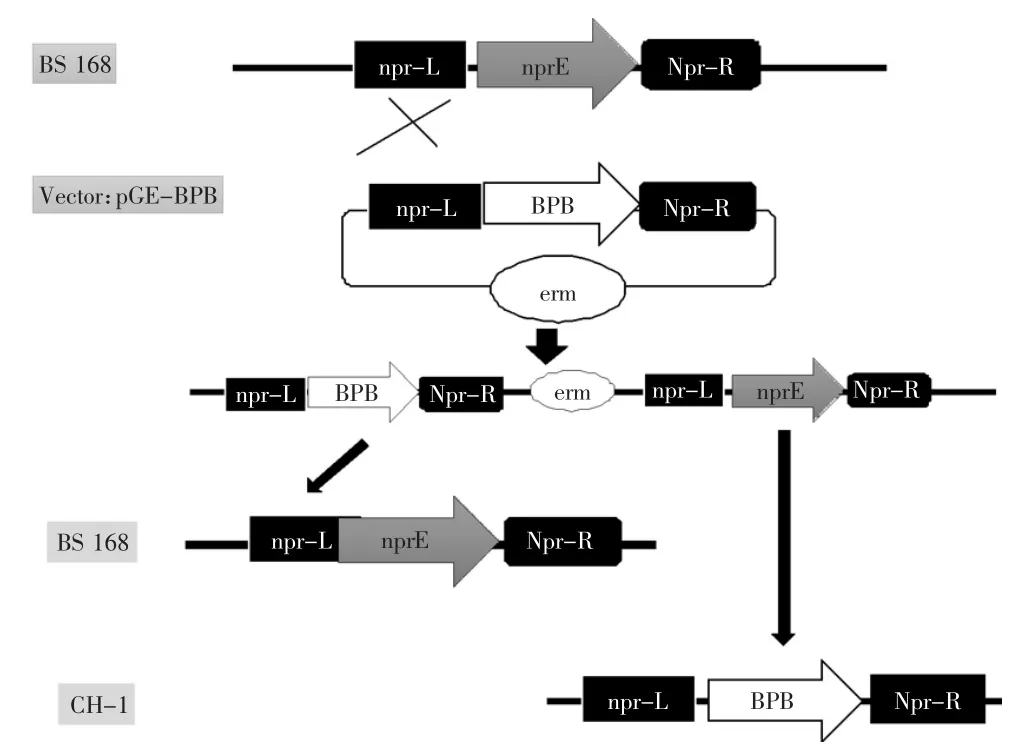
图2 产普鲁兰酶重组菌株CH-1的构建过程Fig.2 Construction of pullulanase producing strain CH-1 through genomic integration
1.2.3产普鲁兰酶枯草芽胞杆菌的摇瓶培养挑取培养皿上单菌落接到装有50 mL LB培养基的250 mL三角瓶中,37℃、200 r/min摇床培养16 h,然后以1%的接种量将种子转接到装有50 mL培养基的500 mL三角瓶中,37℃、200 r/min摇床培养72 h。发酵液采样从接种12 h后开始进行,每隔6 h或12 h,取1 mL培养液,10000×g离心5 min收集培养上清及细胞沉淀。
1.2.4产普鲁兰酶枯草芽胞杆菌的发酵优化初始发酵培养基中含有20 g/L的玉米淀粉为碳源,为了确定最适的发酵碳源,分别以20 g/L的玉米粉、甘油、葡萄糖、蔗糖、普鲁兰糖、可溶淀粉等多种碳源替代,然后进行产酶发酵;在确定蔗糖最佳浓度的发酵实验中,分别添加0.5%、1.0%、1.5%,递增0.5%直至5.5%的蔗糖作为碳源,取代初始培养基中20 g/L的玉米粉;在分析产酶的最适氮源时,分别以50 g/L的麸皮、豆粕、牛肉膏、蛋白胨、酵母粉、1∶1混合的豆粕+麸皮或者麸皮+蛋白胨,替代初始培养基中的蛋白胨和硫酸铵,碳源为45 g/L的蔗糖;为了确定最适氮源浓度,15、30、45、60、75、90、105 g/L的豆粕+麸皮(1∶1)被用作氮源进行摇瓶发酵,碳源为45 g/L的蔗糖;在最适pH及最佳发酵温度的确定实验中,60 g/L豆粕+麸皮和45 g/L蔗糖分别被用作氮源和碳源,发酵温度分别为30、32、37、40、42℃;在确定最适初始pH时,培养温度为32℃,60 g/L豆粕+麸皮和45 g/L蔗糖分别被用作氮源和碳源,培养基的初始pH分别调整为4.0、5.0、6.0、6.2(自然pH)、7.0及8.0。
1.2.5普鲁兰酶酶活分析采用3,5-二硝基水杨酸法(DNS法)[20]。略有改动,具体如下:在1.0 mL 0.5%的普鲁兰糖溶液中加入1.0 mL pH4.6的醋酸-醋酸钠缓冲液,然后加入1.0 mL的酶液(对照组先将1.0 mL酶液沸水浴10 min),于60℃水浴锅中水浴30 min,加入3,5-二硝基水杨酸3.0 mL,沸水浴10 min,取出后流水冷却,于550 nm测光吸收值。一个酶活力单位定义为:在上述反应条件下,每分钟分解普鲁兰糖释放出1 μmol葡萄糖所需的酶量。
2 结果与分析
2.1产普鲁兰酶重组枯草芽胞杆菌CH-1的PCR鉴定
野生型菌株及重组菌株的基因组型可以使用PCR完成鉴定,其中引物对BPB-F/BPB-R1特异地扩增普鲁兰酶基因pulB的DNA片断(0.7 ku),主要用于验证第一次同源重组后的阳性克隆;引物对NPR-L/ NPR-R用于扩增出野生型Bs 168中nprE操纵子的DNA片断(0.8 ku);而引物对NPR-L/BPB-R2则用于鉴定二次重组后阳性克隆的基因型(2.0 ku)。表达菌株168/pMK4-BPB因含有质粒,进行分子生物学验证比较容易,因为质粒pMK4-BPB可以从枯草芽胞杆菌中分离提取。而重组菌株CH-1整合了表达普鲁兰酶的操作子BPB,此外,该菌株的中性蛋白酶基因nprE被原位敲除。图3列出了3组用于鉴定PCR的引物的位置以及PCR产物的理论长度,它们分别为0.7 ku及2.0 ku的普鲁兰酶基因特异DNA片断和0.8 ku的nprE基因产物。如鉴定结果(图3)所示,以Bs 168基因组DNA为模板时,只能得到0.8 ku的DNA产物,而以重组菌株CH-1基因组DNA为模板时,可以分别获得0.7 ku及2.0 ku的两个PCR产物,完全验证了CH-1的基因组型。
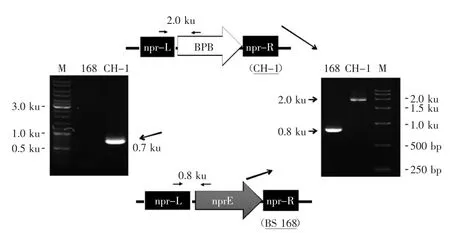
图3 普鲁兰酶重组菌株CH-1的分子鉴定Fig.3 Molecular identification of markerless strain CH-1 by PCR
2.2重组普鲁兰酶的多拷贝质粒表达及单拷贝的基因组表达
重组菌株168/pMK4-BPB含有多拷贝的表达质粒,抗氯霉素;整合了单一拷贝普鲁兰酶基因的重组菌株CH-1无筛选标记,且敲除了中性蛋白酶基因,遗传稳定性更好。为了对这两种表达菌株的产普鲁兰酶能力进行验证,分别将其接种到含有1.0%葡萄糖的无抗性基本营养培养基中,进行连续发酵培养,时间长达72 h,结果如图4所示,这两种重组菌呈现出不同的产酶特点,但均呈现出在特定时间段内出现产酶高峰的特点:168/pMK4-BPB的产酶峰值出现在36 h左右,达到38.3 U/mL,而CH-1的酶活峰值为30.3 U/mL,位于发酵48 h左右。
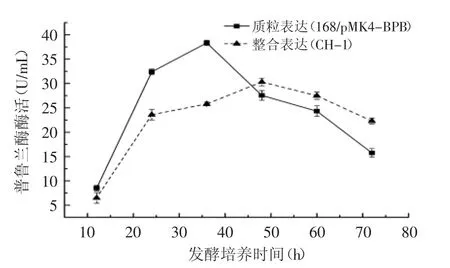
图4 不同类型的重组菌株的产普鲁兰酶发酵产酶随时间的变化Fig.4 Production of heterologous pullulanase from different recombinant Bacillus strains
这说明多拷贝的重组菌株在平行发酵中有更好的酶活表现,酶活出峰时间也较早,但随着时间延长,峰值下降较快,而CH-1虽然酶活稍低,但发酵酶活曲线更为平稳,考虑到CH-1的培养不需要添加抗生素,可以满足食品工业普鲁兰酶生产的要求。因此,后续的发酵优化,主要集中于对CH-1的研究。
2.3碳源种类及浓度对CH-1产酶的影响
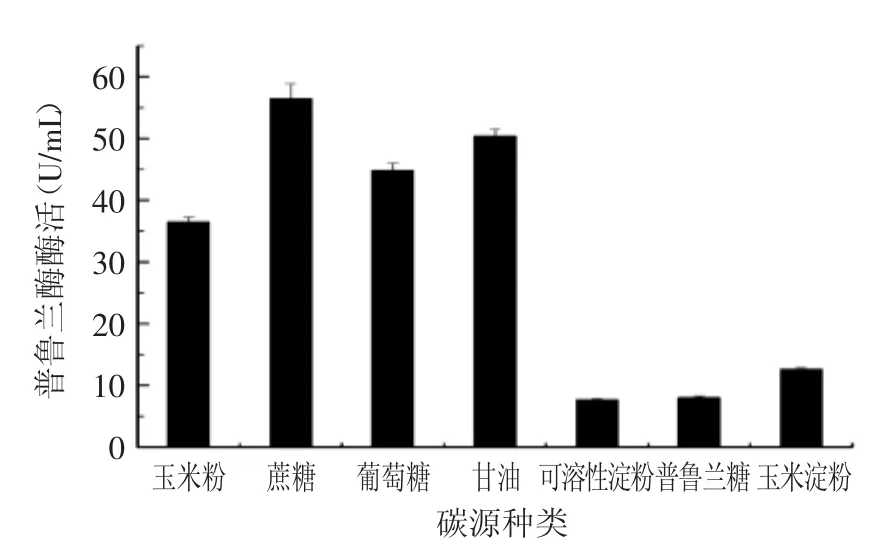
图5 碳源种类对产酶的影响Fig.5 Effect of carbon sources on the production of Bn PulB
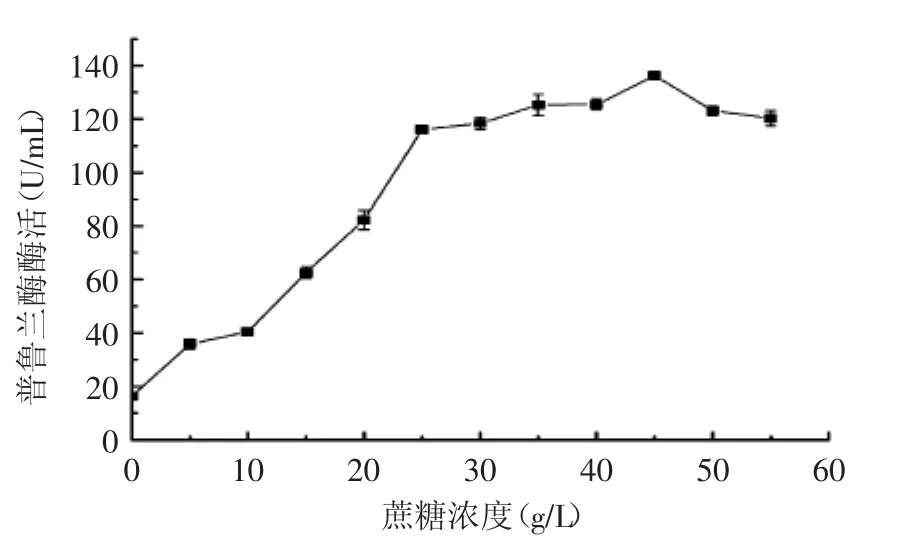
图6 蔗糖浓度对产酶的影响Fig.6 Effect of sucrose concentration on the production of Bn PulB
培养基中不同碳源对枯草芽胞杆菌蛋白分泌的状态影响很大,首先通过使用不同种类的碳源替代基础发酵培养基中的玉米淀粉(20 g/L),在保持其他发酵条件不变的条件下,检测发酵培养后发酵液的普鲁兰酶活,找出最佳的碳源基本成分。由图5所示,在以蔗糖和甘油作为碳源时,重组菌的发酵酶活较高,葡萄糖和玉米粉次之,而可溶性淀粉,玉米淀粉的发酵效果不理想。接着测试了在培养基中添加不同浓度的蔗糖对CH-1产普鲁兰酶的影响,由图6可见,蔗糖添加量为45 g/L时,发酵液中的普鲁兰酶酶活最高,达到137 U/mL。
2.4不同有机氮源及含量对产酶的影响
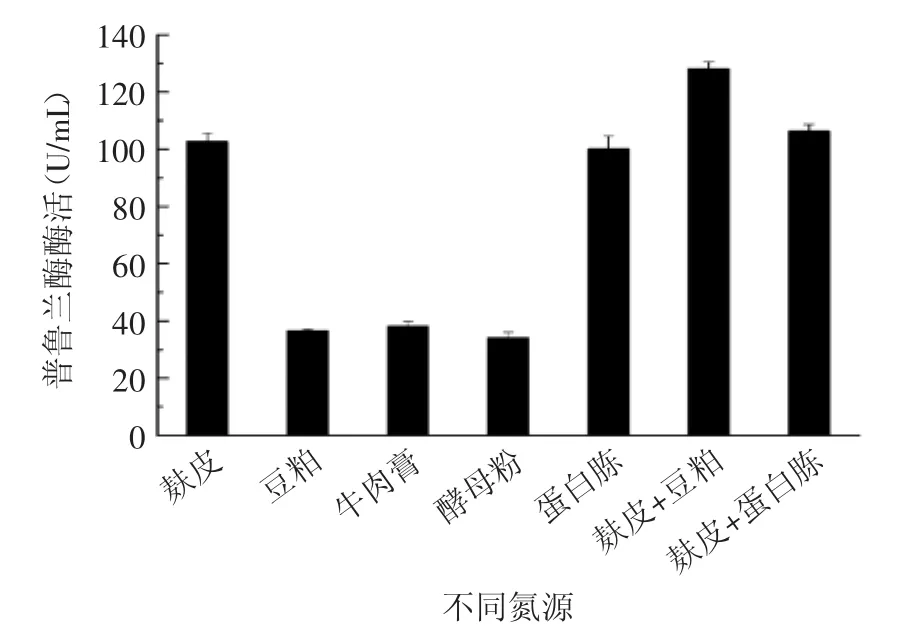
图7 氮源种类对产酶的影响Fig.7 Effect of different nitrogen source on the production of pullulanase
氮源含量及组成是影响发酵的重要因素之一,根据枯草芽胞杆菌分泌和营养需求的特点,多种不同的有机氮源(图7)以不同的配比加入培养基中,但总氮源含量确定为50 g/L,结果显示,在相同的发酵条件下,麸皮+豆粕(麸皮∶豆粕=1∶1)产酶效果最佳,酶活达到128.5 U/mL,而且麸皮和豆粕的价格较为低廉,比较适合工业级放大生产。因此接下来开展了以不同浓度的麸皮和豆粕为氮源的发酵优化,结果如图8所示,不同浓度的麸皮+豆粕氮源对CH-1发酵产酶产生很大的影响。由图8可知,当有机氮原料的浓度为90 g/L时,菌株分泌的普鲁兰酶酶活最高,达到214 U/mL。但90 g/L的氮源添加量太大,不仅会造成培养液的粘度过大,不利于菌株的好氧生长,也不利用工业生产中的成本控制,因此,以50~60 g/L左右的麸皮+豆粕作为起始养份,后期发酵中再进行补料可能是更为理想的氮源补加方案。
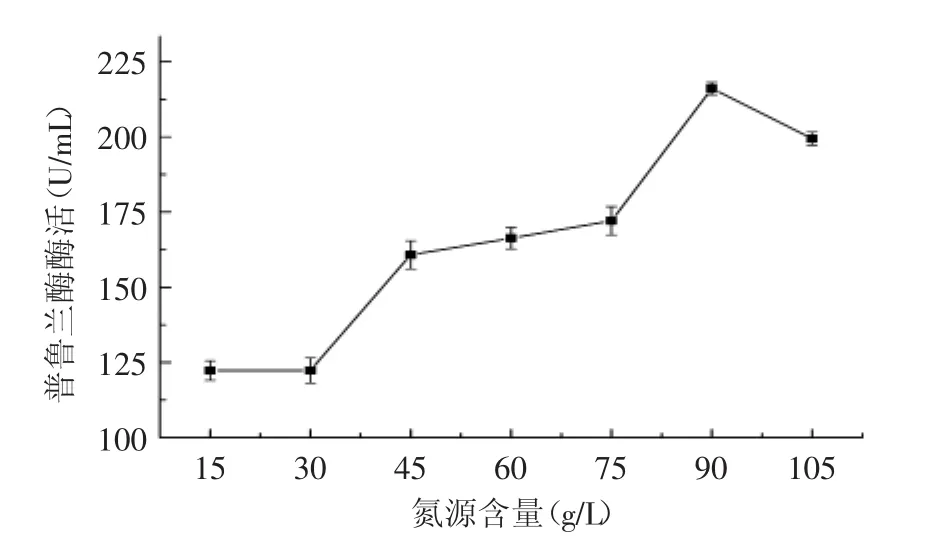
图8 氮源种类对产酶的影响Fig.8 Effect of concentration of nitrogen source on productivity of recombinant pullulanase
2.5温度、pH等发酵因素对菌株CH-1产酶的影响
由于Bs 168的发酵培养温度范围比较宽,28~42℃均可以正常生长,因此有必要对产酶的最佳温度进行探索,结果如图9所示,32℃进行发酵时,分泌产普鲁兰酶酶活最高,达到226 U/mL。而在更高温度发酵时,虽然细胞生长较快,营养利用速度快,但是检测到的酶活却没有相应提升,提示宿主细胞的最佳繁殖状态和最佳的产酶状态没有保持一致,因此在32℃低温培养可能更利于重组普鲁兰酶的蛋白折叠或胞外分泌。
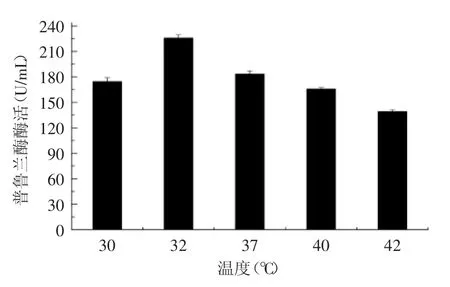
图9 发酵温度对产酶的影响Fig.9 Effect of temperature on the expression level of the enzyme
此外,实验发现,培养基不同的初始pH对普鲁兰酶的重组表达及分泌也有影响,结果如图10所示,起始pH过大过小都不利于发酵产酶。实验结果显示,利用初始pH为6.2的培养基进行发酵时可以获得比较高的酶活,达到268 U/mL,比优化前的摇瓶发酵的产酶量提高了8倍多,使得CH-1初步具备了进行工业生产的能力,为利用该菌进一步的放大中试培养及发酵优化提供了实验依据。
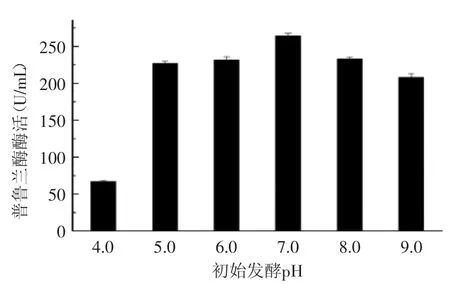
图10 培养基起始pH对产酶的影响Fig.10 Effect of initial pH of the medium on the expression level of the enzyme
3 结论和讨论
普鲁兰酶分泌表达菌株的构建是当前工业酶研究的热点之一,尽管大肠杆菌也可以高效分泌普鲁兰酶[12,21],但枯草芽胞杆菌表达系统具有生产这类胞外酶的天然优势。本实验通过对芽胞杆菌高效启动子的分子构建,利用基因合成技术,组建了长约3 ku的人工操纵子元件BPB并分别导入表达质粒pMK4及重组质粒pGENE-nprLR中,经转化后获得含有表达质粒的枯草芽胞杆菌168/pGE-BPB及整合表达菌株CH-1。初步发酵证实这两种表达菌株均能分泌表达耐酸热的普鲁兰酶Bn PulB,拥有多拷贝表达质粒的菌株发酵酶活稍高,但出于遗传稳定性及食品工业酶生产要求的需要,重点针对CH-1展开了一系列地发酵优化研究,并初步确定了发酵的最适碳源为4.5%的蔗糖,60 g/L麸皮+豆粕为氮源的基本发酵成分,并发现在初始培养基的pH为6.2,培养温度为32℃时进行发酵,重组普鲁兰酶的酶活达到268 U/mL,是单一因素优化前的8倍多,为今后的多元素组合优化奠定了分析基础。
本研究中所用的重组枯草芽胞杆菌菌株CH-1只含有一个拷贝的外源操纵子,为进一步提高重组菌株的产酶能力,将来可以利用分子技术整合多份拷贝到宿主细胞的基因组中。而且,由于Bn pulB被整合到基因组中,传统地物化诱变等依然可以应用于CH-1的诱变育种。由于CH-1不带抗性基因,可以进一步对细胞展开一系列的基因操作,例如敲除原宿主细胞中与芽胞产生相关的基因sigF[22]、碱性蛋白酶相关基因aprE以及与外源普鲁兰酶竞争分泌通路的淀粉酶基因amyE等,而这些都是可能提升重组普鲁兰酶产量的有效途径。此外,对发酵过程的各项参数进行精细控制和系统分析,进一步优化发酵过程,确定最佳工业发酵条件,也是有待进行的重要研究内容。
[1]Crabb WD,Shetty JK.Commodity scale production of sugars from starches[J].Current Opinion of Microbiology,1999,2(3):252-256.
[2]Bertoldo C,Antranikian G.Starch-hydrolyzing enzymes from thermophilic archaea and bacteria[J].Current Opinion of Chemical Biology,2002,6(2):151-160.
[3]NishaM, SatyanarayanaT.Recombinantbacterial amylopullulanases:developmentsandperspectives[J]. Bioengineered,2013,4(6):388-400.
[4]Hatada Y,Igarashi K,Ozaki K,et al.Amino acid sequence and molecular structure of an alkaline amylopullulanase from Bacillus that hydrolyzes α-1,4 and α-1,6 linkages in polysaccharides at different active sites[J].Journal of Biological Chemistry,1996,271(39):24075-24083.
[5]焦豫良,王淑军,吕明生.GH57家族高温淀粉普鲁兰酶的结构与功能分析[J].微生物学报,2011,51(1):21-28.
[6]Doman-Pytka M,Bardowski J.Pullulan degrading enzymes of bacterial origin[J].Critical Reviews in Microbiology,2004,30(2):107-121.
[7]Chulein MS,Hojer-Pedersen B.Characterization of a new class of thermophilic pullulanase from Bacillus acidopullulyticus[J].Annual New York Academic Sciences,1984,434(7):271-274.
[8]Kunamneni A,Singh S.Improved high thermal stability of pullulanase from a newly isolated thermophilic Bacillus sp.AN-7[J].Enzyme and Microbial Technology,2006,39(7):1399-1404.
[9]Ara K,Saeki K,Igarashi K,et al.Purification and characterization of an alkaline amylopullulanase with both α-1,4 and α-1,6-hydrolytic activity from alkalophilic Bacillus sp. KSM-1378[J].Biochimica et Biophysica Acta,1995,1243(3):315-324.
[10]Teague WT,Brumm PJ.Pullulanase expression construction containing α-amylase promoter and leader sequence.US,6300115[P/OL].2001-10-9.http://www.freepatentsonline.com/ 6300115.pdf.
[11]严伟,聂尧,徐岩.长野芽胞杆菌(Bacillus naganoensis)普鲁兰酶在大肠杆菌中的活性表达与分泌调控[J].微生物学报,2013,53(2):145-153.
[12]NIE Y,YAN W,XU Y,et al.High-Level expression of Bacillus naganoensis pullulanase from recombinant Escherichia coli with auto-induction:effect of lac operator[J].PLoS ONE 2013,8(10):e78416.
[13]Brueckner R.A series of shuttle vectors for Bacillus subtilis and Escherichia coli[J].Gene,1992,122(1):187-192.
[14]ZHANG AL,LIU H,YANG MM,et al.Assay and characterization of a strong promoter element from B.subtilis[J]. Biochemical and Biophysical Research Communications,2007,354(1):90-95.
[15]Agaisse H,Lereclus D.Structural and functional analysis of the promoter region involved in full expression of the cryIIIA toxin gene of Bacillus thuringiensis[J].Molecular Microbiology, 1994,13(1):97-107.
[16]Agaisse H,Lereclus D.STAB-SD:a Shine-Dalgarno sequence in the 5’-untranslated region is a determinant of mRNA stability[J].Molecular Microbiology,1996,20(3):634-644.
[17]Sibakov M.High expression of Bacillus licheniformisαamylase with a Bacillus secretion vector[J].European Journal of Biochemistry,1986,155(3):577-581.
[18]李瑞芳,薛雯雯,黄亮.枯草芽孢杆菌(Bacillus subtilis)感受态细胞的制备及质粒转化方法研究[J].生物技术通报,2011,65(5):227-230.
[19]Arnaud M,Chastanet A,Debarbouille M.New vector for efficientallelicreplacementinnaturallynontransformable,Low-GC-Content,Gram-PositiveBacteria[J].Appliedand Environmental Microbiology,2004,70(11):6887-6891.
[20]Jinho Kang,Kyung-Min Park,Kyoung-Hwa Choi,et al. Molecular cloning and biochemical characterization of a heatstable type I pullulanase from Thermotoga neapolitana[J].Enzyme and Microbial Technology,2011,48(3):260-266.
[21]CHEN A,LI Y,LIU X,et al.Soluble expression of pullulanase from Bacillus acidopullulyticus in Escherichia coli by tightly controlling basal expression[J].Journal of Industrial Microbiology&Biotechnology,2014,41(12):1803-1810.
[22]Margolis P,Driks A,Losick R.Establishment of cell type by compartmentalized activation of a transcription factor[J].Science,1991,254(5031):562-565.
Construction of a thermostable pullulanase producing bacillus strain and its fermentation studies
CHEN Chao1,2,LIU Xiao-han3,YU Feng3,JI Ming-hua2,SHI Ji-ping2,4,SUN Jun-song2,4,*
(1.College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China;2.Shanghai Advanced Research Institute,Chinese Academy of Sciences,Shanghai 201210,China;3.Baiyin Sinozyme Corp,Baiyin 730914,China;4.School of Life Science and Technology,Shanghai Tech University,Shanghai 201210,China)
A codon optimized thermostable pullunase gene(Bn pulB)was synthesized and cloned behind an artificial tandom promter Pga2.The synthetic cassette was used to generate a suicide plasmid pGE-BPB;transformation of the plasmid into Bacillus subtilis 168 led to a pullulanase producing recombinant strain CH-1 with native nprE deleted.Initially,30.3 U/mL of extracellular pullulanase was detected by CH-1 on regular medium supplemented with glucose,up to 268 U/mL of enzyme was detected by fermentation at 32℃ in medium with initial pH at 6.2,using 45 g/L of sucrose as carbon source and 60 g/L of wheat bran plus bean pulp as nitrogen source.
pullulanase;Bacillus subtilis;synthetic operon;tandem promoter;fermentation optimization
TS201.3
A
1002-0306(2015)20-0214-06
10.13386/j.issn1002-0306.2015.20.037
2015-01-22
陈超(1989-),男,硕士研究生,研究方向:生物工程,E-mail:19890801chenwei@163.com。
孙俊松(1974-),男,博士,研究员,研究方向:酶工程与生物化工,E-mail:sunjs@sari.ac.cn。
上海市长三角科技联合攻关领域项目(15295810600)。

