法舒地尔对压力超负荷大鼠心脏的肌成纤维细胞表型分化的影响
赵凌杰 张蓓蓓 赵智明 张静 郭郡浩
心肌纤维化是诸多心血管疾病共同的病理改变,可引起慢性心力衰竭和恶性心律失常,其重要特征是肌成纤维细胞(myofibroblast,MFB)表型分化及持续活化[1]。Rho/ROCK信号通路广泛参与多种细胞功能,如细胞收缩、肌动蛋白骨架重组、黏附、迁移、增殖、分裂和基因表达等。大量研究表明,Rho/Rho激酶信号通路介导的肌动蛋白细胞骨架重组在MFB表型分化、收缩和迁移等行为中具有重要作用[2-3],故阻断 Rho/Rho激酶信号通路是治疗心肌纤维化的重要目标[4]。我们前期的研究发现,Rho激酶非选择性抑制剂法舒地尔具有良好的抗心肌纤维化效果[5]。本实验拟进一步观察法舒地尔对压力超负荷大鼠心脏MFB分化的影响及机制,探究法舒地尔抑制心肌纤维化的可能机制。
1 材料与方法
1.1 实验动物、药品及主要试剂
SPF级6周龄雄性SD大鼠50只,体重(180±20)g,由南京军区南京总医院动物实验中心提供[许可证号:SYXK(苏)2003-0032]。盐酸法舒地尔注射液(2 ml:30 mg)由天津红日药业股份有限公司惠赠,羟脯氨酸(hydroxyproline,HYP)测定试剂盒购自南京凯基生物技术发展有限公司,血管紧张素Ⅱ(angiotensionⅡ,AngⅡ)Elisa试剂盒购自上海雅吉生物公司,磷酸化肌球蛋白磷酸酶靶蛋白亚基1(phosphorylated myosin phosphatase target subunit 1,p-MYPT1)一抗购自北京博奥森生物公司,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、骨桥蛋白(osteopontin,OPN)和转化生长因子 β1(transforming growth factor-β1,TGF-β1)一抗购自武汉博士德生物工程有限公司。
1.2 心肌纤维化模型制备
大鼠适应性喂养5 d,造模手术前禁食12 h,自由饮水。给大鼠编号,按照随机数表法随机取8只为Sham组,42只为手术组。用10%水合氯醛(3 ml/kg)腹腔注射麻醉。常规备皮消毒,于剑突下沿腹正中线逐层开腹,在肾动脉上方分离腹主动脉。手术组按照Anversa等[6]的方法用腹主动脉缩窄术制备压力超负荷诱导的心肌纤维化模型,在肾动脉上方0.5 cm用直径0.7 mm银夹夹闭,使腹主动脉缩窄60% ~70%,而 Sham组不予夹闭腹主动脉。确认无出血,关闭腹腔。术后禁食6 h,并给予青霉素10万U/kg肌注3 d预防感染。
1.3 分组及药物干预
术后4周末共有36只大鼠存活,手术组死亡14只,Sham组无死亡。将手术组大鼠按照随机数表法分为:Model组(10只)、FH 组(9只)和 FL组(9 只),分别经腹腔注射生理盐水 2 ml·kg-1·d-1、法舒地尔 30 mg·kg-1·d-1和法舒地尔10 mg·kg-1·d-1。Sham 组(8 只)经腹腔注射生理盐水2 ml·kg-1·d-1。术后8周末共有31只大鼠存活,手术组死亡5只(Model组3只、FH组和FL组各1只),死亡原因主要为严重心力衰竭。
1.4 标本采集及心肌病理形态分析
所有大鼠麻醉后打开胸腔,心脏穿刺收集血液5~10 ml以4 000 rpm离心10 min后取上清(血浆样品)。迅速剪取心脏,除去心房及右心室游离壁,仅保留左心室及室间隔。透壁剪取左室心尖部分组织投入液氮中,其余组织放于4℃的4%多聚甲醛中固定24 h。常规取材、脱水、石蜡包埋,沿左室长轴线每隔1 mm横断面切取数张4 μm厚的切片,行HE和Masson染色。光镜下观察组织形态,采用Image-Pro Plus 6.0软件测定纤维化面积。以视野中所有蓝色胶原(Masson染色:胶原纤维呈蓝色,心肌细胞呈红色)面积之和(不包括血管周围胶原面积)除以心肌纤维和结缔组织面积总和,计算左心室间质胶原容积分数(collagen volume fraction,CⅤF)。以血管周围胶原面积除以血管面积,计算血管周围胶原容积分数(perivascular collagen volume fraction,PCⅤF)。
1.5 心肌HYP含量测定
准确称取60 mg液氮中心肌组织放入试管中,按照HYP试剂盒说明书以碱水解法提取蛋白,比色法检测样本吸光度,计算HYP含量。
1.6 酶联免疫吸附法检测心肌和血浆AngⅡ浓度
取冻存的心肌组织50~100 mg,研磨成匀浆,4 000rpm离心10 min,取上清。分别测定血浆和心肌样品中总蛋白的浓度。再按照Elisa试剂盒说明书,测定样品中AngⅡ的浓度。结果以测定蛋白浓度与总蛋白浓度的比值来表示。
1.7 免疫组化染色分析心肌 p-MYPT1、α-SMA、TGF-β1和OPN的表达
切片烘烤后,常规二甲苯脱蜡及乙醇梯度脱水,柠檬酸盐抗原修复缓冲液中进行抗原修复。灭活过氧化物酶,加入一抗孵育过夜,加入HRP标记二抗,DAB显色,苏木素复染,脱水并封片。光镜下观察组织细胞中蛋白的表达情况,细胞质中黄色为表达阳性,每张切片随机取5个视野拍照。用Image-Pro Plus 6.0测量这些区域的平均光密度(MOD),即阳性累积光密度除以照片面积。因为α-SMA还表达于血管平滑肌细胞,计算时选择血管平滑肌细胞外区域进行分析。
1.8 统计学方法
2 结果
2.1 法舒地尔对大鼠心肌病理形态的影响
图1(HE染色)和图2(Masson染色)显示了各组大鼠心肌病理学改变,与Sham组比较,Model组心肌纤维明显增粗且排列紊乱,间质和血管周围大量蓝色胶原沉积。与Model组比较,FH组心肌组织情况明显改善,接近Sham组,FL组心肌纤维增粗、紊乱,间质和血管周围胶原沉积,但较Model组减轻。
2.2 法舒地尔对大鼠心肌纤维化程度的影响
心肌HYP含量及Masson染色蓝色胶原的面积分数可反映心肌纤维化程度,其中CⅤF和PCⅤF可分别用于评估间质纤维化和血管周围纤维化程度。如表1所示,与Sham组比较,Model组心肌HYP含量、CⅤF及PCⅤF显著升高(P <0.01),心肌纤维化程度明显加重。与Model组比较,FH组和FL组心肌HYP含量、CⅤF及PCⅤF均不同程度的降低(P<0.05或P<0.01),心肌纤维化程度均有所减轻。
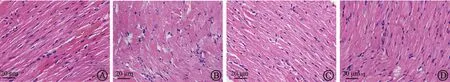
图1 各组大鼠心肌病理学改变HE染色(×400)
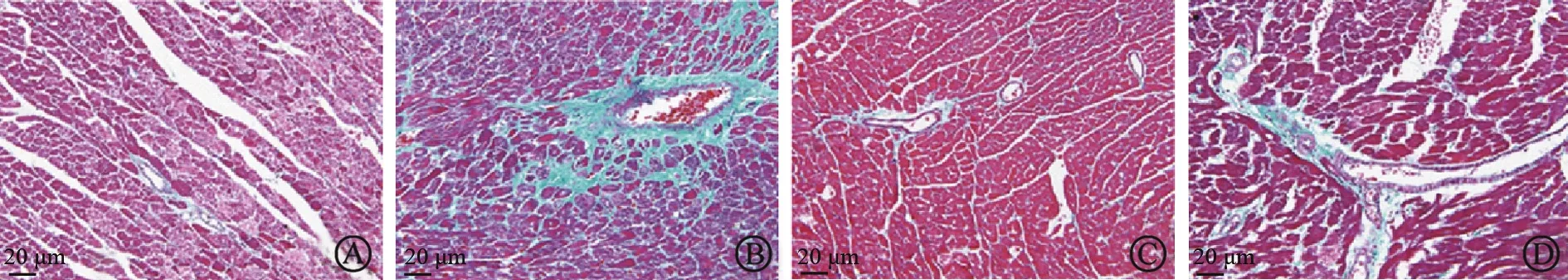
图2 各组大鼠心肌病理学改变Masson染色(×200)
表1 各组大鼠心肌HYP含量、CⅤF和PCⅤF比较()
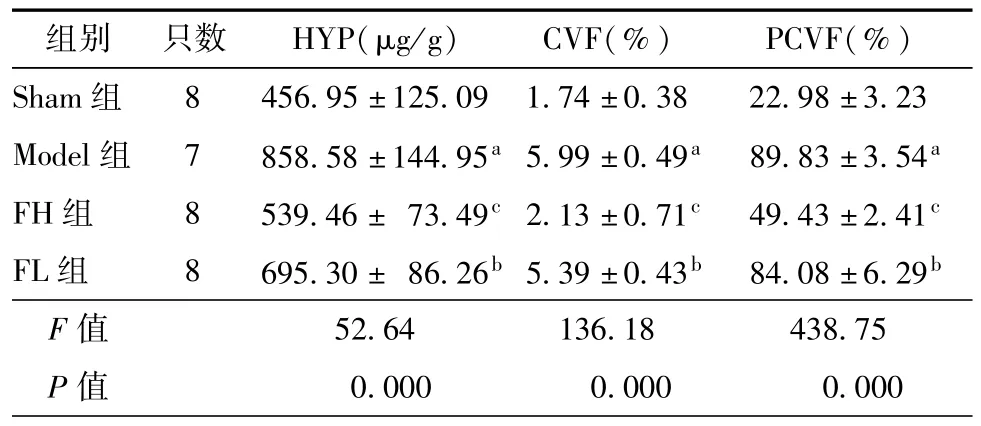
表1 各组大鼠心肌HYP含量、CⅤF和PCⅤF比较()
注:与Sham组比较,aP<0.01,与Model组比较,bP <0.05,cP <0.01
组别 只数 HYP(μg/g) CⅤF(%) PCⅤF(%)Sham组 8 456.95±125.09 1.74±0.38 22.98±3.23 Model组 7 858.58±144.95a5.99±0.49a 89.83±3.54a FH组 8 539.46± 73.49c2.13±0.71c 49.43±2.41c FL组 8 695.30± 86.26b5.39±0.43b 84.08±6.29b F值 52.64 136.18 438.75 P值 0.000 0.000 0.000
2.3 法舒地尔对大鼠血浆和心肌AngⅡ含量影响
酶联免疫吸附法检测结果如表2所示,与Sham组比较,Model组大鼠血浆和心肌AngⅡ含量显著升高(P<0.01);与Model组比较,FH组和FL组大鼠血浆和心肌AngⅡ的含量均显著降低(P<0.05或P <0.01)。
表2 各组大鼠血浆和心肌AngⅡ含量()
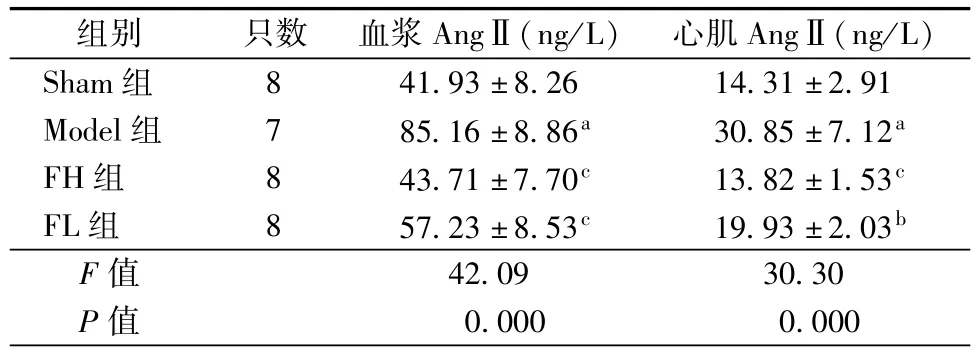
表2 各组大鼠血浆和心肌AngⅡ含量()
注:与Sham组比较,aP<0.01,与Model组比较,bP<0.05,cP <0.01
组别 只数 血浆AngⅡ(ng/L) 心肌AngⅡ(ng/L)Sham组 8 41.93±8.26 14.31±2.91 Model组 7 85.16±8.86a 30.85±7.12a FH组 8 43.71±7.70c 13.82±1.53c FL组 8 57.23±8.53c 19.93±2.03b F值 42.09 30.30 P值 0.000 0.000
2.4 法舒地尔对大鼠心肌组织p-MYTP1、α-SMA、TGF-β1和OPN表达的影响
免疫组化染色结果如表3、图3~图6所示,与Sham组比较,Model组大鼠心肌 p-MYPT1、α-SMA、TGF-β1和OPN棕黄色区域明显增多,MOD值显著升高(均为P<0.01)。与 Model组比较,FH组和FL 组大鼠心肌 p-MYPT1、α-SMA、OPN 和TGF-β1棕黄色区域明显减少,MOD值均显著下降(均为P<0.05或P<0.01)。
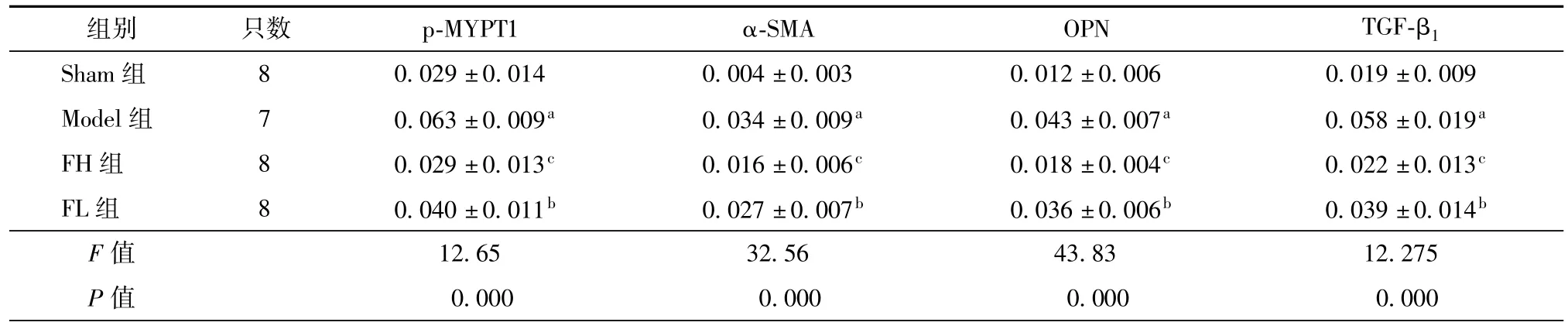
表3 各组大鼠心肌p-MYTP1、α-SMA、OPN和TGF-β1免疫染色MOD值的比较(x¯±s)
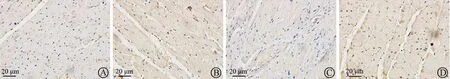
图3 各组大鼠心肌p-MYTP1免疫组化染色(×400)

图4 各组大鼠心肌α-SMA免疫组化染色(×400)
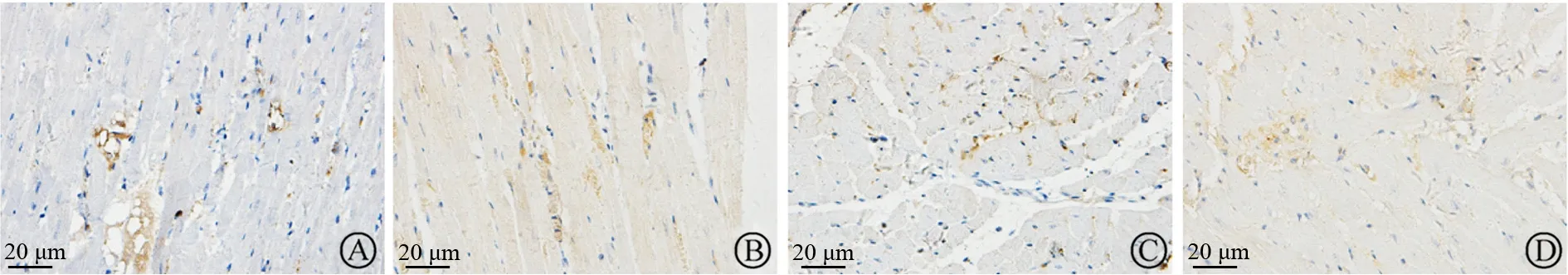
图5 各组大鼠心肌TGF-β1免疫组化染色(×400)

图6 各组大鼠心肌OPN免疫组化染色(×400)
3 讨论
Rho激酶是最早发现的Rho蛋白效应分子,通过磷酸化一系列蛋白,如MYPT1(故p-MYPT1水平可以反映Rho激酶活性)、肌球蛋白轻链磷酸酶、LIM激酶、丝切蛋白、内收蛋白、埃兹蛋白-根蛋白-膜突蛋白(ERM家族)及蛋白激酶A、蛋白激酶C、蛋白激酶G等其他丝氨酸-苏氨酸激酶,调节肌动蛋白骨架,参与细胞形状改变、迁移、增殖和凋亡等行为[7]。Rho激酶信号途径的异常激活与各种心血管疾病密切相关,如高血压、冠状动脉痉挛、动脉粥样硬化和心力衰竭等。抑制Rho激酶是许多传统心血管药物共同的目标之一[8]。近年来研究较多的他汀类药物除具有调脂作用外,对心肌纤维化亦有很好的抑制作用,其机制主要与阻断Rho/Rho激酶信号通路有关[9]。
MFB表型分化是组织损伤修复和纤维化的标志性环节,MFB是最主要的胶原合成细胞,其兼有成纤维细胞和平滑肌细胞的特征,特征性地表达α-SMA。正常心脏中,MFB仅存在于瓣叶,故α-SMA表达阳性的间质细胞一般见于疾病状态下[10]。MFB内包含α-SMA的肌动蛋白应力纤维(微丝束)既是重要的细胞骨架成分,也是MFB强大收缩性能的结构基础。应力纤维成分纤维状肌动蛋白(F-肌动蛋白)是由单体肌动蛋白(G-肌动蛋白)聚合形成的。Rho激酶为肌动蛋白聚合和重组提供动力[11],因此是CFB向MFB转化过程必不可少的物质。本实验采用腹主动脉缩窄法建立压力超负荷模型,8周后,Model组大鼠血浆和心肌AngⅡ浓度明显升高,HYP含量、CⅤF和PCⅤF也显著升高,表明成功复制心肌纤维化模型。同时,心肌间质α-SMA和p-MYPT1的表达水平显著升高,提示大鼠心肌发生了MFB表型分化和Rho激酶信号途径的异常激活。用法舒地尔抑制Rho激酶活性后 (p-MYPT1表达降低),大鼠心肌纤维化程度改善,间质α-SMA的表达下降,表明Rho激酶与MFB表型分化密切相关,与文献报道一致。
虽然目前对MFB的来源还存在很大争议(循环中的细胞、动脉外膜成纤维细胞、间质成纤维细胞及循环中的骨髓干细胞都可能是MFB的前体细胞),但普遍认为,MFB分化主要受局部炎症反应、机械应力及各种体液因子的诱导。其中,TGF-β1是公认的促分化因子,常作为MFB相关研究的工具[12]。活化的 TGF-β1可通过 Smads、Ras/ERK/MAPK 相关激酶或者与其他转录因子的交联促进MFB表型分化。OPN是细胞外基质非结构蛋白——基质细胞蛋白的一员,能通过多种途径发挥促心肌纤维化作用。Lenga等[13]研究发现,OPN在MFB主要结构黏着斑复合体形成过程中是必需的。Chen等[14]研究发现,分泌OPN片段(SⅤⅤYGLR序列)的成肌细胞移植可通过激活 TGF-β/Smads信号通路,诱导MFB分化,明显减轻大鼠心肌梗死后纤维化程度。本实验发现,法舒地尔在抑制心肌α-SMA表达的同时,TGF-β1和OPN的表达亦显著降低,故推测TGF-β1和OPN对Rho激酶介导的MFB分化可能有促进作用。
综上,Rho激酶抑制剂法舒地尔改善压力超负荷大鼠心肌纤维化的作用,可能与抑制心肌MFB表型分化有关。