苦参碱对H9c2细胞缺氧复氧损伤的保护作用及机制
王瑞霞
缺血性心脏病是当今世界尤其是发展中国家致死率最高的人类疾病[1],缺血心肌经血运重建后引起心肌细胞凋亡从而引发缺血再灌注损伤,目前尚无可靠的药物进行防治[2]。因此,开发保护心肌缺血再灌注损伤的药物已成为近年来研究的热点。苦参碱类生物碱广泛存在于豆科植物苦参(Sophora flavescens Ait)、苦豆及广豆根中,属喹诺里西丁类(quinolizidines)。苦参碱在心血管领域有着广泛的生物活性,大量研究表明苦参碱通过抑制心肌细胞凋亡可以减少缺血再灌注后的心肌细胞损伤,本研究将利用细胞急性缺氧复氧模型,模拟心肌缺血再灌注损伤,观察苦参碱对急性缺氧复氧的保护作用及可能机制。
1 材料与方法
1.1 主要材料和试剂
H9c2细胞株购自中国医学科学院基础医学院细胞中心。试剂:高糖DMEM培养基(Gibco),胎牛血清(杭州四季青生物工程材料有限公司),丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(南京建成生物工程研究所),BCA蛋白定量试剂盒和活性氧(reactive oxygen species,ROS)检测试剂盒(碧云天生物技术有限公司),c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、凋亡信号调节激酶 1(apoptosis signal-regulating kinase 1,ASK1)和 B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)一抗(英国ABCOM公司)。
1.2 实验分组
H9c2细胞株在含10%胎牛血清高糖DMEM完全培养基中培养(条件为37℃,5%CO2),2~3 d传代1次。实验时取对数生长期细胞,采用随机数字表法分成4组:(1)对照组:不作任何处理;(2)缺氧复氧组(模型组):将细胞放入缺氧箱中缺氧12 h,再复氧 6 h;(3)和(4)苦参碱处理组:用含10 μmol/L和30 μmol/L 苦参碱的 DMEM 完全培养基预处理细胞12 h,然后进行缺氧复氧处理。
1.3 MTT法检测细胞增殖
培养于96孔培养板的H9c2细胞,接种密度为105/孔,每孔液体200 μL。实验处理后各组每孔加入 MTT 溶液(5 mg/ml)20 μL,孵育 4 h;去培养液,然后各组每孔加入150 μL DMSO振荡10 min,选择490 nm波长,在酶联免疫检测仪上测定各孔光吸收值。设不加细胞只加孵育液的空白对照,记录结果。细胞存活率=(试验组光吸收值/对照组光吸收值)×100%。
1.4 AnnexinⅤ-FITC/PI双标法流式细胞术检测细胞凋亡
取处理过的各组6孔培养板,先将可能含有漂浮凋亡细胞的各组培养液分别收集于流式管中,用0.25%的胰酶消化贴壁细胞,并收集于对应的流式管中,4℃、1 000 r/min离心5 min,用冰预冷的PBS洗涤2次,然后用200 μL结合缓冲液重悬细胞。加入5 μL Annexin Ⅴ-FITC,避光室温反应15 min,再加入10 μL PI避光室温反应 5 min或者 4℃反应30 min,加入 250 μL PBS,立即上机检测。
1.5 Tunnel法检测细胞凋亡
取对数期生长的H9c2细胞以5×105个/ml接种于6孔培养板中,孔中置圆形盖玻片,细胞贴壁后,常规培养4 d后将细胞按1.2方式进行分组处理,处理后将盖玻片取出,以PBS液洗涤,晾干,用多聚赖氨酸细胞面朝上粘于载玻片。PBS冲洗载玻片两次,干燥样品载玻片四周区域,每个样品加入50 μL TUNEL混合液,注意加盖封口膜或盖玻片,37℃暗室孵育60 min,PBS冲洗载玻片3次,滴加1滴PBS,激发光 450~500 nm,检测波长 515~565 nm,荧光显微镜下分析样品,计数凋亡细胞。
1.6 SOD和MDA测定
上述处理过的细胞,收集细胞上清液,按试剂盒说明书进行检测。
1.7 细胞中ROS检测
生长状态良好的H9c2细胞,调整细胞密度为1×105个/ml,按1.2方式进行分组处理。消化收集细胞。按照1:1 000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L。细胞收集后悬浮于稀释好的DCFH-DA中,细胞浓度为100~2 000×104/ml,37℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀一下,使探针和细胞充分接触。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。上机测试。
1.8 Western Blot检测 ASK1、JNK和 Bcl-2蛋白表达
按1.2方式处理过的各组细胞,用预冷的PBS洗涤3次,收集细胞加入裂解缓冲液 4℃裂解20 min,收集细胞裂解液,离心,收集上清液。用Bradford法测定裂解液中总蛋白含量。取细胞裂解液上样于SDS-PAGE聚丙烯酰胺凝胶,每孔40 μg蛋白电泳。电转移将蛋白转至硝酸纤维素膜上。加入封闭液过夜,抗靶蛋白抗体溶液4℃孵育过夜,洗膜,加入二抗工作液室温孵育1 h,洗膜,用化学发光试剂盒检测靶蛋白的表达。
1.9 统计学方法
应用SPSS 19.0统计学软件进行分析。计量资料为正态分布,用表示,两组间比较用独立样本t检验,多组间比较采用单因素方差分析,两两比较方差具有齐性时用SNK检验,方差不具有齐性时用Dunnett检验。P<0.05为差异有统计学意义。
2 结果
2.1 苦参碱对缺氧复氧后H9c2细胞增殖的作用
与缺氧复氧组(47.7% ±3.4%)比较,苦参碱低剂量和高剂量处理组的细胞生存率显著提高(59.3% ±3.1%和70.6% ±2.7%),差异有统计学意义(均为P<0.05)。
2.2 AnnexinⅤ-FITC/PI双标法及流式细胞仪检测细胞凋亡
流式结果如图1所示,与缺氧复氧组(67.4% ±6.8%)比较,苦参碱低剂量和高剂量处理组的细胞凋亡率明显下降(34.6% ±4.2%和18.5% ±1.9%),差异有统计学意义(均为P<0.05)。表明苦参碱具有抑制缺氧复氧的H9c2细胞凋亡的作用。
2.3 Tunnel法检测细胞凋亡
Tunnel法检测结果与流式结果吻合,模型组凋亡细胞明显增多,苦参碱处理组细胞凋亡较模型组显著减少(图2)。
2.4 SOD活性、MDA含量以及ROS检测
氧化应激系统的检测结果如表1所示,与对照组比较,模型组的SOD活性和ROS含量显著降低,而与模型组比较,苦参碱低、高剂量组能显著提高二者含量,并呈剂量依赖;与对照组比较,模型组的MDA含量显著增多,而与模型组比较,苦参碱处理组能显著减少MDA含量。
2.5 Western Blot检测 ASK1、JNK和 Bcl-2蛋白表达
Western Blot结果如图3、4所示,与对照组比较,模型组中ASK1和JNK蛋白表达显著降低,Bcl-2蛋白表达却显著升高,而苦参碱低、高剂量处理组均能提高ASK1、JNK的表达同时降低Bcl-2的表达。
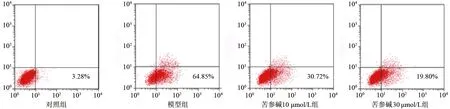
图1 AnnexinⅤ-FITC/PI双标法流式检测细胞凋亡
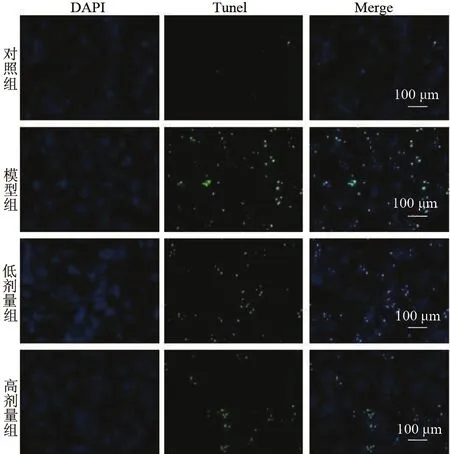
图2 镜下观察细胞凋亡(×200) 与对照组比较,模型组细胞凋亡明显增加,而苦参碱有效抑制了细胞凋亡,并随剂量的升高这种作用越强
表1 不同组别细胞中SOD、MDA及ROS检测()
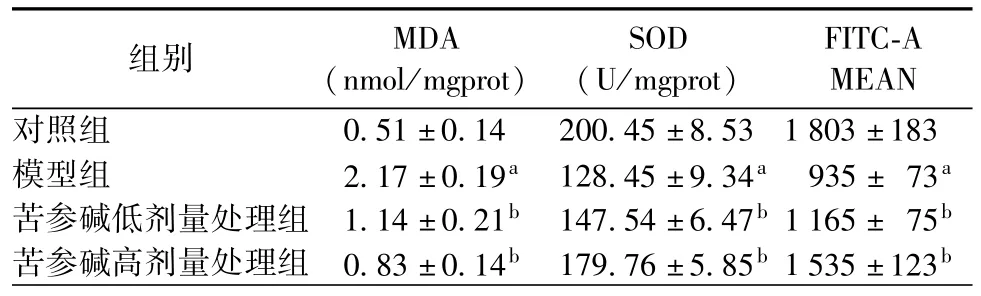
表1 不同组别细胞中SOD、MDA及ROS检测()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05
组别 MDA(nmol/mgprot)SOD(U/mgprot)FITC-A MEAN对照组 0.51±0.14 200.45±8.53 1 803±183模型组 2.17±0.19a 128.45±9.34a 935± 73a苦参碱低剂量处理组 1.14±0.21b 147.54±6.47b1 165±75b苦参碱高剂量处理组 0.83±0.14b 179.76±5.85b1 535±123b
图3 Western Blot检测ASK1、JNK和Bcl-2表达
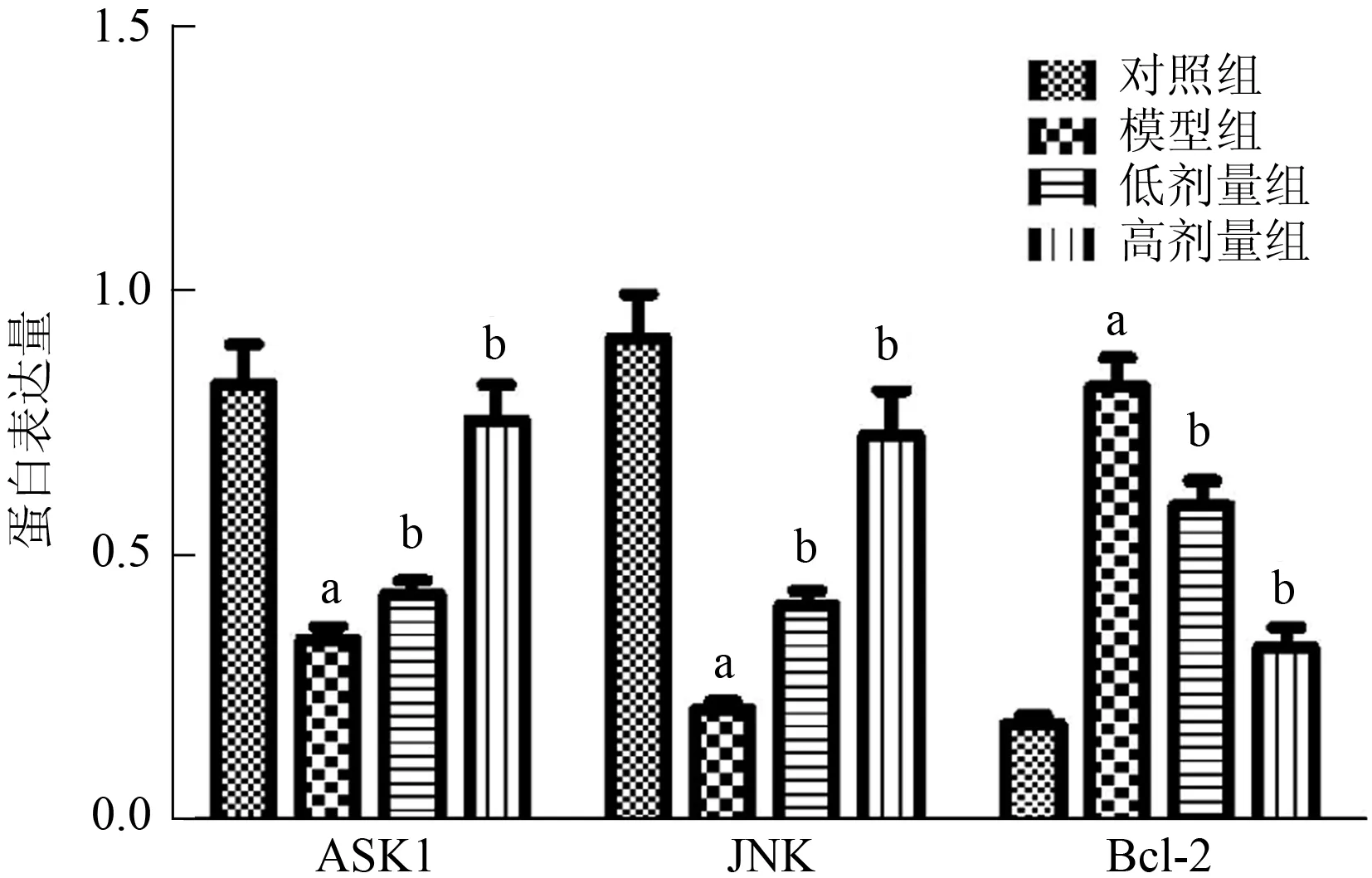
图4 ASK1、JNK和Bcl-2的蛋白表达量
3 讨论
近年来,心血管疾病已成为危害人类健康的重要疾病,造成心肌和血管损伤的因素众多[3]。缺血再灌注可诱发细胞凋亡[4],心肌细胞凋亡与冠状动脉粥样硬化性心脏病、心肌梗死、心肌缺血再灌注损伤等心血管疾病的发生发展关系密切。心肌再灌注损伤主要是氧供应的恢复和大量ROS的爆发性增多造成的细胞结构损伤和功能代谢障碍,因此可以主要归结为心肌细胞缺氧/复氧损伤的问题[5]。ROS是外源性氧化剂活细胞内氧代谢产生的高生物活性的氧分子,生理状态下,机体可以产生少量ROS,而机体内具有SOD,可以分解ROS成分,以维持机体ROS的平衡[6]。在缺血再灌注时机体处于氧化应激状态,ROS大量产生,ROS堆积能激活线粒体上非特异MPTP开放,导致细胞凋亡[7],对机体产生损伤。
大量文献表明,苦参碱在心血管系统具有广泛的药理活性,例如抗心律失常[8]。苦参碱可以抑制心肌细胞钙内流,对大鼠急性心肌缺血具有保护作用[9],可以减少自由基生成,减轻脂质过氧化[10]。还可以通过抑制NO的过量生成,缓解炎症反应[11]。本实验建立了H9c2细胞缺氧复氧模型模拟缺血再灌注损伤,结果显示苦参碱对于缺氧复氧造成的损伤具有显著的抑制作用,提高了H9c2细胞的存活率。在模型组中,ROS和MDA的含量比苦参碱处理组和对照组显著提高,差异有统计学意义,SOD的活性却显著降低。流式结果证实,苦参碱对于缺氧复氧引发的细胞凋亡同样具有抑制作用,我们推测苦参碱主要是通过抑制凋亡来起到提高存活率的作用,而苦参碱可以降低细胞内ROS含量,从而导致MDA含量也降低,同时提高SOD的活性,进一步清除细胞内的ROS。通过减少ROS产生消除堆积,抑制MPTP的开放,最终达到抑制细胞凋亡的目的。
ROS与心血管疾病的发生、发展有密切关系[12],其介导的JNK信号通路是JNK信号通路的重要成员之一,在炎症与细胞凋亡等应激反应中发挥重要作用。ASK1是MAPKKK家族的成员之一,可以激活SEK1(MKK4)/MKK7-JNK 和MKK3/MKK6-p38MAPK信号级联,而其本身又可被氧化应激在内的多种应激而激活,有证据显示,ROS可以通过去磷酸化激活[13],也可以使PP5与ASK1结合而抑制ASK1活性,提示存在一种负向调控机制。我们通过Western Blot检测发现模型组中ASK1和JNK蛋白都较苦参碱处理组高,而bcl-2蛋白表达降低,于是我们推测,苦参碱可能通过激活ASK1的表达,使JNK表达升高,抑制了Bcl-2蛋白表达,从而降低线粒体膜通透性和细胞色素C的释放,抑制凋亡。
关于苦参碱作用的机制,我们仅仅是研究了其对于ASK1和JNK蛋白的影响,具体在JNK信号通路里是通过哪些蛋白逐步发挥抗凋亡作用还有待研究。我们希望苦参碱在将来能够应用于临床,真正为患者提供帮助。