抑菌剂在异养小球藻发酵过程中的应用*
毕生雷,张成明,金洪波,郑世文,刘钺,杜风光
1(河南天冠企业集团有限公司车用生物燃料技术国家重点实验室,河南南阳,473000)
2(清华大学 核能与新能源技术研究院,北京,100084)
3(北京市生物燃料工程技术研究中心,北京,100084)
小球藻(Chlorella)异养培养具有生长速度快,发酵设备通用性好,占地面积少,培养过程和藻细胞采收成本低,劳动强度低等特点,近年来受到广泛关注。通过对高细胞浓度异养培养技术的研究与探索,大幅度提高了小球藻发酵效率,使小球藻异养培养的工业化生产成为可能[1-3]。ZHENG 等发现,小球藻在两级异养培养条件下的生长速度、细胞密度分别为光自养条件下的3.0和3.3倍[4]。Ceron-Garcia等人在2 L发酵罐中进行小球藻的异养培养,最终得到的细胞干重达64 g/L,日干重增加量达到8.7 g/(L·d),且藻细胞中油脂含量达到50%[5]。CHEN等使用葡萄糖作为碳源进行小球藻异养培养,生物质和脂质的葡萄糖转换率分别为 43.3%和 14.2%[6]。Isleten-Hosoglu等人报道,异养小球藻脂肪酸的主要成分为油酸(C18∶1)和亚油酸(C18∶2),它们分别占总脂肪酸含量的34.4%和30.1%[7]。在高密度培养方面,华东理工大学李元广教授报道异养小球藻的培养密度高可达140 g/L、日产率可达9.08 g/(L·d),是目前的最高水平[8]。而且,异养与光自养串联培养后异养小球藻日产率可达15 g/(L·d),折合后单位面积日产率是自养培养的101~140倍[8]。
小球藻异养培养的发酵周期通常长达7~15 d,生长速度较慢,如果培养措施不当,则很容易被细菌、霉菌等环境中存在的微生物污染[9]。环境中霉菌的存在是由于空气、设备、墙壁等存在潮湿的状况,而小球藻在培养过程中一般不会受到霉菌污染。钱文倩等认为,小球藻培养过程中污染菌主要是芽孢属杆菌[10]。在受到外来菌污染后,小球藻生长受到抑制,藻细胞内脂类含量下降,为无菌条件下的86%[10]。目前小球藻异养培养染菌后通常的做法是停止发酵、彻底杀菌,这样会造成培养基、补料和能源的巨大浪费。克菌灵和安菌素作为新型抑菌剂能使一般杂菌的羧肽酶、转化酶失活,抑制杂菌细胞壁的扩增,能同时抑制革兰氏阳性菌和革兰氏阴性菌的生长分裂,以此来达到杀菌的目的,已经在酒精发酵和食品工业中得到广泛的应用,效果比较理想[11]。青霉素中的β-内酰胺可以作用于细菌的细胞壁,直接阻碍细菌细胞壁的合成,从而达到抑制细菌的目的。在酒精发酵和藻类自养培养过程中也有较多的应用[12-13]。
克菌灵、安菌素、青霉素的毒性都比较小,同属于干扰细胞细胞壁从而达到抑菌、杀菌目的的抗生素,目前尚未见这3种抑菌剂在藻类发酵中获得应用的报道。本研究希望通过考察不同浓度抑菌剂对小球藻发酵的影响,以及在染菌条件下对杂菌的抑制情况,获得抑菌剂的最佳使用量,以达到通过使用抑菌剂来减少由于倒料造成经济损失的目的。
1 实验材料与方法
1.1 试剂
酵母粉,安琪酵母有限公司;葡萄糖,国药集团有限公司;青霉素,石家庄制药集团有限公司;克菌灵,广西万佳食品发展公司;安菌素,柳州龙泰科技有限公司;其他试剂均为国产分析纯或生化试剂。
1.2 实验菌株和培养条件
1.2.1 实验菌株
异养小球藻(Heterotrophic Chlorella),由清华大学生命科学院提供。细菌,由50 L发酵罐中染杆菌的发酵液经稀释涂布、挑选单菌落培养而成。
1.2.2 抑菌剂处理方法
在无菌室中,将抑菌剂加入一定体积的无菌水中,分别配成质量浓度为5、50、500 mg/mL的溶液备用。
1.2.3 抑菌试验
抑菌试验所采用的受试菌为50 L发酵罐中染杆菌的发酵液经稀释涂布、挑选单菌落培养而成。
抑菌圈试验采用纸片法:制备浓度约为105CFU/mL的杆菌悬液,取20 mL杆菌悬液倒入300 mL溶化并已冷却至40~45℃的牛肉膏蛋白胨培养基中,摇匀后迅速分装于培养皿中,每个培养皿15 mL,待凝固后,将20 μL各抑菌剂溶液加入到已消过毒的圆形纸片(Φ 6 mm)上,略干后贴于培养基平板上,同时作各溶剂的空白对照,置于恒温培养箱中培养(37℃,24 h),培养完成后观察结果,测量抑菌圈直径[14]。
小球藻接种量10%。培养条件:发酵温度28℃,pH 6.5,转速为间歇调节(干重<20 g/L,转速为200 r/min;20 g/L<干重<50 g/L,转速为300 r/min;50 g/L<干重<70 g/L,转速为400 r/min;干重 >70 g/L,转速为450 r/min)采用间歇补料,葡萄糖含量低于10 g/L时补料。发酵培养基配方为(g/L):葡萄糖30、酵母粉 3,KH2PO40.075,MgSO40.075、CaCl20.025、K2HPO40.175,蛋白胨 3,(NH4)2SO41,Fe2(SO4)33,ZnSO40.072,MnCl20.581,钼 酸 钠0.044。
1.2.4 摇瓶试验
平板上的藻细胞单菌落接入摇瓶,200 r/min,28℃下培养7 d,种子培养合格时种子液中应无菌、干重达到10 g/L以上。摇瓶试验采用2 L摇瓶发酵,装液量50%。培养条件:温度28℃,转速200 r/min。摇瓶培养基配方为(g/L):葡萄糖30、酵母粉 3,KH2PO40.075,MgSO40.075、CaCl20.025、K2HPO40.175,蛋白胨 3,(NH4)2SO41,Fe2(SO4)33,ZnSO40.072,MnCl20.581,钼酸钠0.044。
1.2.5 发酵试验
发酵试验所采用的受试菌为异养小球藻以及50 L发酵罐中染杆菌的发酵液经稀释涂布、挑选单菌落培养而成的液体杂菌。发酵试验采用50 L正常发酵的空白试验和50 L接入液体杂菌、添加抑菌剂试验进行对比。其中添加抑菌剂的试验罐在接种时同时接入1 mL液体杂菌。
发酵试验采用50 L发酵,接种量10%,发酵温度28 ℃,pH 6.5,通风量 2 m3/(L·h)[1],转速为间歇调节(干重<20 g/L,转速为200 r/min;20 g/L<干重<50 g/L,转速为300 r/min;50 g/L<干重<70 g/L,转速为400 r/min;干重 >70 g/L,转速为450 r/min)采用间歇补料,葡萄糖含量低于10 g/L时补料。
发酵培养基配方为(g/L):葡萄糖30、酵母粉3,KH2PO40.075,MgSO40.075、CaCl20.025、K2HPO40.175,蛋白胨 3,(NH4)2SO41,Fe2(SO4)33,ZnSO40.072,MnCl20.581,钼酸钠0.044。
1.3 分析方法
葡萄糖含量采用HPLC法测定,细胞数采用血球板计数。干重测定方法:取10 mL发酵液,离心后弃上清液,加蒸馏水至10 mL,再次离心,100℃下烘干藻泥,然后计算干重。

2 结果与讨论
2.1 抑菌圈试验结果
抑菌圈试验过程比较简单、快捷,可以有效地反映出菌体对药物试剂的敏感程度,畜牧业已经广泛的使用抑菌圈来判定抑菌效果。根据常用药敏试验敏感度判定标准[15],一般抑菌圈直径在15 mm以上为高敏,10~14 mm为中敏,10 mm以下为低敏,0 mm为不敏感。为了克服小球藻染菌问题,研究人员需要不断的开展试验以筛选菌体相对比较敏感的药物试剂。染菌小球藻发酵液中分离出的杆菌对安菌素、克菌灵等抑菌剂敏感性结果见表1。
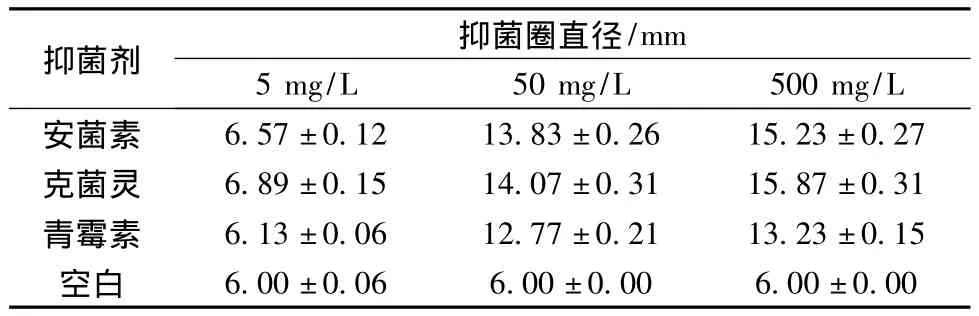
表1 抑菌试验结果Table 1 Result of antibacterial experiment
如表1所示,一定质量浓度的抑菌剂均对该杆菌有抑制作用,并且随着抑菌剂浓度升高,抑制作用增强。当抑菌剂浓度低于50 mg/mL时均表现为中、低敏,当抑菌剂浓度达到500 mg/mL时,安菌素和克菌灵表现为高敏,而青霉素则表现为中敏。安菌素和克菌灵的抑菌圈直径进行单因素方差分析P=0.000 182差异不是太大。而克菌灵和青霉素P=0.013 769,安菌素和青霉素P=0.006 437,之间差异明显较大。安菌素和克菌灵在添加500 mg/L时抑菌圈>15 mm处于在高敏区,而青霉素在添加500 mg/L时抑菌圈介于10 mm与10 mm处于在中敏区但接近高敏的标准,从抑菌圈所表现出来的抑菌效果,依次是克菌灵、安菌素、青霉素为了更好的区分。微生物发酵试验中添加任何试剂都需要考虑其对发酵过程的影响,为了考察抑菌剂对小球藻发酵过程的影响、找到更合适的抑菌剂用量,需进一步开展摇瓶试验。
2.2 摇瓶试验结果
摇瓶试验可以直观地反映微生物发酵过程中微生物生长状况,在进行配方等试验时,使用摇瓶开展试验,可以快速、低成本地获取相关试验结果。微生物在摇瓶中对营养物质的消耗速度、在摇瓶中的生长速度,能够直接说明了微生物对该配方的适应性。而抑菌剂小球藻在发酵过程中的影响也会在摇瓶试验中直观的观察出来。
2.2.1 添加安菌素的摇瓶试验结果
安菌素是近两年开发出来的新型抑菌剂,在酒精发酵行业获得了一定的应用,能够起到良好的抑菌效果,目前尚未应用到藻类培养领域。
如图1所示,添加100 mg/L的安菌素,发酵过程干重质量浓度、葡萄糖含量变化趋势和终了干重与空白样基本吻合,说明添加100 mg/L的安菌素不会对整个发酵过程产生明显的影响。而增大添加量以后,小球藻的发酵过程出现较为明显的波动,且随着安菌素添加量的增加,小球藻终了干重呈现降低的趋势、葡萄糖消耗减慢。说明增大添加量以后安菌素对小球藻的发酵过程产生了负面的影响,藻细胞增殖速度减慢。在发酵第5 d,添加500 mg/L的安菌素的小球藻发酵液中出现了絮状物,经镜检发现未染杂菌,可能是添加较多量的安菌素后小球藻发生了絮凝。

图1 添加安菌素对发酵过程影响Fig.1 Effect of Anjunsu on Chlorella fermentation
2.2.2 添加青霉素的摇瓶试验结果
青霉素是目前藻类培养过程中使用较多的抑菌剂,王江涛、周文礼等人的研究表明,低于100 mg/L的青霉素在自养小球藻培养过程中可以明显起到抑菌的作用且不会对小球藻、金藻等藻类产生叶绿素a产生抑制。而王卫东等人的研究则表明,添加300 IU/mL的青霉素不仅会抑制杂菌而且还会对球等鞭金藻的生长起到促进作用[12-14]。
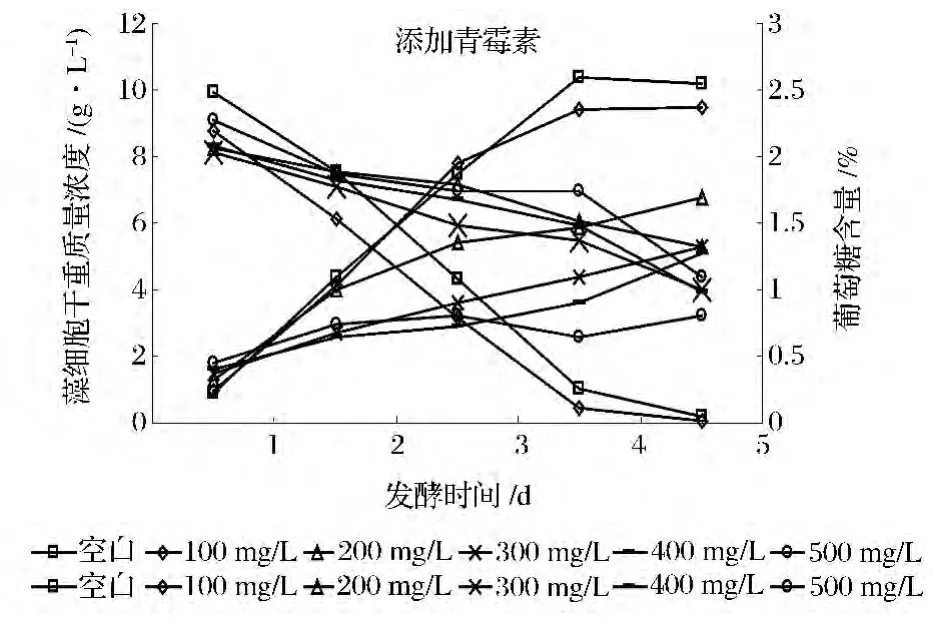
图2 添加青霉素对发酵过程影响Fig.2 Effect of penicillin on Chlorella fermentation
如图2所示,添加100 mg/L的青霉素,发酵过程干重质量浓度和葡萄糖含量变化趋势在发酵前期与空白样基本吻合,而进入到第4天,添加青霉素的发酵过程干重质量浓度开始落后于空白样,而且终了干重也低于空白样。说明添加100 mg/L的青霉素已经对整个发酵过程产生明显的影响。而随着添加量增大,小球藻在发酵过程中葡萄糖消耗速度减慢,发酵过程干重质量浓度变化越来越低,且小球藻终了干重也呈现越来越低的趋势。说明增大添加量以后青霉素对小球藻的发酵过程产生了较为明显负面的影响,藻细胞增殖速度受到抑制。
2.2.3 添加克菌灵的摇瓶试验结果
克菌灵是近两年开发出来的新型抑菌剂,在酒精发酵行业获得了一定的应用。在发酵初期添加,起到抑制杂菌生长、减少硫酸用量、减弱发酵醪酸度的作用[16]。目前尚未应用在藻类培养领域。
如图3所示,添加各个比例的克菌灵,整个发酵过程干重质量浓度变化趋势均和终了干重与空白样相比均基本吻合,仅终了干重略低,说明安菌素不会对整个发酵过程产生明显的影响。添加100 mg/L的克菌灵整个发酵过程干重质量浓度变化趋势均和终了干重与空白样相比基本相同。
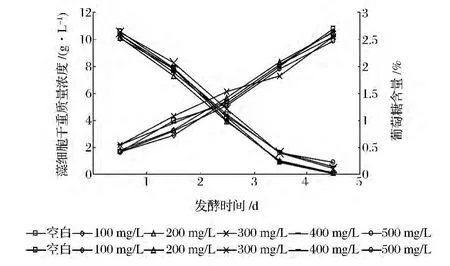
图3 添加克菌灵对发酵过程影响Fig.3 Effect of Kejunling on Chlorella fermentation
对比安菌素、青霉素、克菌灵摇瓶发酵试验结果,安菌素的添加会引起小球藻在发酵过程中葡萄糖消耗和细胞增殖有所减慢,而青霉素的添加则会引起小球藻发酵过程剧烈变化,葡萄糖消耗和藻细胞干重质量浓度均为空白样的一半。而克菌灵添加则没有对小球藻发酵过程造成明显影响。结合平板抑菌圈试验结果,添加100 mg/L的克菌灵抑菌效果良好,且添加量较小在发酵过程中不会对小球藻的正常发酵过程造成明显的影响,比较适合在小球藻发酵过程中使用。
2.3 50 L发酵试验结果
摇瓶试验结果可以直观的反映发酵过程,由于转速、通风、温度、pH等因素影响,摇瓶试验结果又不能完全反映发酵过程。摇瓶试验结果必须在发酵罐中进行进一步试验。
如图4所示,正常发酵试验(空白)发酵过程中干重增加较为平稳,而接种时同时接入杂菌的对照组(100 mg/L)在发酵处于延滞期的前2天,生长与空白组没有太大差别,而在发酵进入第3、4天两者之间干重质量浓度、每天干重增加量差距比较明显,发酵处于停滞状态,如果不采取挽救措施,整个发酵会以失败而告终。而加入100 mg/L克菌灵后,小球藻的生长逐步恢复正常。在加入克菌灵24 h后,镜检已经发现不了杂菌。在第5天以后发酵过程中干重增长趋势与对照基本一致,而发酵终了干重的质量浓度也仅比空白组低10 g/L。结果表明在染菌以后添加克菌灵可以有效地抑制杂菌,并成功挽救发酵。
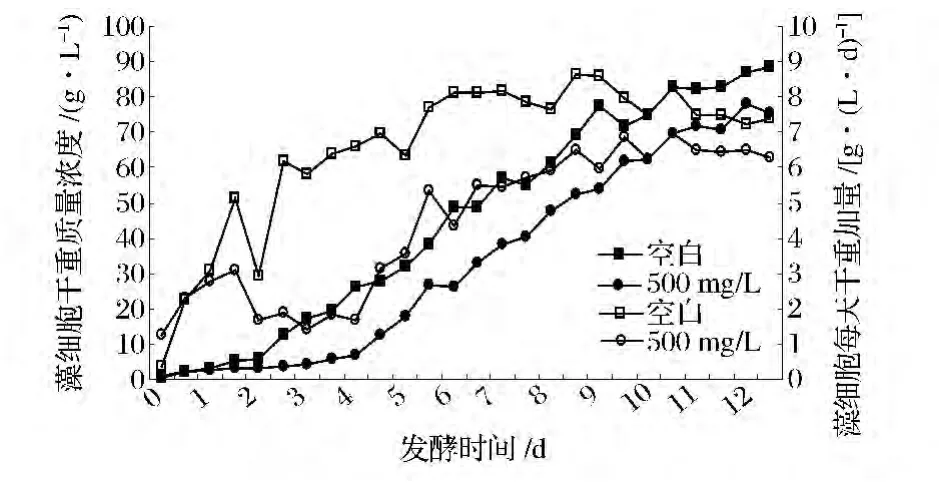
图4 50 L发酵罐中克菌灵对小球藻发酵的影响Fig.4 Effect of Kejunling on Chlorella fermentation in a 50 L fermenter
2.4 添加抑菌剂对发酵结果的影响
从表1中可以看出,在相同的发酵时间内,由于染菌的影响,小球藻终了干重、藻油含量、平均每天干重增加量均比正常发酵过程偏低,但是由于添加了抑菌剂及时抑制了细菌对小球藻正常生长的影响,所以发酵没有因染菌而失败,而是在停滞一段时间后恢复了正常生长,因此使用抑菌剂挽救了染菌的发酵过程。
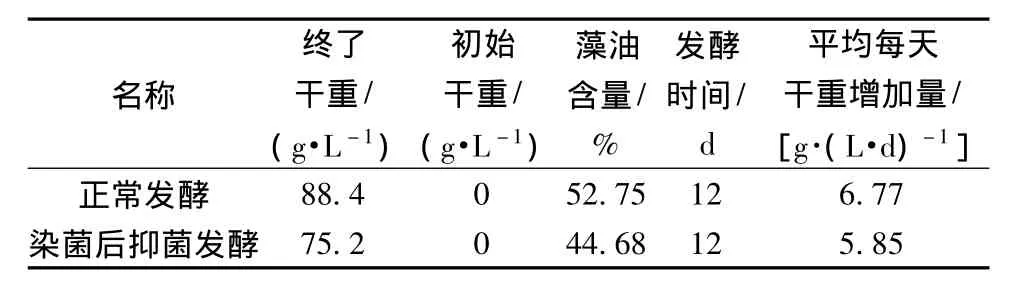
表1 添加抑菌剂对发酵结果的影响Table 1 The effect of fermentation results by adding bacteriostatic agent
3 结论
(1)杂菌(杆菌)生长较快,能够在发酵过程中迅速占据种群优势,消耗大量营养物质,导致小球藻不能够正常生长,每天干重增加量迅速下降,如果不采取挽救措施,会直接导致发酵失败。
(2)在加入克菌灵后,在24 h后镜检已经不能发现杂菌(杆菌),克菌灵能够有效的抑制杂菌(杆菌)。
(3)空白组的终了干重为88.4 g/L,日干重增加量为7.36 g/(L·d),对照组终了干重为75.2 g/L,每天干重增加量为6.27 g/(L·d),相比仅降低14.9%。而在没有添加克菌灵前小球藻的干重一直低于5 g/L,添加克菌灵在抑制了杂菌(杆菌)且成功的挽救了发酵过程。
[1]景建克,许倩倩,刘硕,等.大规模异养发酵培养小球藻USTB -01研究[J].现代化工,2008,28(12):67-70.
[2]陈俊辉,魏东.异养小球藻对铁、锌和钙的生物富集作用研究[J].现代食品科技,2010,26(11):1 192-1 196.
[3]潘欣,李建宏,戴传超,等.小球藻异养培养的研究[J].食品科学,2002,23(4):28 -33.
[4]ZHENG Y,CHI Z,Lucker B,et al.Two-stage heterotrophic and phototrophic culture strategy for algal biomass and lipid production[J].Bioresource Technology,2012,103(1):484-488.
[5]Ceron-Garcia M C,Macias-Sanchez M D,Sanchez-Miron A.A process for biodiesel production involving the heterotrophic fermentation of Chlorella protothecoides with glycerol as the carbon source[J].Applied Energy,2013,103(Mar.):341-349.
[6]Chen Y H,Walker T H.Fed-batch fermentation and supercritical fluid extraction of heterotrophic microalgal Chlorella protothecoides lipids[J].Bioresource Technology,2012,114(1):512 -517.
[7]Muge Isleten-Hosoglu,Idil Gultepe,Murat Elibol.Optimization of carbon and nitrogen sources for biomass and lipid production by Chlorella saccharophila under heterotrophic conditions and development of Nile red fluorescence based method for quantification of its neutral lipid content[J].Biochemical Engineering Journal,2012,61:11 -19.
[8]李兴武,李元广,钱峰慧,等.小球藻异养-光自养串联培养技术及其放大研究[C].大连:全国海洋生物技术与海洋药物学术会议集,2006:2-6.
[9]毕生雷,杜风光,孙沛勇,等.异养小球藻的半连续发酵方法[P].中国专利:CN201310031846.7,2013-04-24.
[10]钱文倩.微生物对异养小球藻生长及代谢产物影响的研究[D].上海:上海交通大学,2008:2-10.
[11]刘晓峰,李莉.克菌灵在酒精生产中的应用[J].广西轻工业,2003(2):19-20;22.
[12]刘卫东,苏浩,虞星炬.培养基琼脂浓度及抗生素对3种海洋微藻生长的影响[J].生物技术,2006,16(6):75-77.
[13]周文礼,乔秀亭,肖慧,等.三种抗生素对几种海洋微藻叶绿素a含量影响的初步研究[J].海洋环境科学,2009,28(3):268 -271.
[14]付秀娟,宋文军,王雪青.固定化培养对球等鞭金藻生长及其提取物的抑菌效果影响研究[J].天津师范大学学报:自然科学版,2012,32(1):70 -73.
[15]孙长贵译.抗菌药物敏感性试验执行标准.第19版信息增刊[J].临床检验杂志,2009(1):69-71.
[16]罗东成.克菌灵在糖蜜酒精微酸发酵生产中的应用研究[J].企业科技与发展,2010(23):32-33.

