串联飞行时间质谱的碎片离子相对强度在区分亮氨酸和异亮氨酸残基中的应用
王 勇,高 升,李水明(.深圳大学生命科学学院,深圳市海洋生物资源与生态环境重点实验室,广东深圳 58060;.深圳大学生命科学学院,深圳市微生物基因工程重点实验室,广东深圳 58060)
串联飞行时间质谱的碎片离子相对强度在区分亮氨酸和异亮氨酸残基中的应用
王 勇1,高 升2,李水明1
(1.深圳大学生命科学学院,深圳市海洋生物资源与生态环境重点实验室,广东深圳 518060;
2.深圳大学生命科学学院,深圳市微生物基因工程重点实验室,广东深圳 518060)
研究肽段从头测序需要解决的问题之一是区分亮氨酸和异亮氨酸残基,利用基质辅助激光解吸电离-串联飞行时间质谱(MALDI-TOF/TOF)所产生的w型离子区分这两种氨基酸残基是目前最常用的方法。本研究以6对合成的同分异构肽段(由7~15个氨基酸构成)为例,来说明w离子信号强度较低且有时不能产生,在区分多肽中的亮氨酸和异亮氨酸时受肽段长度和序列的限制。而亮氨酸与异亮氨酸的变化会导致亚胺相关离子、内部断裂离子、b-型和y-型离子等相对强度的微小变化。通过比较这些骨架断裂变化所产生的微小差异,可为区分肽段中的亮氨酸和异亮氨酸残基提供新的线索和判据。
从头测序;串联飞行时间质谱(MALDI-TOF/TOF);亮氨酸;异亮氨酸
数据库搜索和从头测序是基于串联质谱鉴定肽段的两种基本方法[1-2]。相比于数据库搜索,从头测序的关键是串联质谱数据是否能提供足够的序列信息,其中,亮氨酸和异亮氨酸残基的区分就是亟待解决的问题之一。一般来说,基于氨基酸序列的相似性,局部同源搜索工具(BLAST)可以为从头测序提供区分亮氨酸和异亮氨酸的参考信息[3-5],然而,该方法不适用于亮氨酸和异亮氨酸的基因发生相互突变的情况[6]。此外,在人类转录组中,核糖核酸(RNA)和脱氧核糖核酸(DNA)序列也存在广泛的差异,亮氨酸或异亮氨酸也可能通过其他氨基酸的突变产生[7-8]。因此,对串联质谱数据进行深入地分析非常重要。
在低能碰撞诱导解离模式下,通过分析亮氨酸和异亮氨酸亚铵离子碎片的三级串联质谱可将其有效区分。亮氨酸和异亮氨酸都可以产生m/z30和m/z44离子,然而,亮氨酸由麦氏重排主要断裂成m/z 43和m/z 44离子,异亮氨酸则通过失去氨和乙烯生成m/z69和m/z41离子[9-12]。这些信息可用于区分金属离子复合物中的亮氨酸和异亮氨酸[13]。此外,基质辅助激光解吸电离源内裂解与亚稳态原子活化解析质谱相结合也可区分这两种氨基酸[14-16]。
高能碰撞诱导解离是通过将前体离子加速后与碰撞池中的气体原子或分子进行碰撞而实现离子碎裂。一次碰撞足以引起前体离子电子的激发,随后的碰撞会产生所有可能的断裂,这在增加串联图谱复杂性的同时,也提高了所获得序列信息的确定性[17]。高能碰撞诱导解离产生的w离子碎片可以区分亮氨酸和异亮氨酸[18],但是,由于多肽结构、样品浓度和仪器条件等因素的影响,有时观测不到w离子。本工作通过研究亮氨酸和异亮氨酸残基之间的取代导致的串联质谱中各碎片离子相对强度的变化,寻找有可能区分出亮氨酸和异亮氨酸残基的新线索。
1 实验部分
1.1 主要仪器与试剂
4800MALDI-TOF/TOF Analyzer基质辅助激光解吸电离-串联飞行时间质谱仪:美国AB Sciex公司产品;Milli-Q超纯水处理系统:美国Millipore公司产品。
多肽的合成与制备:所有标准肽由强生生物(上海)科技有限公司合成,合成的多肽通过反相HPLC纯化,冷冻干燥,并用分析型HPLC和质谱确定所有多肽的纯度均在95%以上;α-腈基-4-羟基肉桂酸:美国Sigma公司产品,使用前重结晶,浓度为6g/L。将制备的适量固态多肽溶解在CH3CN(分析纯)与去离子水的溶液(1∶1,V/V)中,最终形成的多肽溶液浓度范围在100~500nmol/L之间。
1.2 质谱条件
所有实验在MALDI-TOF/TOF 4800质谱仪上完成。一级质谱每张谱图累加800次。在串联质谱模式中,碰撞诱导解离条件为1keV碰撞能加空气碰撞,碰撞能为1 000V,二级加速电压为15 000V,最大累积激光发射次数为2 000次。通过MS-Product程序确定子离子质荷比。
2 结果与讨论
2.1 利用w离子区分亮氨酸和异亮氨酸多肽同分异构体的局限性
目前,肽段断裂后所产生离子的命名一般采用2009年美国化学会规定的系统命名法,示于图1。含有亮氨酸和异亮氨酸残基的多肽可由w型离子区分,但也存在一些问题,本研究将通过6组合成的模拟胰蛋白酶水解肽段(以赖氨酸或精氨酸结尾)加以说明。例如,肽段HKDLYGK和HKDIYGK的MALDI-TOF/TOF串联质谱图非常相似,互补的y和b系列离子为优势断裂,组氨酸亚胺离子m/z 110.08为基峰,虽然能够在放大的谱图上观察到可以区分它们的w离子,但是离子强度很低,示于图2。同样地,在肽段EQWTEGTIK放大的串联质谱图上,可以观察到wa2离子,但信号强度很低,示于图3。为了进一步说明该问题,将所有多肽的w离子相对强度和信噪比列于表1。

图1 肽段断裂离子的系统命名法[14]Fig.1 Nomenclature of peptide fragment ions[14]
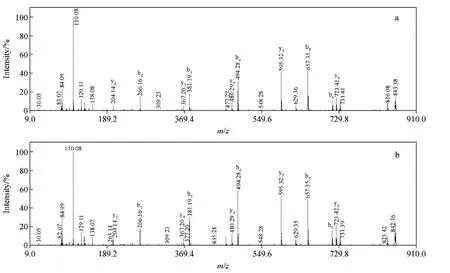
图2 500nmol/L HKDLYGK(a)和500nmol/L HKDIYGK(b)的串联飞行时间质谱图Fig.2 MALDI-TOF/TOF CID spectrumsof 500nmol/L HKDLYGK(a)and 500nmol/L HKDIYGK(b)
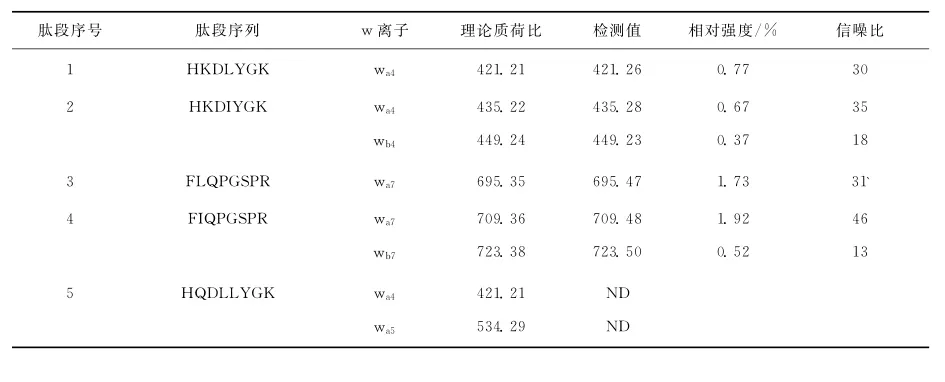
表1 12种多肽对应的w离子和它们的相对强度Table 1 Summary of the observed w ions and their relative intensity for twelve peptides
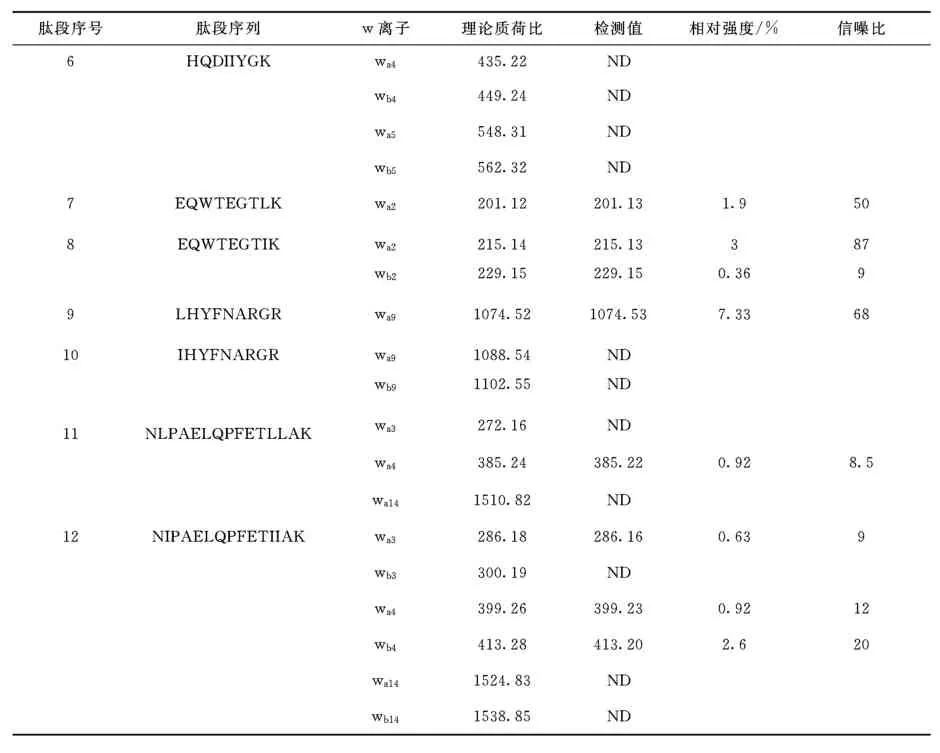
续表1

图3 100nmol/L EQWTEGTIK 的串联飞行时间质谱图(a)和放大图(b)Fig.3 MALDI-TOF/CID sprctrums of 100 nmol/L EQWTEGTIK (a)and expand region(b)
如表1所示,对于编号为5、6、10、11和12的肽段未观察到相应的w离子,在其他肽段的串联质谱中,wa和wb离子的相对强度也很低。氨基酸残基的位置和肽段长度是影响w离子能否被检测到的关键因素。对于多肽NLPAELQPFETLLAK和NIPAELQPFETIIAK,只能检测到wa3、wa4、wb4离子,因为碎片离子在高质量区普遍强度较低,在N端第14的位置亮氨酸和异亮氨酸难以区分。除了相对较低的强度,利用w离子的另一个缺点是在低质量区域的其他碎片离子也可能对w离子的检测造成干扰。例如,理论上肽段EQWTEGTLK和EQWTEGTIK可通过EQWTEGTLK的wa2离子m/z201.12和EQWTEGTIK的wa2离子m/z215.14、wb2离子m/z229.15加以区分,但是,在这2个肽段的串联质谱中均检测到了较高强度的m/z215.14离子,来源于它们的内部断裂离子TI/TL。类似地,并不是所有的亮氨酸和异亮氨酸残基都可以由157nm光解产生的v型和w型离子进行区分[19]。综上,虽然侧链碎片离子可在区分多肽中的亮氨酸或异亮氨酸时发挥重要作用,但其适用性受肽段长度和序列的限制。
2.2 利用亚铵相关离子相对强度区分亮氨酸和异亮氨酸的多肽异构体
相比于亮氨酸,异亮氨酸更易产生亚胺相关离子m/z69和m/z 41[20]。Armirotti等[14]研究表明,由亮氨酸产生m/z69的亚铵离子需要更多的能量,即亮氨酸亚铵离子必须克服+305.4J/mol的能垒完成重排,并克服147.3J/mol失去氨,而异亮氨酸则只需要+219.7J/mol的能垒完成重排,+76.6J/mol进一步产生m/z41离子[14]。在串联飞行时间质谱中该规律同样适用。对m/z41和m/z69离子的相对强度进行总结,发现在含有异亮氨酸的多肽串联质谱中,m/z41和m/z 69亚铵离子的相对强度均高于相对应的含有亮氨酸的多肽,结果列于表2。但在本研究中,当肽段长度大于10个氨基酸时,就不会产生m/z69亚胺离子,因此,该判据也有一定的局限性。
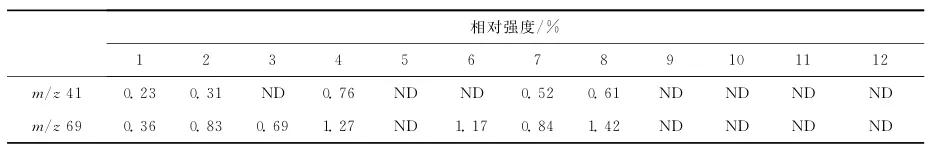
表2 12个肽段4种亚胺相关离子的相对强度Table 2 The relative intensities of four kinds of immonium related ions of Leu/Ile for twelve peptides
2.3 利用b和y系列离子的相对强度区分亮氨酸和异亮氨酸同分异构多肽
由于亮氨酸和异亮氨酸的同分异构体是在相同的实验条件下进行串联质谱分析的,所以离子强度的差异应来源于这两种氨基酸之间的取代所导致的多肽结构的微小差别。肽段5~12的串联质谱各碎片离子的相对强度示于图4。实验发现,对于肽段1~6和11~12,大多数肽段肽裂解产生含异亮氨酸离子的相对丰度明显高于亮氨酸异构体,因此认为该特征可以用来区分这两种氨基酸残基。例如,在图2中,HKDIYGK的b3、b4离子的相对强度明显高于HKDLYGK所产生的b3、b4离子。特别是在肽段FLQPGSPR的串联质谱中,母离子m/z901.2为基峰,其他碎片离子的强度也较高;而在肽段FIQPGSPR的串联质谱中,m/z 70.08离子为基峰,其质谱图示于图5。对于肽段7~10,其碎片离子的相对强度相差较小,然而,正如上面所提到的,肽段EQWTEGTLK 和EQWTEGTIK可通过m/z41和m/z69离子区分,在肽段LHYFNARGR的串联质谱中也检测到了wa9离子。对于性质非常相近的肽段,例如含有IL或LI残基的肽段,虽然预期各碎片离子强度可能很相近,但仍需w离子进行区分。
2.4 TOF/TOF谱形状的相对稳定性
高能碰撞诱导解离谱图被认为具有较好的重复性,这是由于前体离子具有很高的动能,与
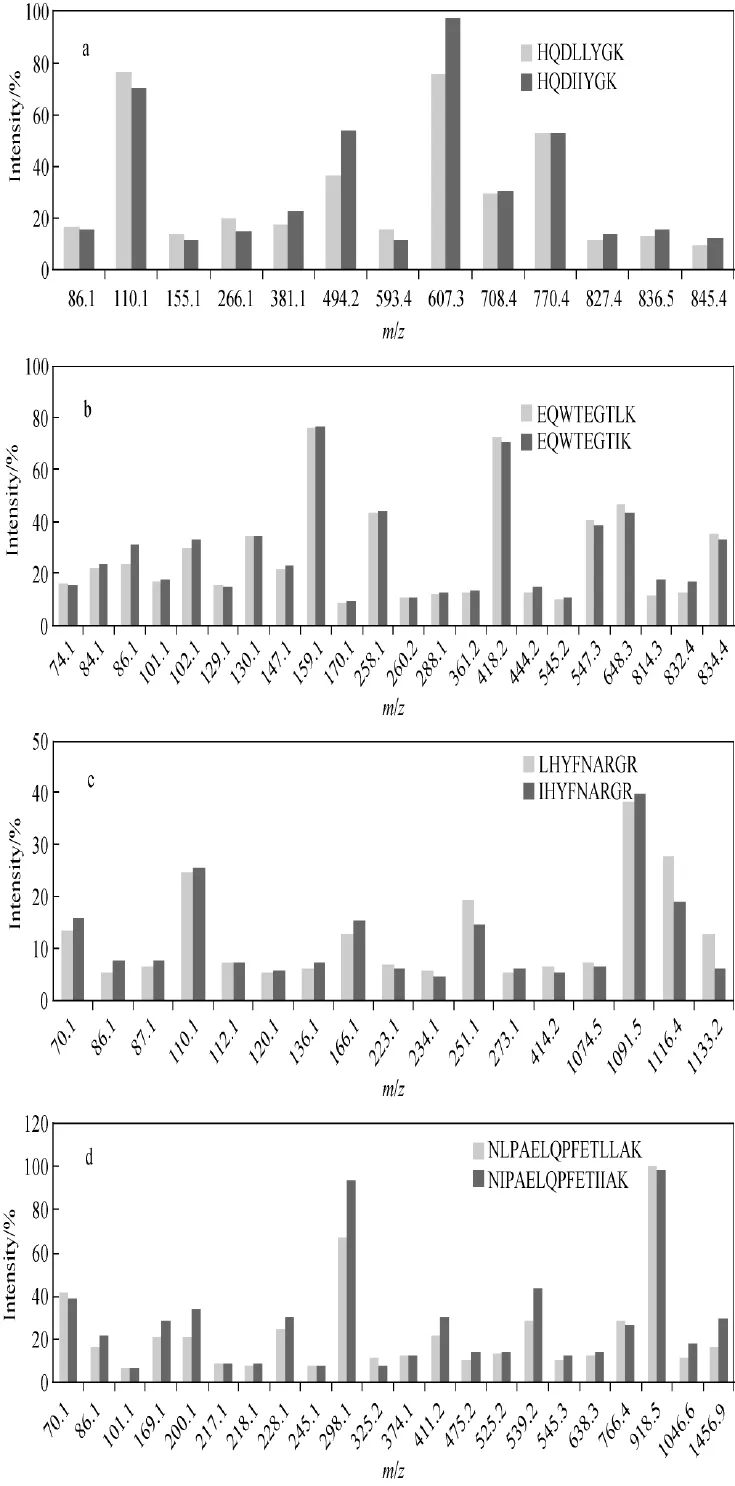
图4 肽段HQDLL/IIYGK(a),EQWTEGTL/IK(b),L/IHYFNARGR(c),NL/IPAELQPFETLL/IIAK(d)各主要子离子的相对强度Fig.4 The relative intensities of the main product ions of HQDLL/IIYGK(a),EQWTEGTL/IK(b),L/IHYFNARGR(c)and NL/IPAELQPFETLL/IIAK(d)
千电子伏前体离子的能量相比,碰撞过程中气体原子的动能可以忽略不计。这意味着,在相同的碰撞条件下,碰撞气种类、气体压力和温度的变化不会明显影响离子分布[17]。Vestal和Campbell指出TOF/TOF高CID的动态范围在典型的实验条件下为3个数量级[21]。在一定程度上,离子强度也可以被看作是串联质谱的本质特征,因为子离子的产生概率与肽结构是高度相关的。因此,离子强度信息可以改善从头测序的准确性[22],MALDI-TOF/TOF可以检测到多肽中的D-氨基酸[23]。离子的性质决定了最有利的解离通道[24],即串联质谱的本质依赖于蛋白质的氨基酸组成[25],但目前尚未见用离子强度区分亮氨酸和异亮氨酸残基的报道。
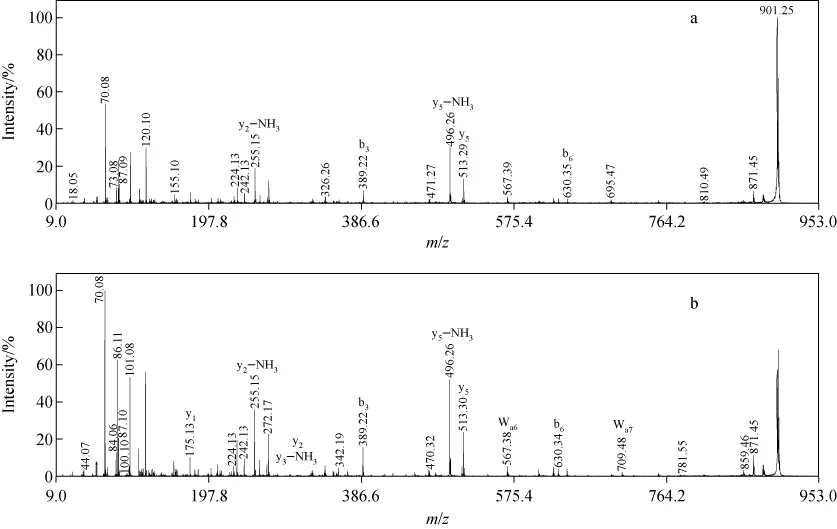
图5 100nmol/L FLQPGSPR(a)和100nmol/L FIQPGSPR(b)的串联飞行时间质谱图Fig.5 MALDI-TOF/TOF CID spectrums of 100nmol/L FLQPGSPR(a)and 100nmol/L FIQPGSPR(b)
3 结论
由于蛋白质序列的多样性,很难找到一个通用的标准从TOF/TOF谱中直接确定亮氨酸或异亮氨酸。本研究表明,亮氨酸和异亮氨酸残基同分异构体的差异有可能体现在碎片离子的相对强度上。这种方法的缺点是需要合成肽段比较差异性,并且不适于大规模数据分析。
[1] PEVTSOV S,FEDULOVA I,MIRZAEI H,et al.Performance evaluation of existing de novo sequencing algorithms[J].Journal of Proteome Research,2006,5(11):3 018-3 028.
[2] MENSCHAERT G,VANDEKERCKHOVE T T M,BAGGERMAN G,et al.A Hybrid,de novo based,genome-wide database search approach applied to the sea urchin neuropeptidome[J].Journal of Proteome Research,2010,9(2):990-996.
[3] SHEVCHENKO A,SUNYAEV S,LOBODO A,et al.Charting the proteomes of organisms with unsequenced genomes by MALDI-quadrupole timeof-flight mass spectrometry and BLAST homology searching[J].Analytical and Bioanalytical Chemistry,2001,73(9):1 917-1 926.
[4] SIMEONOVA D D,SUSNEA L S,MOISE A, et al.“Unknown Genome”proteomics:A new NAD(P)-dependent epimerase/dehydratase revealed by N-terminal sequencing,inverted PCR,and high resolution mass spectrometry[J].Molecular &Cellular Proteomics,2009,8(1):122-131.
[5] WIELSCH N W,THOMAS H,SURENDRANATH V,et al.De novo sequencing of peptides from the parotid secretion of the cane toad,Bufo marinus(Rhinella marina)[J].Journal of Proteome Research,2006,57(2):2 448-2 456.
[6] BROWN A C,MOSS S R,WILSON Z A,et al.An isoleucine to leucine substitution in the ACCase of Alopecurus myosuroides(blackgrass)is associated with resistance to the herbicide sethoxydim Pestic[J].Pesticide Biochemistry and Physiology,2002,72(3):160-168.
[7] WILLIMS J P,CREESE A J,ROPER D R,et al.Hot electron capture dissociation distinguishes leucine from isoleucine in a novel hemoglobin variant,Hb Askew,β54(D5)Val→Ile[J].Journal of the American Society for Mass Spectrometry,2009,20(9):1 707-1 713.
[8] LI M Y,WANG I X,LI Y,et al.Widespread RNA and DNA sequence differences in the human transcriptome[J].Science,2011,333(6 074):53-58.
[9] ARMIROTTI A,MILLO E,DAMONATE G,et al.How to discriminate between Leucine and isoleucine by low energy ESI-TRAP MSn[J].Journal of the American Society for Mass Spectrom,2007,18(7):57-63.
[10]KRISHNA P,PRABHAKAR S,VAIRAMANI M.Differentiation of derivatized leucine and isoleucine bt tandem mass spectrometry under liquid secondary ion mass spectral conditions[J].Rapid Communications in Mass Spectrometry,1998,12 (20):1 429-1 434.
[11]HULST A G,KIENTZ C E.Differentiation between the isomeric amino acids leucine and isoleucine using low-energy collosion-induced dissociation tandem mass spectrometry[J].Journal of Mass Spectrom,1996,31(10):1 188-1 190.
[12]ARMIROTTI A,SCAPOLLA C,BENATTI U,et al.Electrospray ionization ion trap multiplestage mass spectrometric fragmentation pathways of leucine and isoleucine:An ab initio computational study[J].Rapid Communications in Mass Spectrometry,2007,21(19):3 180-3 184.
[13]WU L M,LEMR K,AGGERHOLM T,et al.Recognition and quantification of binary and ternary mixtures of isomeric peptides by the kinetic method:Metal ion and ligand effects on the dissociation of metal-bound complexes[J].Journal of the American Society for Mass Spectrometry,2003,14(2):152-160.
[14]SOLTWISCH J,DREISEWERD K.Discrimination of isobaric leucine and isoleucine residues and analysis of post-translational modifications in peptides by MALDI in-source decay mass spectrometry combined with collisional cooling[J].Analytical and Bioanalytical Chemistry,2010,82 (13):5 628-5 635.
[15]COOK S L,COLLIN O L,JACKSON G P.Metastable atom-activated dissociation mass spectrometry:Leucine/isoleucine differentiation and ring cleavage of praline residues[J].Journal of Mass Spectrom,2009,44(8):1 211-1 223.
[16]LEE S S,LIM J,TAN S,et al.Accurate MALDI-TOF/TOF sequencing of one-bead-one-compound peptide libraries with application to the identification of multiligand protein affinity agents using in situ click chemistry screening[J].Analytical and Bioanalytical Chemistry,2010,82 (2):672-679.
[17]EKMAN R,SILBERRING J,WESTMANBRINKMALM A,et al.Mass spectrometry instrumentation,interpretation,and applications [J].Hoboken,NJ,USA:John Wiley &Sons,INC,2008,89-103.
[18]HUANG L,BALDWIN M A,MALTBY D A,et al.The identification of protein-protein interactions of the nuclear pore complex of Saccharomyces cerevisiae using high throughput matrixassisted laser desorption ionization time-of-flight tandem mass spectrometry[J].Molecular &Cellular Proteomics,2002,1(6):434-450.
[19]ZHANG L Y,REILLY J P.Peptide de novo sequencing using 157nm photodissociation in a tandem time-of-flight mass spectrometer[J].Analytical and Bioanalytical Chemistry,2010,82 (3):898-908.
[20]GOGICHAEVA N V,WILLIAMS T,ALTERMAN M A.MALDI TOF/TOF tandem mass spectrometry as a new tool for amino acid analysis [J].Journal of the American Society for Mass Spectrometry,2007,18(2):279-284.
[21]VESTAL M L,CAMPBELL J M.Tandem timeof-flight mass spectrometry[J].Methods in Enzymology,2005,402:79-108.
[22]KANAZAWA M,ANYOJI H,OGIWARA A,et al.De novo peptide sequencing using ion peak intensity and amino acid cleavage intensity ratio [J].Bioinformatics,2007,23(9):1 068-1 072.
[23]SACHON E,CLODIC G,GALANTH C,et al.D-amino acid detection in peptides by MALDITOF-TOF[J].Analytical and Bioanalytical Chemistry,2009,81(11):4 389-4 396.
[24]MCLUCKEY S A,MENTINOVA.M.Ion/neutral,ion/electron,ion/photon,and ion/ion interactions in tandem mass spectrometry:Do we need them all?Are they enough?[J].Journal of the American Society for Mass Spectrometry,2011,22(1):3-12.
[25]MEDZIHRADSZKY K F,CAMPBELL J M,BALDWIN M A,et al.The characteristics of peptide collision-induced dissociation using a high-performance MALDI-TOF/TOF tandem mass spectrometer[J].Analytical and Bioanalytical Chemistry,2000,72(3):552-558.
Differentiation of Leucine and Isoleucine Residues Using Relative Intensities of Fragment Ions of MALDI-TOF/TOF
WANG Yong1,GAO Sheng2,LI Shui-ming1
(1.Shenzhen Key Laboratory of Marine Bioresources and Ecology,College of Life Science,Shenzhen University,Shenzhen518060,China;2.Shenzhen Key Laboratory of Microbial Genetic Engineering,College of Life Science,Shenzhen University,Shenzhen518060,China)
Differentiation of leucine(Leu)and isoleucine(Ile)is a difficult problem for de novo peptide sequencing.There is a general agreement that backbone cleavage is not capable of discriminating Leu and Ile residues and w-type ions produced by MALDITOF/TOF high energy collision-induced dissociation(CID)can provide distinguishable information.The experiment based on six pairs of tryptic-like isomeric peptides which contain 7to 15residues,showed that w ions were not always can be observed,while the displacement between Leu and Ile will lead to the change of relative abundance of immonium ions,internal fragment ions,b-and y-types of ions,the degree of changes depends on peptide composition and Leu/Ile position.Therefore,it is possible to distinguish Leu from Ile by comparing the relative intensities of the fragment ions of MALDI-TOF/TOF high energy CID spectra.
de novo peptide sequencing;MALDI-TOF/TOF;Leucine;Isoleucine
O657.63
A
1004-2997(2015)04-0302-08
10.7538/zpxb.youxian.2015.0012
2014-07-08;
修回日期:2014-08-28
王 勇(1970—),男(汉族),吉林人,副教授,从事生物质谱分析研究。E-mail:wyong@szu.edu.cn
时间:2015-01-30
;
http:∥www.cnki.net/kcms/detail/11.2979.TH.20150130.1553.012.html

