水介导的通讯路径对脂肪酶热稳定性的影响
闾 蓉,丁彦蕊
(1.江南大学 理学院,江苏 无锡214122;2.江苏省媒体设计与软件技术重点实验室,江苏 无锡214122)
脂肪酶广泛存在于动物、植物和微生物中,能催化水解、酯化、酯交换、醇解、酸解等反应,并且能在有机溶剂、离子液体等非水相中催化反应。脂肪酶在催化反应中不需要辅酶,催化效率也较高,所需反应条件温和,有利于降低生产成本。因此,脂肪酶在洗涤剂、食品、造纸、油脂、化妆品、制药等多个工业领域中有广泛应用[1-2]。高温下保持酶的功能活性和结构完整性是许多蛋白质生物技术、食品加工和商业工业中应用的理想标准,所以对脂肪酶耐热性的研究是工业生产的迫切需求。
水作为生物分子的常见溶剂,在调节蛋白质的结构、功能和生物活性方面发挥着重要作用[3-6]。蛋白质和水之间的相互作用对蛋白质结构、动力学和功能至关重要[6-8],也会影响蛋白质的热稳定性[9-11]。耐热的蛋白质在蛋白质-水界面显示出更丰富的微观形态和更高的亲水性[11-12]。目前已有一些实验的方法及计算机模拟的方法可供研究蛋白质和水之间的关系,有研究发现蛋白质会扰乱其水合壳中的水的动力学[7],而水分子除了调节蛋白质动力学[13],还与蛋白质形成氢键网络直接参与蛋白质功能作用[14],并会介导蛋白质-蛋白质之间相互作用[15-18]。然而,蛋白质-水之间的耦合动力学并不完全清楚。因此,了解水在生物分子结构和动力学以及从复杂网络中最短路径的角度研究蛋白质和水之间的信号传递对于揭示其对蛋白质功能的影响至关重要。
复杂网络的研究和应用目前已渗入到社会学、生物学以及计算机科学等领域,网络的研究具有重要的理论和实际应用的价值[19]。蛋白质的三维结构可通过转换成网络来体现,并且蛋白质中的残基之间和残基-水之间存在相互作用,因此可以残基、水为节点,残基之间及残基-水的相互作用为边构成残基-残基和残基-水网络(简称残基-水全网络)。将复杂网络中最短路径的计算应用在蛋白质网络中具有重要的作用。Zhang等利用最短路径找出与脉络膜新生血管(CNV)相关的候选基因,为治疗CNV提供了新的见解[20]。Papaleo等通过详细分析酶中的最短路径,从而可更清楚了解酶中残基之间的通讯[21]。此外,通过计算蛋白质相互作用网络中的最短路径,可了解网络的性质并且识别关键残基[22]。最短路径选择就是使用最优化的理论方法,搜索两个节点之间多条通路中的最短路径。由于问题以及网络的多样性,求解最短路径的算法也有很多。其中,经典的最短路径算法主要有Dijkstra算法[23]、Floyd-Warshall算法[24]、Bellman-Ford算法[25]。本研究使用Dijkstra算法来挖掘脂肪酶残基-水全网络中的最短路径,以获得脂肪酶中残基和水之间信号传递的动态变化。
以野生型脂肪酶及其突变体6B在2个温度(300 K和400 K)下通过300 ns的长时间分子动力学模拟为研究对象,首先以残基和水为节点,残基-残基及残基-水的相互作用为边,构建脂肪酶残基-水全网络。然后使用Dijkstra算法对脂肪酶残基-水全网络进行最短路径识别,分析最短路径与脂肪酶耐热性的关系,从而进一步分析研究水在脂肪酶最短路径中的作用以及残基和水之间信号传递的动态变化。
1 材料与方法
1.1 脂肪酶的分子动力学模拟
本研究中的研究对象为野生型脂肪酶(WTL,PDB code:1I6W,Tm:56℃)[26]及其突变体6B(PDB code:3QMM,Tm:78.2℃)[27]。6B是印度研究组Rao等利用多轮体外进化获得的野生型枯草芽孢杆菌脂肪酶突变体,共12个突变点(A15S、F17S、A20E、N89Y、G111D、L114P、A132D、M134E、M137P、I157M、S163P、N166Y)[27]。野生型WTL和突变体6B的三维结构如图1所示,其中红色区域是α螺旋,黄色区域是β-折叠,绿色的区域是loop,蓝色的区域是6B中的突变点。
通过Amber软件包[28]在300 K和400 K下分别执行了300 ns的长时间分子动力学模拟。WTL和6B在包含17 765和16 993个TIP3P水分子的周期性水盒子中溶解,蛋白质表面与盒子边缘的距离为2 nm。分别加入5个和1个氯离子中和系统,最后系统中分别有55 996个原子(WTL)和53 685个原子(6B)。
首先,对包含溶剂、氯离子和脂肪酶氢原子的系统进行10 000步最小化,再对整个系统进行10 000步最小化。在NVT系综中将系统加热至300 K,再使用NPT系综进行多步平衡。用Amber ff99SBildn力场描述原子相互作用,截止距离设置为1.2 nm,用PME算法[29]描述静电相互作用和范德华相互作用。通过SHAKE算法[30]来限制所有含氢键的伸缩,设置2 fs的时间步长,每5 000步保存一次轨迹。
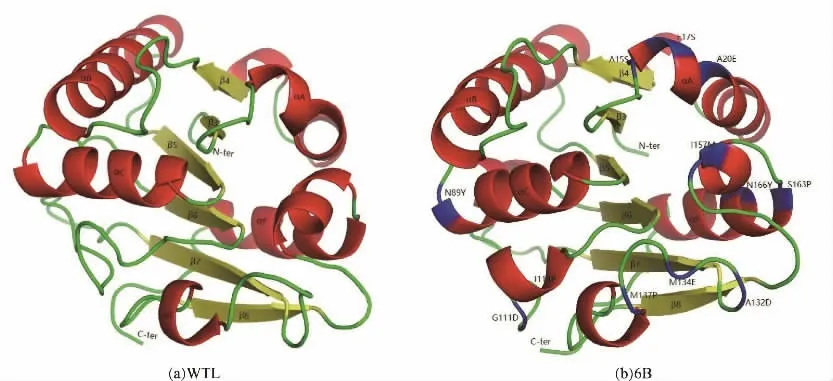
图1 WTL和6B的三维结构Fig.1 The three-dimensional structure of WTL and 6B
1.2 脂肪酶动态残基-水全网络的构建
以分子动力学模拟得到的WTL和6B在300 K和400 K下300 ns的运动轨迹为基础构建脂肪酶残基-水全网络。首先用Ring 2.0[31]得到残基-残基相互作用的数据,设置不同相互作用的距离阈值分别为氢键0.35 nm,盐桥0.35 nm,二硫键0.4 nm,π-π堆积0.7 nm,π-阳离子0.7 nm,范德华相互作用0.08 nm。然后用vmd软件[32]得到残基-水相互作用的数据,其中氢键定义为:如果供体和受体重原子之间的距离<0.35 nm,角度偏差<30°,那么它们之间就形成了氢键。接着以残基和水为节点,残基-残基及残基-水相互作用为边,构建脂肪酶残基-水全网络。每一帧的构象编码为一个脂肪酶残基-水全网络,则模拟时间内的所有帧的网络构成时间轴上的动态脂肪酶残基-水全网络。
1.3 Dijkstra算法计算最短路径
残基和水之间的路径都会随着时间的变化而变化。Dijkstra算法[23]可以求得图中一点到其它任一顶点的最短路径。本文使用Dijkstra算法对脂肪酶残基-水全网络进行最短路径挖掘,挖掘出残基到水之间的路径,从而进一步了解水对脂肪酶耐热性的影响。残基-水全网络中的边权重是残基之间以及残基-水之间的相互作用的数量,边权重越大,就表明节点之间的连接越强,也就意味着节点之间的传输越快[33-34]。使用Dijkstra算法计算最短路径时,节点之间的距离用边缘权重的倒数来表示[35]。
Dijkstra算法的基本思想:假设脂肪酶残基-水全网络G=(V,E),V是所有节点的集合,E是网络中所有边的集合。将V分成两个集合S和U,集合S中存储的是已经求出最短路径的节点以及相应的最短路径的长度,集合U中存储的是除去S中的节点后还没有找到最短路径的节点。最开始的时候S中只有一个节点,假设为起点s(残基或者水分子),U中节点的路径就是“起点s到该节点的路径”。求出U中节点的最短路径,找出路径最短的节点,并将这个节点加入集合S中,更新U中节点和节点对应的路径。接着,再从U中找出路径最短的节点,并且将这个节点加入S中,更新U中的节点和节点对应的路径。重复该操作,直到遍历所有的节点。
Dijkstra算法求脂肪酶残基-水全网络中最短路径的具体步骤为:
1)假设d[s,k]表示起点s到节点k的最短路径,初始化时,集合S中只有一个起点s,那么可以记作S={s},d[s,s]=0。集合U中包含除s之外的其他节点,假如集合U中的节点u与起点s邻接,那么d[s,u]就是节点u和起点s两点之间的权值,如果u和s不邻接,那么它们之间的距离为无穷大。
2)在集合U中选出一个离起点s最近的节点u,把u放入到集合S中,此时d[s,u]就是起点s到达节点u的最短路径值。同时,将节点u从集合U中移除。
3)更新集合U中各个节点到起点s的值,更新的规则为:将新选入集合S中的节点u作为所考虑的中心节点,如果从起点s到节点j的距离(该路径经过节点u)小于原来的距离(该路径不经过节点u),那么更新节点j的最短路径值d[s,j],更新之后的d[s,j]值为d[s,u]+d[u,j]。如果从起点s到节点j的距离(该路径经过节点u)大于原来的距离(该路径不经过节点u),那么就保持起点s到节点j的值d[s,j]不变。
4)重复步骤(2)和(3),直到把所有节点加入集合S中时,算法结束。
2 结果与讨论
2.1 最短路径的动态变化
使用Dijkstra算法计算出WTL和6B的残基-水全网络在不同温度(300 K和400 K)下所有节点之间的最短路径后,分别统计所有帧网络中残基到水分子之间的路径,然后计算了每一条残基到水分子之间的最短路径在300帧里的出现次数,分析最短路径的动态变化。两个节点之间的最短路径会随着时间而变化,如果两个节点之间的最短路径在所有时间帧中的出现次数>270(占比>90%),认为这个路径是稳定的路径,并且出现次数越高,就说明这个路径越稳定。
不同温度下,WTL和6B中稳定的最短路径数如图2所示。随着温度的升高,WTL和6B中两个节点之间形成的稳定的最短路径数都减少了,说明在高温下,残基之间以及残基-水之间的作用会不断断裂和形成,路径难以保持稳定,也就是节点之间的信号传递波动较大。在300 K下,WTL中的稳定的最短路径数为493,6B中的为542。当温度升高到400 K时,WTL中稳定的最短路径数急剧下降成83,6B中的下降为147。显然,不管是在300 K还是400 K温度下,6B中的稳定路径数都大于WTL中的,这可以说明WTL中节点之间的路径在高温下波动较大,信号传递受高温的影响大于6B,并且6B中残基之间以及残基-水之间的作用力比WTL稳定,信号传递更频繁,残基之间以及残基-水之间的作用力有利于脂肪酶的热稳定性[36]。

图2 不同温度下WTL和6B中稳定的最短路径数Fig.2 Number of shortest stable paths in WTL and 6B at different temperatures
2.2 最短路径与脂肪酶耐热性的关系
为了更清楚了解残基和水之间的信号传递,获得脂肪酶残基-水全网络中所有节点之间的最短路径以及在所有时间帧的出现次数后,统计了WTL和6B在两种温度下(300 K和400 K)残基到水分子之间稳定的最短路径的长度,结果如图3所示。随温度升高,WTL和6B中残基到水分子之间的最短路径长度明显减少,说明残基之间以及残基和水之间的作用力会随着温度升高越来越不稳定,有的甚至会消失,残基到水分子之间的信号传递强度在高温下也会降低。由图3(a)可以看出:在300 K时,WTL和6B中路径长度最长的为8,即路径中包含8个节点,并且6<路径的长度≤8的路径数都在10个左右。所以接下来主要对300 K下路径长度排名前10的路径进行比较分析。在400 K时(图3(b)),路径长度最长的只有5,WTL中只有1条路径长度为5,6B中有8条,明显大于WTL,但为了比较分析,主要对400 K下路径长度排名前5的路径进行提取分析,具体的数据如表1、表2和表3所示。
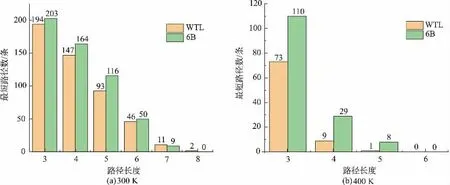
图3不同温度下WTL和6B中不同长度路径的稳定的最短路径数Fig.3 Number of shortest stable paths with different path length in WTL and 6B at different temperatures
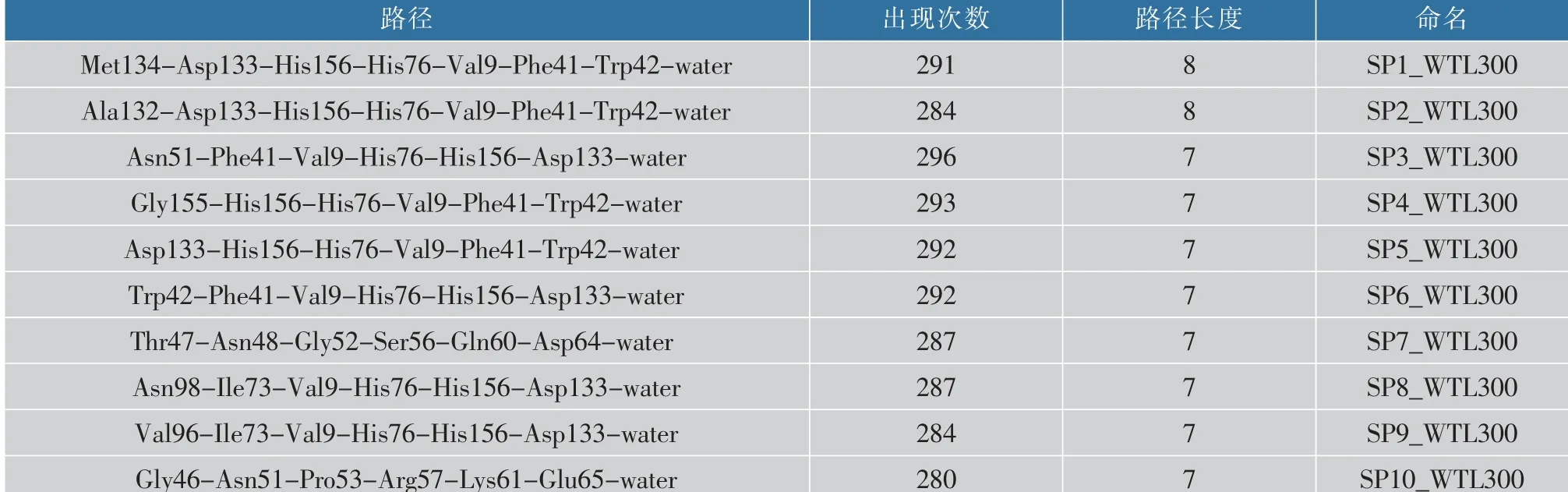
表1 300 K温度下WTL残基到水分子之间路径长度排名前10的稳定路径Table 1 Stable paths from residues in WTL to water molecules at 300 K in the top ten of path length

表2 300 K温度下6B残基到水分子之间路径长度排名前10的稳定路径Table 2 Stable paths from residues in 6B to water molecule at 300 K in the top ten of path length

表3 400 K温度下WTL和6B残基到水分子之间路径长度排名前5的稳定路径Table 3 Stable paths from residues in WTL and 6B to water molecules at 400 K in the top five of path length
从表1和表2可知:300 K时,WTL中的路径长度最长为8,6B中最长的仅为7,将WTL中与6B中路径长度一样的路径相比,WTL中的这些路径在所有时间帧的出现次数普遍都大于6B中的路径。说明WTL在300 K时残基到水分子之间的信号传递强度稍微强一点。当温度升高到400 K时(表3),WTL和6B中的路径长度最长都为5,其中,WTL中路径长度为5的路径只有1条,而6B中的5条路径的长度都为5,并且6B中的路径长度为5的路径在所有时间帧中的出现次数都是大于WTL中路径长度为5的路径。这说明:高温下,与WTL相比,6B中残基和水分子之间可以形成稳定的路径从而加强残基和水分子之间的信号传递,也体现了6B中残基与残基以及残基与水的作用力更紧密更稳定,这维持了脂肪酶的耐热性[10]。从表4可以看出:WTL和6B最短路径中的残基大部分都位于loop和αB。由表5可知:WTL最短路径中的残基大部分位于αB和αC,而6B最短路径中的残基大部分位于loop和αA。说明:loop和α螺旋中的残基容易与残基以及水分子形成稳定的相互作用,形成稳定的路径从而加强脂肪酶的结构。一般来说,脂肪酶的loop区域和turn区域非常灵活,其次是α螺旋。loop和α螺旋的残基与残基以及残基与水之间的相互作用可以降低loop和α螺旋的灵活性,增强刚性,从而促进蛋白质的热稳定性[37]。
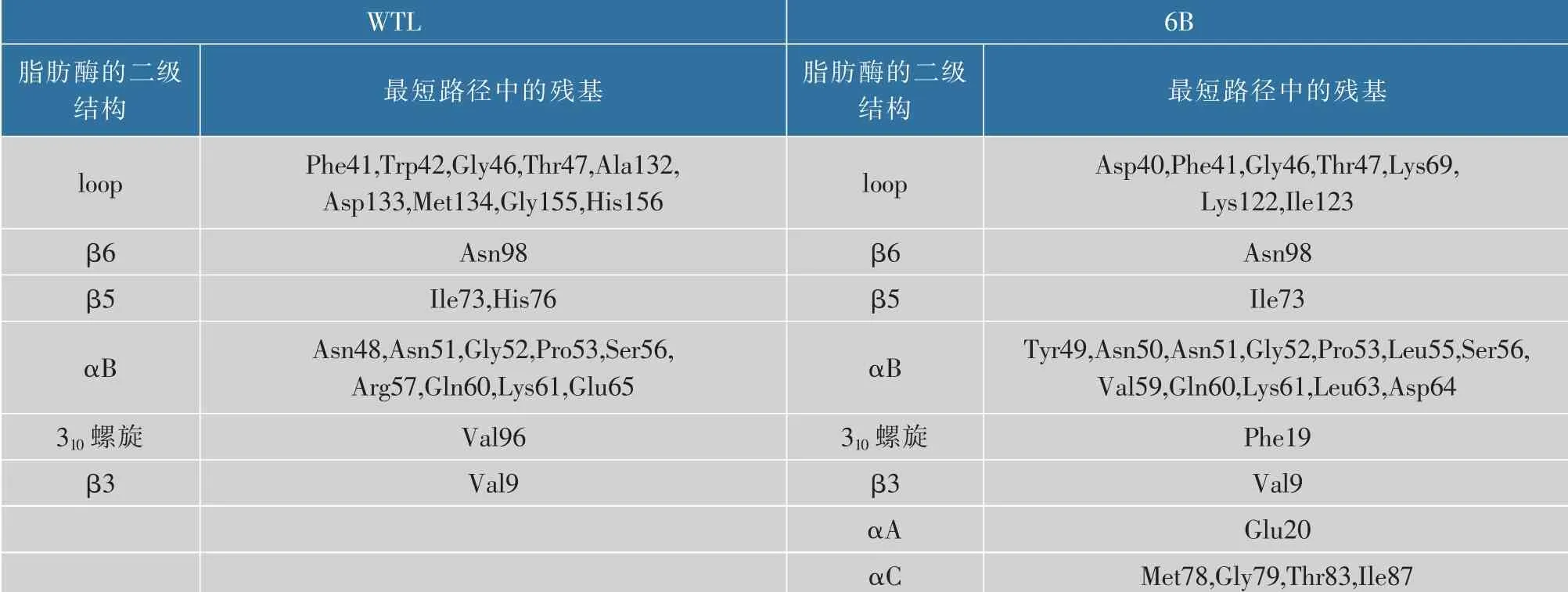
表4 300 K温度下WTL和6B残基到水分子之间稳定的最短路径中的残基在脂肪酶二级结构中的分布Table 4 Distribution of residues in the shortest stable path from residues in WTL and 6B to water molecules at 300 K in the secondary structure of lipase
表1中,SP1_WTL300和SP2_WTL300中除了起始节点不一样,其他路径中经过的节点都是一样的,可以认为是相似路径,同一个酶中的相似路径,就可以认为是主干路径。表1中前6条路径以及SP8_WTL300和SP9_WTL300中都频繁经过His156、His76和Val9,其中位于β5的His76可以分别与loop(β8与αF之间)的His156和β3上的Val9形成稳定的氢键作用,从而可以加强柔性区域loop与β5、β3之间的联系。从脂肪酶的二级结构,可以看出另外两条路径SP7_WTL300和SP10_WTL300可以使得loop(αB与β4之间)与αB之间的关系更紧密。表2中,6B前3条路径都为主干路径,并且SP6_6B300和这3条路径一样,都频繁 经 过αB上 的Leu63、Val59、Leu55、Asn51和Lys69这5个节点,这5个节点之间都能够形成稳定的氢键作用,并且Asn51分别与loop(αB与β4之间)的Gly46和αB上的Tyr49形成范德华力,与Thr47形成氢键作用,从而加强了loop与αB之间的联系。SP4_6B300、SP7_6B300和SP10_6B300虽然经过的节点不太一样,但也是加强了loop(αB与β4之间)与αB之间的联系。另外,SP5_6B300是连接6B中loop(β6与β7之间)、αC与水分子的重要路径,SP9_6B300则是加强了6B中的β6,β5,β3,αB以及310螺旋之间的联系。以上可以表明300 K温度下,WTL和6B中经过的二级结构差异不是很大,但是随着温度的升高,WTL和6B中差异更明显。结合表3和表5,SP1_WTL400和SP4_WTL400仅仅是加强了αC内部与水之间的信号传递,SP3_WTL400也只是使得αB内部的结构更紧密。WTL中另外两条路径 SP2_WTL400和SP5_WTL400分别加强了loop(αB与β5之间)和αB间的关系以及β7和β8间的联系。SP1_6B400、SP2_6B400和SP3_6B400是主干路径,它们共同经过的节点为β3上的Met8,310螺旋上的Phe19以及αA的Glu20,这3条路径的起始节点分别为位于loop(αB与β4之间)的Val39,β3上的Val7,β4上的Tyr37,所以这3条路径使得这些区域连接更加紧密,也加强了这些区域与水之间的信号传递。另外两条路径中,SP4_6B400使得αA内部的结构更紧密,SP5_6B400则是连接loop和β7的重要路径,其中Ala113位于脂肪酶最长的loop区域(β6与β7之间),它可以与另一条loop(β7与β8之间)上的Asp144形成稳定的氢键作用,可以稳定两个loop区域,从而稳定6B的二级结构。总之,这些区域的最短路径都可以降低柔性区域的柔性,从而可以抵抗高温。
通常310螺旋是不稳定的,而且有研究表明:310螺旋的剧烈运动会影响结构的稳定性[27]。从表4可以看出WTL中的Val96和6B中的Phe19位于310螺旋。WTL中包含Val96的路径只有SP9_WTL300,其中Val96和β5上的Ile73之间可以形成稳定的范德华力。与WTL相比,6B在300 K温度下包含Phe19的路径有2条,400 K温度下有3条,这几条路径中Phe19与Val9、Met8和Glu20之间都有形成强大的范德华力,从而稳定310螺旋,稳定脂肪酶结构。这可以说明6B中通过的310螺旋的信号传递比WTL更强更稳定。另外,值得注意的是:6B中与Phe19形成范德华力的Glu20位于αA的N端,由Ala20突变而成,可以表明:突变之后的Glu20更容易与水形成氢键作用,并且与水形成氢键的能力比较稳定,A20E突变使脂肪酶热稳定性增强。综上分析:与WTL相比,不管是300 K还是400 K,6B中的路径经过了更多的二级结构,使得6B中的结构更加紧密,加强了残基与水分子之间的信号传递,稳定了脂肪酶的二级结构。
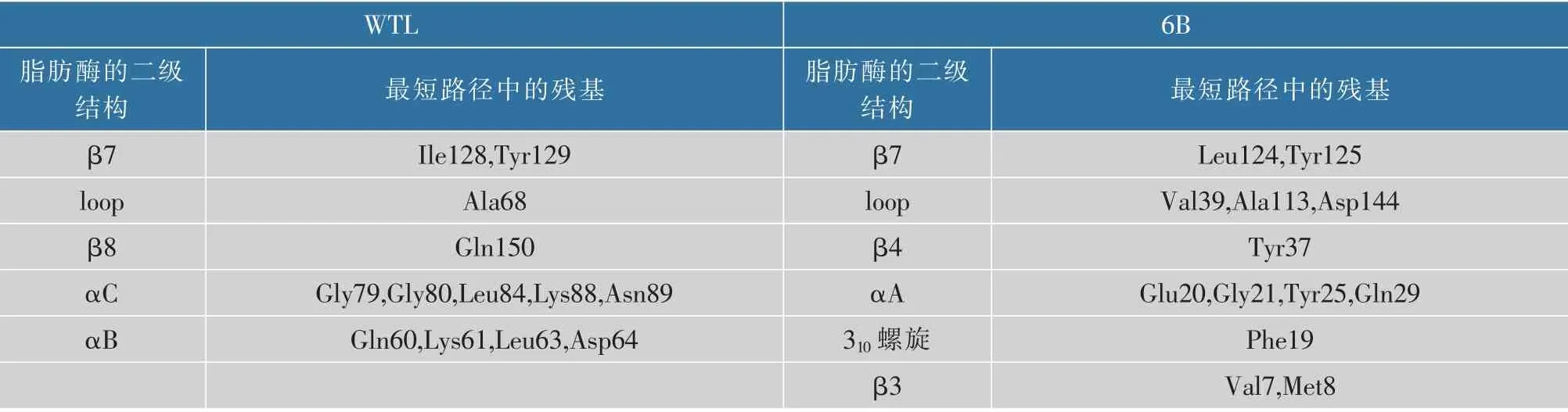
表5 400 K温度下WTL和6B残基到水分子之间稳定的最短路径中的残基在脂肪酶二级结构中的分布Table 5 Distribution of residues in the shortest stable path from residues in WTL and 6B to water molecule at 400 K in the secondary structure of lipase
3 结语
本研究结合分子动力学模拟得到WTL和6B的运动轨迹构象,构建脂肪酶动态残基-残基和残基-水相互作用网络(简称残基-水全网络),通过分析两种脂肪酶在不同温度下的最短路径来探讨脂肪酶突变与热稳定性之间的关系,进一步分析研究残基和水之间的信号传递的动态变化。通过Dijkstra算法对WTL和6B动态残基-水全网络进行最短路径计算,发现:6B在不同温度下的稳定路径数都是大于WTL的,说明WTL中的节点之间的路径在高温下波动较大,信号传递受高温的影响大于6B,并且6B中的残基之间以及残基-水之间的作用力比WTL稳定,信号传递更频繁。接着通过对稳定路径中残基所在的二级结构分析,发现残基到水分子之间的最短路径可以减少脂肪酶的柔性区域loop和α螺旋的柔性,使得脂肪酶结构更稳定。与WTL相比,不管是300 K还是400 K,6B中的路径经过了更多的二级结构,使得6B中的结构更加紧密,加强了残基与水分子之间的信号传递,从而可以稳定脂肪酶的二级结构。另外,分析结果还发现突变体中的突变点A20E在突变之后更容易与水形成稳定的氢键作用,突变使脂肪酶热稳定性增强。

