我国特殊医学用途婴儿配方食品现状浅析
李美英,邓少伟,李雅慧,王 星,吴 娜
(国家市场监督管理总局食品审评中心,北京100070)
近年来,一些不良企业将目标瞄准母婴群体,以固体饮料(属普通食品)冒充特殊医学用途婴儿配方食品(属特殊食品)坑害婴儿的事件时有发生。2020年5月,湖南省不良商家将“固体饮料”冒充“配方粉”,严重侵害婴儿生命健康,引起社会广泛关注,大量媒体深度报道或刊文转载。
特殊医学用途婴儿配方食品,是特殊医学用途配方食品中的一类,是针对患有特殊紊乱、疾病或医疗状况等特殊医学状况婴儿的营养需求而设计的粉状或液态配方食品,必须在医生或临床营养师的指导下,单独食用或与其他食物配合食用,其能量和营养成分能够满足0~6月龄特殊医学状况婴儿的生长发育需求,6月以上婴儿需配以辅食[1-2]。据国家统计局每年发布的《国民经济和社会发展统计公报》[3],2017—2019年我国出生人口分别为1 700万、1 523万和1 465万。其中,部分婴儿由于特殊医学状况(如各种疾病影响或代谢问题等),不可通过母乳或普通婴儿配方食品喂养。特殊医学用途婴儿配方食品,是这些婴儿生命早期或更长时间内的主要食物来源。存在各种疾病影响或代谢问题等特殊医学状况的婴儿是脆弱群体,必须采取充分措施保障其生命健康。为加强特殊医学用途婴儿配方食品的监管,我国在2010年出台《食品安全国家标准特殊医学用途婴儿配方食品通则》(GB 25596-2010)[4],2016年出台的《特殊医学用途配方食品注册管理办法》明确:这类食品实施上市前需注册审批。之后相继出台的配套法规文件,在生产、销售、广告等方面也提出了明确要求。
特殊医学用途配方食品在我国起步晚,无论在政府监管、产业发展,还是社会共识等方面,均存在很大不足。加上社会对特殊医学状况的婴儿关注度不高、消费者对特殊医学用途婴儿配方食品了解不足,且这类产品一般价格高、利润空间大,引得一些不良分子铤而走险。若要杜绝这些违法违规行为,除了加强对违法违规行为的处罚,还应从政策引导、制度建设、社会共治、科普宣传等方面下功夫。本研究对比国内、国外监管特殊医学用途婴儿配方食品的法规标准,归纳我国特殊医学用途婴儿配方食品的批准现况,分析特殊医学用途婴儿配方食品与固体饮料、普通婴幼儿配方乳粉的区别,剖析固体饮料冒充特殊医学用途婴儿配方食品销售屡禁不止的原因,并对这类产品的监管提出建议。
1 对比国内、国外特殊医学用途婴儿配方食品的监管要求
1.1 特殊医学用途配方食品
特殊医学用途配方食品在国外发达国家、地区起步较早,工业化营养产品的应用起源于欧洲,美国FDA于1957年批准苯丙酮尿症配方作为“孤儿药”上市,用于肠内营养治疗。国际食品法典委员会(Codex Alimentarius Commission,CAC)在《特殊医用食品标签和声称法典标准》(CODEX STAN 180-1991)中,将这类食品命名为“特殊医用食品”,特殊医用食品指:为病人进行膳食管理并仅能在医生监督下使用的,经特殊加工或配制的,用于特殊膳食的一类食品[5]。全球很多国家针对特殊医学用途配方食品的法规标准是以CAC标准为基础建立的,各国对这类食品的命名略有不同,但定义和基本原则一致:是食品,而非药品;为特殊制度或特殊配方;适用人群为特定疾病患者;须以医学和营养学为基础,并有科学依据证实产品的安全性和有效性[6-7]。
1974年,我国才将肠内营养制剂作为药品应用于临床。2010年,原卫生部发布《食品安全国家标准特殊医学用途婴儿配方食品通则》(GB 25596-2010),我国才首次引入特殊医学用途配方食品的概念。2015年,新修订的《食品安全法》明确规定:特殊医学用途配方食品应当经国务院食品药品监督管理部门注册。2016年,《特殊医学用途配方食品注册管理办法》正式颁布,该文件明确:特殊医学用途配方食品注册时,应当提交产品配方、生产工艺、标签、说明书以及表明产品安全性、营养充足性和特殊医学用途临床效果的材料,经注册审评审批后获得文号为“国食注字TY+8位数字”的产品批准证书。根据《食品生产许可管理办法》,拟在我国境内生产的特殊医学用途配方食品生产企业,还需获得生产许可后方可组织生产。特殊医学用途婴儿配方食品还需严格执行《特殊医学用途配方食品生产许可审查细则》《GB 29923-2013食品安全国家标准特殊医学用途配方食品企业良好生产规范》等有关规定。企业所在省份的食品监管部门,对企业进行严格细致的生产许可审查。在生产销售和广告方面,应遵守《食品经营许可管理办法》《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理暂行办法》等规定。
1.2 特殊医学用途婴儿配方食品
不同国家、地区、组织对特殊医学用途婴儿配方食品的管理要求[8]比较见表1。表中所列的国家、地区对这类食品的监管要求基本一致:均对这类食品单独命名;均建立了较为完整的法规标准体系;均强调要在医生或临床营养师的指导下使用、不得自行选购;在标签和声称方面,均要求遵循特殊医学用途配方食品有关要求;在添加剂方面,普遍采取婴儿配方食品的标准要求,CAC有针对特殊医学用途婴儿配方食品允许使用的添加剂名单,并在2001年更新。但是,仅我国实施上市前的注册审批制和生产许可制;我国和CAC一致,针对这类食品建立了专门的食品安全国家标准,明确该类产品可以根据适用人群的特定营养需求在普通婴儿配方食品的基础上对配方进行合理调整,并详细规定了特殊医学用途婴儿配方食品的可选择性成分、目标使用人群、作用、使用方法、标签和声称的方式方法等内容。美国、欧盟和澳新则是把特殊医学用途婴儿配方食品的监管要求,涵盖在婴儿配方食品相关的标准规范中,以单独章节或特殊条款进行陈述。华家才等[9]比较分析国内、国外特殊医学用途婴儿配方食品标准后指出:我国已经形成较为完善的婴幼儿食品安全标准体系,特殊医学用途婴儿配方食品标准规定的营养素指标与CAC标准高度一致,并且不低于欧盟、澳新标准。
为确保特殊医学状况婴儿的生命健康,针对特殊医学用途婴儿配方食品,我国在生产销售环节还设置了单独条款要求。在生产环节,《特殊医学用途配方食品生产许可审查细则》[10]第三十一条第二款规定:“生产特殊医学用途婴儿配方食品所使用的食品原料和食品添加剂不应含有谷蛋白,加入的淀粉应经过预糊化处理;不得使用氢化油脂、果糖和经辐照处理过的原料;生产0~6个月龄的特殊医学用途婴儿配方食品,应使用灰分≤1.5%的乳清粉,或灰分≤5.5%的乳清蛋白粉。”第三十三条第三款规定:“生产特殊医学用途婴儿配方食品的,成品出厂应当自行逐批全项目检验,且每年至少1次对全部出厂检验项目的检验能力进行验证。”在销售环节,《食品经营许可审查通则》[11]第二十条要求:“申请保健食品销售、特殊医学用途配方食品销售、婴幼儿配方乳粉销售、婴幼儿配方食品销售的,应当在经营场所划定专门的区域或柜台、货架摆放、销售。”在广告方面,《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理暂行办法》[12]第二十二条规定:“特殊医学用途婴儿配方食品广告不得在大众传播媒介或者公共场所发布。”
由此可看出:我国对特殊医学用途婴儿配方食品的监管更加严格,法规标准体系更为清晰,标准规定的营养素指标与CAC标准高度一致。这为保障特殊医学状况婴儿的健康提供了制度保障。
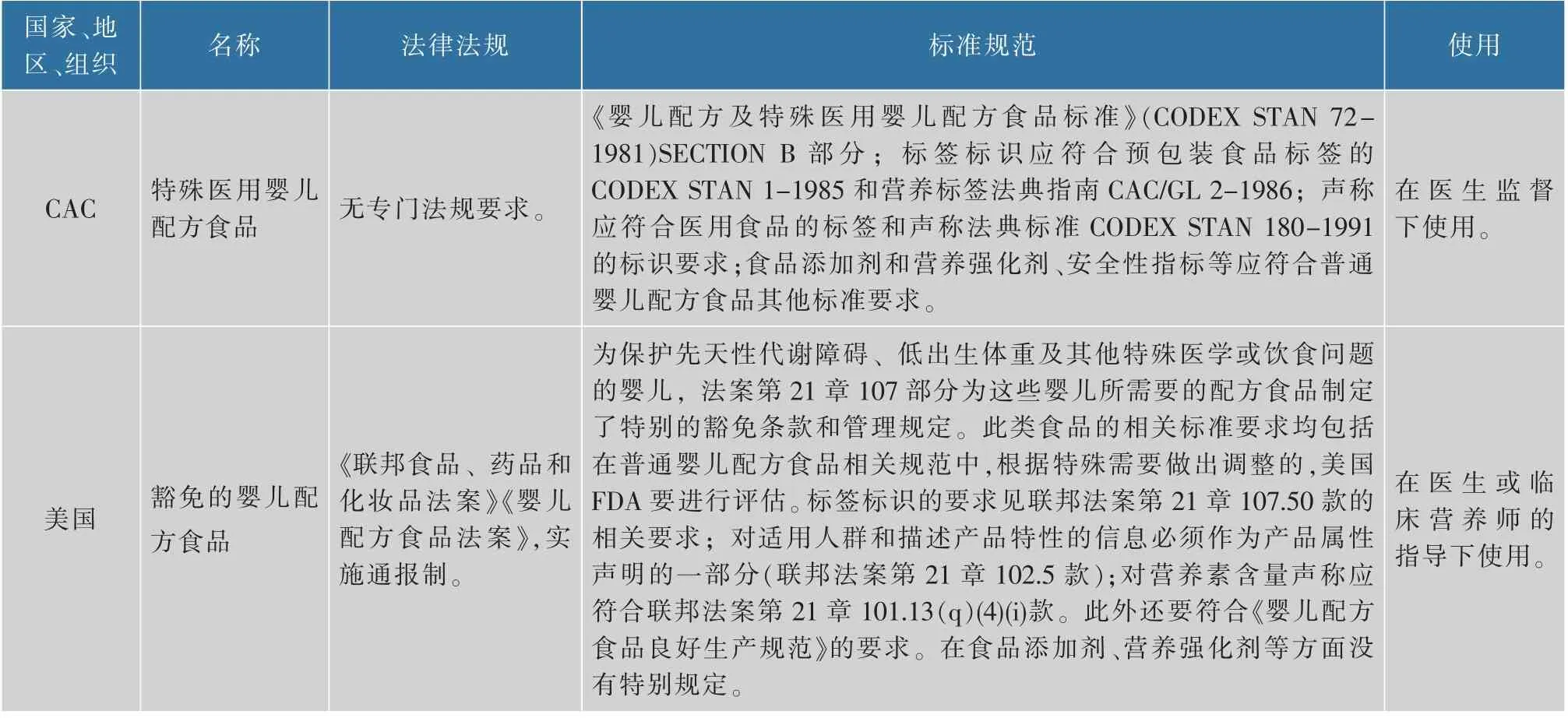
表1 不同国家、地区、组织对特殊医学用途婴儿配方食品管理要求比较Table 1 Comparative analysis on the regulatory requirements of IFFSMPin domestic and abroad

续表1
2 我国特殊医学用途婴儿配方食品批准情况
根据《食品安全国家标准特殊医学用途婴儿配方食品通则》(GB 25596-2010),我国特殊医学用途婴儿配方食品包括为6类,产品类别、适用特殊医学状况、主要临床症状、配方主要特点及产品批准情况见表2。由表2可知,特殊医学用途婴儿配方食品使用对象为特殊医学状况婴儿,主要临床症状表现为腹泻、过敏、早产/低出生体重及其他代谢障碍。针对不同的医学状况,不同类型的产品在配方设计上存在差异,需针对不同医学状况的营养需求进行个性化设计。

表2 我国特殊医学用途婴儿配方食品的产品类别及批准情况Table 2 The current status on approval of IFFSMP in China
目前,我国共批准注册特殊医学用途婴儿配方食品30个,其中进口产品21个,国产新产品9个。由于我国特殊医学用途配方食品注册审批工作开展时间较短,已批准的特殊医学用途婴儿配方食品数量不多,且主要以进口产品为主;产品已覆盖特殊医学用途婴儿配方食品的6大类型,但是产品数量少,主要集中在适用于早产/低出生体重婴儿的产品,占比47%;氨基酸代谢障碍配方只有1个适用于苯丙酮尿症的产品,甲基丙二酸尿症、丙酸血症、枫糖尿症甲等特殊医学状况尚无产品批准;乳蛋白深度水解配方或氨基酸配方和氨基酸代谢障碍配方,所批准产品均为进口,我国还不具备这两类产品的研发、生产能力。批准产品类型分布情况见图1。

续表2
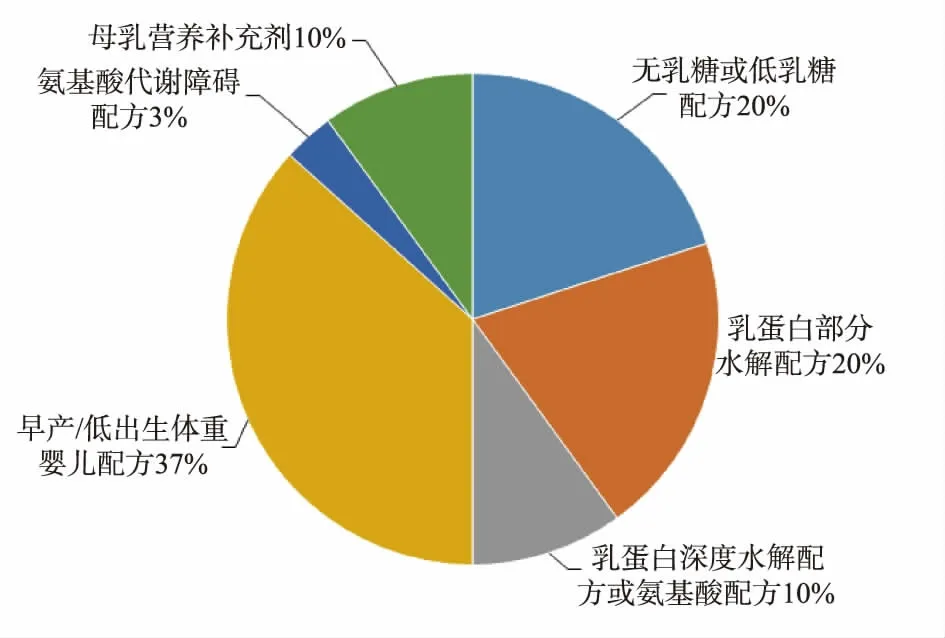
图1 我国特殊医学用途婴儿配方食品的产品类型分布Fig.1 Distribution of the approved IFFSMPs in China
3 固体饮料冒充特殊医学用途婴儿配方食品销售事件
2019年5月,《新京报》报道:北京3家医院院内商店将宁波特壹食品有限公司、青岛金大洋乳业有限公司生产的“固体饮料”充当特殊医学用途婴儿配方食品售卖[13]。国家市场监督管理总局官网于当年6月6日发布《关于查处宁波特壹食品有限公司和青岛金大洋乳业有限公司违法违规行为的通报》。同年8月7日,青岛市黄岛区市场监督管理局对涉事企业违法行为依法下达《行政处罚决定书》。
2019年7月,《人民日报》记者辗转4省5市,追踪调查雅乐迪配方粉[14]。雅乐迪配方粉为山东梵和生物科技有限公司的产品,为固体饮料,包装上却违规标注“适度水解蛋白配方粉”“适宜为乳蛋白消化不良,乳蛋白过敏高风险人群提供营养支持”。《关于对山东梵和生物科技有限公司的查处情况报告》指出:该公司“存在生产经营未在食品标签的醒目位置真实标示‘固体饮料’‘调制乳粉’等反映产品真实属性的产品专用名称的预包装食品,以及食品标签特别强调含有某种或多种有价值、有特性的配料或成分,未在标签标示添加量或在成品中的含量的预包装食品的行为,且其生产经营的涉案预包装食品标签含有虚假内容”。
2020年5月,湖南省郴州市永兴县不良商家将蛋白型固体饮料倍氨敏“奶粉”冒充特殊医学用途婴儿配方食品推荐给消费者,造成多名婴儿出现湿疹、体重严重下降、头骨畸形酷似“大头娃娃”、不停拍头等异常情况[15]。之后,2019年郴州市儿童医院医生推荐“舒儿呔”固体饮料冒充特殊医学用途婴儿配方食品事件也被曝光。事件发生后引起社会广泛关注,5月13至14日2天内各大媒体发布或转发相关信息便超3万篇次,引起一波舆情热点。5月13日,国家市场监督管理总局官网发出通知,要求湖南省市场监管部门严查普通食品冒充特殊医学用途配方食品的违法行为[16]。5月15日,国家市场监督管理总局官网发布通知,在全国开展固体饮料、压片糖果、代用茶等食品专项整治工作。
4 固体饮料、特殊医学用途婴儿配方食品和婴幼儿配方乳粉的区别
特殊医学用途婴儿配方食品与固体饮料存在本质的区别:特殊医学用途婴儿配方食品为特殊医学用途配方食品中的一种,属于特殊食品,是特殊医学状况的婴儿生长早期的唯一营养来源;固体饮料属于普通食品,不限定使用人群,其蛋白质等营养素含量均远低于婴幼儿配方乳粉和特殊医学用途婴儿配方食品,不能满足婴儿生长发育需要。特殊医学用途婴儿配方食品也与普通婴幼儿配方乳粉不同:特殊医学用途婴儿配方食品是针对特殊医学状况婴儿生长需要个性化设计的食品,普通婴幼儿配方乳粉不能满足这类婴儿的营养需求;王星等[17]对我国特殊医学用途婴儿配方食品与普通婴幼儿配方食品法规标准比较分析表明:二者在产品定义、注册要求、生产条件、使用的原料、营养成分限量及标签标识等方面,均存在差异。特殊医学用途婴儿配方食品、固体饮料、婴幼儿配方乳粉的区别见表3。
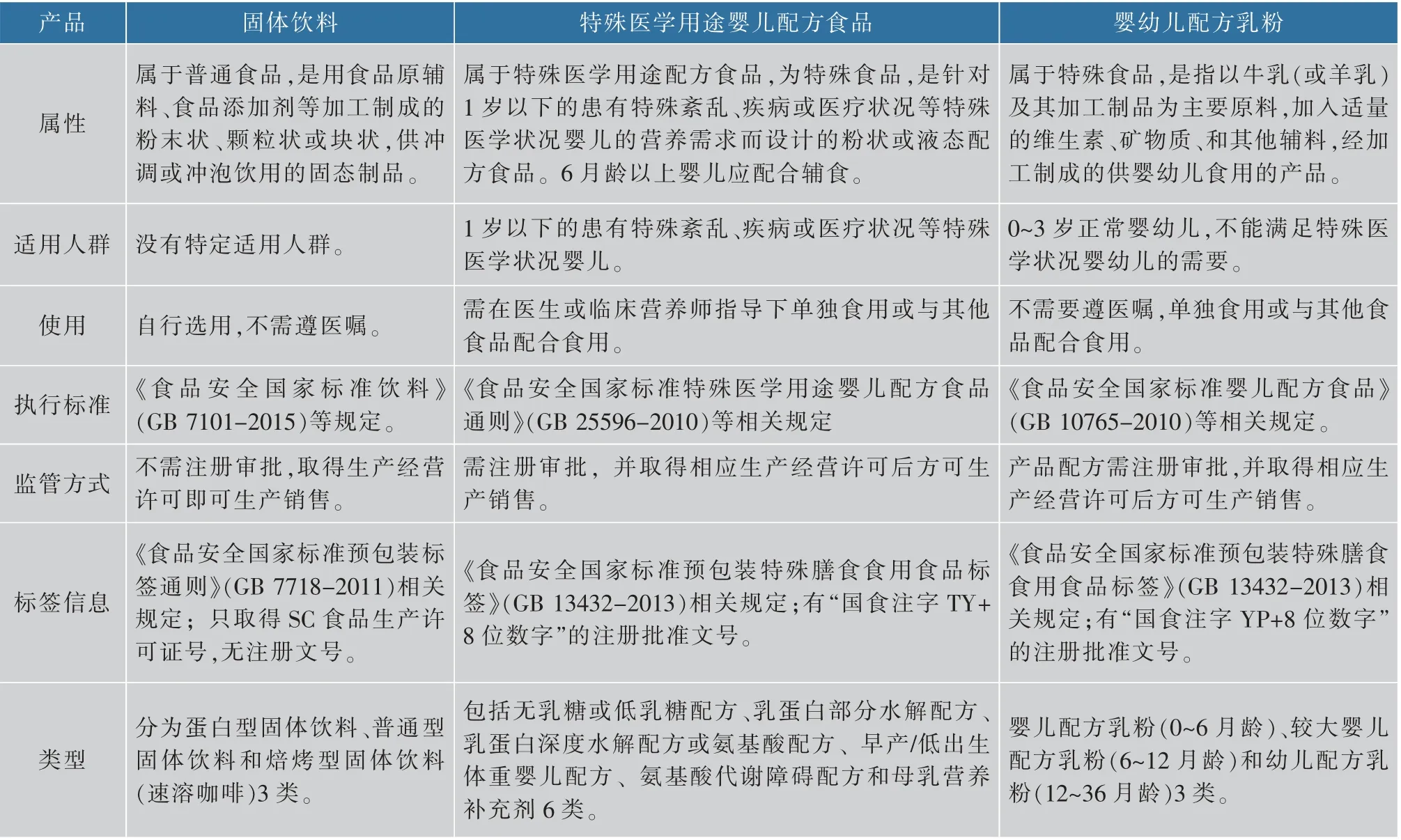
表3 固体饮料、特殊医学用途婴儿配方乳粉和婴幼儿配方乳粉的区别Table 3 The differences of IFFSMP,solid beverages,and common infant formula milk powder
5 固体饮料冒充特殊医学用途配方食品销售事件原因分析
对厂家和销售渠道监管力度不足,导致一些不良企业在利益驱动下违法违规。由于特殊医学用途配方食品在我国起步较晚,部分监管人员尤其是基层监管人员,对于特殊医学用途配方食品的概念和相关法规政策不了解,一定程度上导致监管不到位。另一方面,自2008年遭遇“三聚氰胺”事件后,国家高度重视婴幼儿配方乳粉质量安全,花大力气推进产品品质提升,我国奶粉行业整体呈现出安全健康发展的势头,近年来国产奶粉抽检合格率高达99.5%。然而,对于因各种疾病影响或代谢问题而不能喂食母乳或普通婴儿配方食品的婴儿,他们的口粮——特殊医学用途婴儿配方食品,社会关注度并不高。事实上,这部分婴儿的数量并不少。据研究报道,我国早产儿发生率约为9.9%[18],婴幼儿牛奶蛋白质过敏患病率为0.83%~3.50%[19]。尽管近年来未见婴幼儿氨基酸代谢障碍(如苯丙酮尿症、甲基丙二酸尿症、丙酸血症和枫糖尿症等)和乳糖不耐受全国发生率的权威流行病学调查结果,但是,一些地区性或早年研究结果可供参考:黄新文等研究发现,2009年到2016年间仅浙江省便通过串联质谱技术筛出氨基酸代谢疾病164例[20];2008年上海市儿童医院研究发现,0~6岁儿童乳糖吸收不良的发生率为47.4%、乳糖不耐受发生率为16.5%[21]。北京大学人民医院刘洋洋等[22]更是指出,我国乳糖不耐受发生率可达46.9%~70.0%,最常见的症状为腹泻。面对这样庞大的市场、较高的产品价格、尚显薄弱的监管能力,一些不良企业在利益的驱动下铤而走险。
已批准产品数量少,消费者获取特殊医学用途婴儿配方食品的渠道有限。特殊医学用途配方食品产业专业性强、多学科交叉,涉及食品加工、临床营养、临床医学、食品安全等多个方面,与普通食品产业很不相同,既需要科研技术力量的投入,也需要科技研发的探索积累,但我国的营养、健康等学科建设起步晚,科技积累不足,科研投入较低,致使我国营养健康产业整体基础比较薄弱,特殊医学用途配方食品产业则更为薄弱,国产企业核心技术缺乏,产品推出缓慢,可供选择的产品数量不足、类型单一。我国特殊医学用途配方食品注册管理制度刚刚起步,批准的特殊医学用途婴儿配方食品仅30个,其中进口产品占2/3以上,生产企业多为国外企业,我国企业仅有两三家,实际具备生产能力的可能更少。产品种类单一,如氨基酸代谢障碍配方只有1个适用于苯丙酮尿症的进口产品,甲基丙二酸尿症、丙酸血症、枫糖尿症甲等特殊医学状况尚无产品可用;适用于过敏婴儿的产品仅9个。近年来,我国婴儿过敏发生率呈上升趋势,2016年中国疾病预防控制中心妇幼保健中心针对0~24月龄婴幼儿过敏性疾病症状的流行病学调查发现,婴幼儿家长报告其子女曾经发生或正在发生过敏性疾病症状的比例为40.9%[23]。特殊医学用途配方食品社会需求量大,产品数量少,消费者购买困难,供需不平衡,为不良分子留下可乘之机。
宣传教育不足,社会各界对特殊医学用途配方食品的认知欠缺。我国监管人员、医务工作者、特殊人群、普通消费者等,普遍对特殊医学用途配方食品的认知尚浅。在临床应用方面,我国临床营养学科正在建设之中,不同地区、不同类型的医院发展不均衡,大部分临床科室对特殊医学用途配方食品不了解。在固体饮料冒充特殊医学用途婴儿配方食品事件中,便存在临床医生参与推荐的情况。在科普宣传教育方面,我国对营养科学、特殊医学用途配方食品的宣传教育不够广泛,缺乏耳濡目染的科普宣传。多数普通消费者对这类产品不甚了解,更不知道这类产品必须在“医生或临床营养师指导下使用”,这导致消费者在不良分子误导下自行选用产品,直到不良症状明显时才发现问题,对婴儿造成不可逆转的损害。湖南永州固体饮料冒充特殊医学用途婴儿配方粉事件发生后,国家市场监督管理总局的官网和微信公众号发布了一系列消费警示和科普宣传小知识,被各大媒介转载,受到广泛好评,侧面反映出社会大众对这类知识的渴望。
6 关于进一步加强我国特殊医学用途婴儿配方食品监管的思考
加大政策引导,鼓励科技创新,推进特殊医学用途配方食品产业发展。加强特殊医学用途配方食品产业规划部署和政策研究,前瞻性布局特殊医学用途配方食品产业科技计划项目,分层次建立“产学研用”相结合的研发平台,尤其是针对特殊医学状况婴儿开展核心技术问题的联合攻关,打破国外的技术壁垒。加大营养健康产业财政资金投入,出台相关政策鼓励企业加大科研投入,为打造科技创新水平高、竞争力强、社会责任感强的特殊医学用途配方食品企业营造良好的政策环境。
切实落实“四个最严”要求,强化事前事中事后监管,努力形成社会共治的良好局面。特殊医学用途配方食品实施的注册制和生产经营许可制,均属于上市前监管。在注册审批时,应加强对产品标签、标识的管理,避免夸大和虚假宣传,通过客观、准确、有价值的标识信息,让使用者正确了解、规范使用特殊医学用途配方食品。此外,应该落实《国务院关于加强和规范事中事后监管的指导意见》的要求,加强对特殊医学用途配方食品的生产、销售、经营环节的监管力度,加强事中事后监管。加强对基层监管队伍的建设,及时发现虚假销售、误导消费者的行为,并实行严厉打击、严肃处罚,将监管外压转换为企业提升效益的内生动力。推进食品行业诚信体系建设,落实企业主体责任,鼓励行业协会引导自律,让良性市场机制发挥决定作用。尝试设立良性的举报人制度,进一步明确和规范举报方式、举报人保护、提供奖励等措施,强化社会监督。
加强人才培养,深入强化科普宣传,提高社会各界对特殊医学用途配方食品的认知水平。无论是特殊医学用途配方食品的研发、使用指导,还是监管和科普宣传,都需要大量具备相关专业知识的人才作为基础保障。要依托现有高校、科研院所、医院等专业学科设置,加强食品、临床营养、公共卫生、检测、装备等领域相关专业人才的培养。完善特殊医学用途配方食品尤其是特殊医学用途婴儿配方食品相关从业人员培养与评价体系,从行业认定、职称评审等多方面完善临床营养师队伍。食品监管部门不仅要加强对监管人员尤其是基层监管人员专业知识的教育培训,更应通过各种传播途径强化特殊医学用途配方食品的科普宣传,促进生产企业、监管人员、医务工作者、消费者等更准确理解、执行、推荐和使用所需产品。鼓励协会等社会组织以合理合法的形式开展消费者营养健康教育,提高医务工作者和消费者对特殊医学用途配方食品的正确认知,引导大众合理科学使用,保障特殊人群的生命安全。借鉴国外发达国家的做法,将氨基酸代谢障碍等特殊医学状况纳入医保体系,实施政府专门配给。

