肉桂鞣质B-1对脊髓星形胶质细胞增殖的调节作用及对血清氧葡萄糖缺乏/复氧诱导细胞凋亡的保护作用*
崔国峰武军龙 毕郑刚李福春**
(1.哈尔滨医科大学附属第一医院骨科,哈尔滨150001;2.郑州大学附属洛阳市中心医院骨科,河南洛阳471009)
·基础研究·
肉桂鞣质B-1对脊髓星形胶质细胞增殖的调节作用及对血清氧葡萄糖缺乏/复氧诱导细胞凋亡的保护作用*
崔国峰1武军龙2△毕郑刚1李福春1**
(1.哈尔滨医科大学附属第一医院骨科,哈尔滨150001;2.郑州大学附属洛阳市中心医院骨科,河南洛阳471009)
背景:中枢神经系统中星形胶质细胞对神经元起重要的保护作用。据报道,一些抗氧化剂可以保护缺血/再灌注引起的星形胶质细胞功能障碍。肉桂鞣质B-1(Cinnam tannin B-1)是一种天然存在的A型原花青素,具有抗氧化作用。
目的:研究肉桂鞣质B-1对脊髓星形胶质细胞的作用。
方法:星形胶质细胞血清氧葡萄糖缺乏(OGSD)8 h后用或不用肉桂鞣质B-1进行复氧(R)。
结果:肉桂鞣质B-1对OGSD/R诱导的星形胶质细胞凋亡具有保护作用,同时具有促进星形胶质细胞增殖的作用,而细胞外调节蛋白激酶(ERK)抑制剂逆转这种作用。
结论:肉桂鞣质B-1通过ERK信号通路促进星形胶质细胞增殖,保护OGSD/R诱导的细胞凋亡。在中枢神经系统,肉桂鞣质B-1作为一种抗氧化剂对星形胶质细胞缺血/再灌注损伤具有保护作用。
星形胶质细胞;肉桂鞣质B-1;缺血/再灌注;细胞凋亡
Background:ound:Astrocytes are important for protecting neurons in central nervoussystem.Ithas been reported thatsomeantioxidants could protect astrocytes from ischemia-reperfusion-induced dysfunction.Cinnam tannin B-1 is a naturally occurring type-A proanthocyanidin thatexhibitsantioxidantproperties.
Objective:tive:The purposeof the study is to investigate theeffectsof cinnamtannin B-1 on spinal cord astrocytes.
Methods:hods:Astrocyteswere subjected to oxygen-glucose-serum deprivation for eight hours followed by reoxygenation w ith orw ithout cinnam tannin B-1.
Results:ults:Cinnam tannin B-1 protected astrocytes from oxygen-glucose-serum deprivation and reoxygenation-induced apoptosis.Concurrently,cinnam tannin B-1 promoted the proliferation of astrocytesw hereas the extracellular regulated protein kinase(ERK)inhibitor reversed thiseffect.
Conclusions:ions:Cinnamtannin B-1 protectsastrocytes from oxygen-glucose-serum deprivation/reoxygenation-induced apoptosis by promoting astrocyte proliferation via an ERK pathway.Therefore,as an antioxidant,cinnamtannin B-1may provide extra benefit for astrocyte protection during ischem ia-reperfusion in the centralnervous system.
众所周知,中枢神经系统(central nervous system,CNS)中脊髓缺血将导致严重的并发症。在一些脊髓缺血的动物模型中可以观察到严重的功能障碍和残疾,如暂时的传导减慢或永久性的截瘫[1-3]。然而,缺血及随后再灌注损伤所引起的脊髓神经细胞凋亡机制仍不清楚。
星形胶质细胞是哺乳动物CNS的一类神经胶质细胞,是大脑中数量最多的神经细胞。有研究显示,
星形胶质细胞对脊髓损伤有一定的保护作用[4,5]。星形胶质细胞在促进新陈代谢、递质摄取及其他应激时保护神经元。因此,在缺血/再灌注损伤过程中,星形胶质细胞功能障碍将导致神经细胞凋亡[5-7]。研究证实,在缺血/再灌注损伤过程中,线粒体氧化应激可导致细胞病变甚至死亡[8]。作为CNS中最活跃的星形胶质细胞也参与了这一过程。
肉桂是一种香料,可以作为一种有效的抗氧化剂,有利于2型糖尿病和代谢综合症的治疗[9,10]。肉桂中含有大量原花青素,即天然存在的类黄酮[11]。此外,已从肉桂的树皮中初步分离出A型原花青素肉桂鞣质B-1(Cinnam tannin B-1),其由三个单体组成并通过C2→O→7乙醚键和碳键形成的双链连接(图1)。体内外试验研究表明,肉桂鞣质B-1具有很强的抗氧化活性[12,13],对2型糖尿病有积极的治疗作用,而对CNS缺血/再灌注损伤有无保护作用,目前尚无相关报道证实。
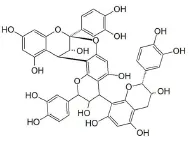
图1 肉桂鞣质B-1的结构
本研究探讨肉桂鞣质B-1对原代培养大鼠脊髓星形胶质细胞在血清氧葡萄糖缺乏/复氧(oxygenglucose-serum deprivation/restoration,OGSD/R)时引起的功能障碍是否有保护作用,及其是否通过有丝分裂原活化蛋白激酶(m itogen-activated protein kinase,MAPK)信号通路以调控细胞增殖,从而保护OGSD诱导的星形胶质细胞凋亡。
1 材料与方法
1.1 试剂
细胞培养试剂,Dulbecco改良的Eagle细胞培养基(Dulbecco'smodified Eagle'smedium,DMEM),胰蛋白酶,胎牛血清(fetalbovine serum,FBS),青霉素和链霉素(美国GIBCO提供)。3.4,5-二甲基吡啶-2-基)-2,5-二苯基四唑溴化物(MTT),PD98059,烟酸己可碱3.42(美国Sigma-A ldrich提供)。肉桂鞣质B-1(表儿茶素-4β→8 2β→O→7)-表儿茶素-(4α→8)-表儿茶素)提取自月桂树(瑞士A lexis提供)(图1)。活性氧(reactive oxygen species,ROS)检测试剂盒(中国碧云天生物技术公司提供)。TUNEL染色试剂盒(美国罗氏公司提供)。EdU染色试剂盒和A lexa Fluor 488-标记的羊抗兔IgG抗体(美国Invitrogen提供)。神经胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)抗体,三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、荧光粉-ERK、Bcl-2和含半胱氨酸的天冬氨酸蛋白水解酶-3抗体(美国圣克鲁斯生物技术公司提供)。过氧化物酶标记的山羊抗兔IgG抗体(美国Jackson Immuno Research提供)。
1.2 细胞培养
采用原代脊髓星形胶质细胞进行培养[14]。使用新生Sprague-Daw ley大鼠(出生后1 d),仔细解剖脊髓,使其与脑脊膜分离。37℃胰蛋白酶(0.25%)分解脊髓5m in,将悬浮液在1500 rpm下离心5m in,去除上清液后用200μm网筛过滤细胞,将细胞接种在含有10%FBS、100 IU/m l青霉素和100μg/m l链霉素的6孔板上,在37℃和5%CO2的条件下培养14 d后进行本研究。去除培养基,PBS液冲洗后进行OGSD。细胞暴露于含有95%N2和5%CO2的缺氧气室,在无血清和葡萄糖的DMEM培养基中培养8 h,然后将培养基从气室中取出,加入葡萄糖和FBS并将细胞置于正常条件下以不同的时间进行复氧[15]。
1.3 MTT MTT法测定生成的ROS ROS
将星形胶质细胞种植于96孔板中(每孔15000个细胞),复氧4 h以上添加MTT试剂(0.5mg/m l),然后加入二甲基亚砜(dimethyl sulfoxide,DMSO)溶解不溶性紫色甲臜产物。通过MK3酶标仪(上海赛默飞世尔科技有限公司提供)测定一定波长(490 nm)的吸光度。通过ROS检测试剂盒检测各组细胞ROS的产生情况。ROS存在时,2’,7’-二氯二氢荧光素二乙酸酯(DCFH-DA)可转换为荧光二氯荧光素(DCF),在488 nm的激发波长及535 nm的发射波长时,通过Flexstation 3检测15000个细胞/孔的DCF荧光分布情况。
1.4 免疫荧光
将原代培养的脊髓星形胶质细胞与星形胶质细胞标记物GFAP进行染色。以每孔500000个细胞种植于6孔玻璃板上,并用4%多聚甲醛过夜固定进行免疫荧光。用磷酸盐缓冲盐水(PBS)冲洗细胞3次,之后用1%牛血清白蛋白(BSA)在室温下阻断15m in。在玻璃板上加入兔抗-GFAP单克隆初级抗体(1:100
稀释)并在4℃下过夜培养。经过多次PBS冲洗后,将细胞用A lexa Fluor 488标记的羊抗兔IgG抗体在室温下黑暗中培养2 h。PBS冲洗后,用烟酸己可碱3.42染色细胞核。在EdU染色中,EdU试剂盒在细胞植入玻璃板前应用。通过显微镜(DP70,日本Olympus公司提供)采集图片。
1.5 TUNEL TUNEL染色
细胞培养在6孔板中的盖玻片上,经处理后,凋亡细胞用TUNEL试剂盒进行染色。凋亡细胞用绿色荧光进行标记,总细胞数用烟酸己可碱3.42染色。
1.6 免疫印迹(Western Blot n Blot)分析
经处理后,细胞用RIPA溶解液进行溶解。应用改良的免疫印迹进行分析[16]。分别稀释初级抗体如下:荧光性ERK(1:1000)、ERK(1:1000)、bcl-2(1: 500)、caspase-3(1:500)、GAPDH(1:5000)。
1.7 统计学处理
采用SPSS18.0进行统计学分析,数据采用均数±标准差表示,进行单因素方差分析,P<0.05有统计学意义。细胞凋亡率按照凋亡细胞除以总细胞数进行计算。
2 结果
2..11原代培养的大鼠脊髓星形胶质细胞
在中枢神经系统内,星形胶质细胞特异性表达GFAP[17]。因此,可鉴定出原代培养的脊髓星形胶质细胞的纯度,在原代培养的细胞中可以用免疫细胞化学显示GFAP阳性的星形胶质细胞。培养14 d后,超过95%的细胞出现GFAP抗体染色阳性和烟酸己可碱3.42(Hoechst3.42)染色阳性(图2)。
2.2 肉桂鞣质B-B-11通过ERK/Bcl-/Bcl-22通路保护OGSD/R GSD/R诱导的星形胶质细胞凋亡
据报道,OGSD/R抑制星形胶质细胞的生存能力[18]。MTT法观察不同组别肉桂鞣质B-1对OGSD/R诱导的星形胶质细胞生存能力的保护作用,与未进行复氧组相比,OGSD 8 h后复氧,星形胶质细胞的生存能力均显著下降,而OGSD 24、48、72 h后复氧的结果之间无明显差异(图3)。与此相反,OGSD/R联合肉桂鞣质B-1处理组的细胞生存能力显著高于单纯OGSD/R处理组(图3)。此外,不同浓度的肉桂鞣质B-1对星形胶质细胞的存活能力或细胞凋亡无影响。
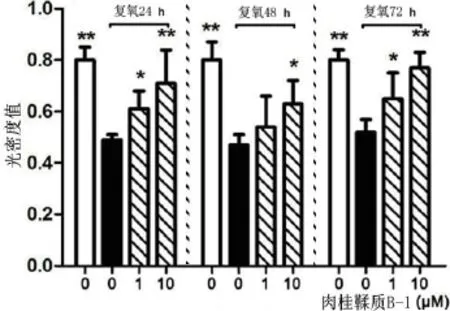
图3 MTT法测定肉桂鞣质B-1对星形胶质细胞生存能力的影响
在OGSD/R过程中产生的ROS导致氧化应激和细胞凋亡[19]。OGSD 8 h/复氧24 h后能够检测到产生的ROS,OGSD/R显著提高细胞内ROS的水平(图4),与单纯OGSD/R处理组相比,10μM肉桂鞣质B-1联合OGSD/R处理组细胞的ROS被显著抑制(图4),即肉桂鞣质B-1减少缺血/再灌注过程中ROS的生成。
由于肉桂鞣质B-1在OGSD时保护星形胶质细胞和减少ROS的产生,使用TUNEL染色法观察肉桂鞣质B-1联合OGSD 8 h/复氧24 h处理组与单纯OGSD 8 h/复氧24 h处理组星形胶质细胞的凋亡率。虽然与单纯OGSD/R处理组相比,联合1μM肉桂鞣质B-1处理组无明显变化,但联合10μM肉桂鞣质B-1处理组在OGSD/R时凋亡细胞的数量减少(图5)。
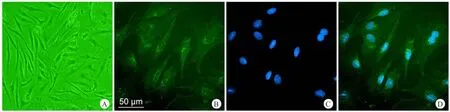
图2 原代星形胶质细胞培养14 d

图4 DCF荧光法测定肉桂鞣质B-1在ROS产生过程中的作用
在细胞凋亡过程中,特别是缺血/再灌注诱导的细胞死亡,线粒体氧化应激起重要作用[19,20]。为了识别在OFSD/R时,肉桂鞣质B-1是否通过减少线粒体凋亡保护星形胶质细胞,需要免疫印迹法分析一些参与线粒体氧化应激诱导细胞凋亡的蛋白质表达水平。如图6所示,细胞经OGSD 8 h/复氧24 h后,p-EPK和Bcl-2的表达减少,caspase-3的表达增加。经肉桂鞣质B-1处理的细胞内p-EPK和Bcl-2的表达高于单纯OGSD/R组。同时,肉桂鞣质B-1以剂量依赖的方式抑制caspase-3的激活。综上所述,肉桂鞣质B-1可能通过增加EPK的磷酸化及Bcl-2的表达来保护原代培养的星形胶质细胞免受OGSD/R诱导的细胞凋亡。
2.3 肉桂鞣质B-B-11通过EPK EPK途径调节脊髓星形胶质细胞的增殖

图6 免疫印迹法分析参与线粒体氧化应激诱导细胞凋亡的蛋白质表达水平
在OGSD/R条件下,经肉桂鞣质B-1处理的细胞内EPK磷酸化水平升高。EPK磷酸化在MAPK通路中起着重要的作用,这与细胞增殖有关[21]。因此,肉桂鞣质B-1可能影响星形胶质细胞的增殖。如图7所示,10μM的肉桂鞣质B-1显著改善星形胶质细胞的增殖。同时,MAPK抑制剂PD98059可逆转这种作用。此外,EdU试剂盒测定星形胶质细胞的增值率。在EdU测定过程中,增殖的细胞核可被标记为荧光探针[22]。根据MTT法的检测结果,10μM的肉桂鞣质B-1刺激星形胶质细胞的增殖。然而,PD98059抑制这种作用。综上所述,肉桂鞣质B-1至少部分通过激活ERK调节脊髓星形胶质细胞的增殖。
3 讨论
肉桂的主要成分原花青素具有抗氧化活性[23]。从肉桂和其他一些植物中分离出的肉桂鞣质B-1是天然存在的原花青素[24]。研究证实,在许多类型细胞中,肉桂鞣质B-1作为一种有效的抗氧化剂,有三个黄烷-3-醇亚单位以及其对抗ROS的保护作用[24-27]。据报道,肉桂鞣质B-1所具有的抗氧化性可用于2型糖尿病的治疗并取得了一定的效果[28]。然而,肉桂鞣质B-1对缺血/再灌注诱导的细胞凋亡的作用尚无相
关研究。本研究发现肉桂鞣质B-1对OGSD/R诱导的原代培养的星形胶质细胞损伤具有保护作用。

图5 TUNEL染色法观察肉桂鞣质B-1对星形胶质细胞凋亡率的影响
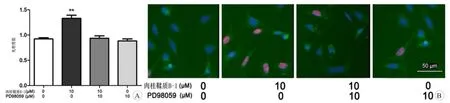
图7 MTT法检测肉桂鞣质B-1对星形胶质细胞增殖的调节作用
氧化应激在细胞死亡过程中起重要作用且参与多种疾病的发生发展,如缺血/再灌注损伤和某些神经退行性病变[8,29]。在这个过程中,生成的ROS导致细胞损伤。线粒体细胞内产生的ROS主要抑制呼吸链的组成部分[30],促进细胞色素C的释放和激活凋亡诱导因子(AIF)[31,32]。脊髓细胞内ROS增加以及ROS介导的细胞凋亡已经被报道[33]。同时我们发现经OGSD/R处理的原代培养星形胶质细胞产生的ROS显著高于未进行复氧组,抗氧化剂和肉桂鞣质B-1减少经OGSD/R处理的原代培养星形胶质细胞产生ROS,因此,肉桂鞣质B-1在保护细胞存活方面可作为一个考虑因素。
研究证实,MAPK通路与细胞增殖和凋亡过程密切相关[34,35]。星形胶质细胞中产生的ROS参与激活ERKA[36]。然而,ROS的不均衡性产生可导致严重的自由基损伤。此外,线粒体膜表面上大量的促凋亡和抗凋亡蛋白也参与这个过程。自由基诱导细胞色素C激活含半胱氨酸的天冬氨酸蛋白水解酶-3导致细胞死亡[37]。同时,抗凋亡蛋白Bcl-2通过抑制氧自由基引起的膜损伤从而防止细胞凋亡[38,39]。本研究确定了OGSD/R处理后,存在/不存在肉桂鞣质B-1时细胞的凋亡率,并且发现肉桂鞣质B-1对OGSD/R诱导的细胞凋亡具有保护作用。减少ROS的产生以及恢复ERK的活性可能也参与其中,导致Bcl-2的表达增加和caspase-3的活性降低。
星形胶质细胞通过激活某些内源性抗氧化剂如谷胱甘肽(GSH)调节ROS,从而维持神经元的存活[40,41]。星形胶质细胞抗氧化功能缺失可导致神经元损伤[42,43]。发生在脊髓的某些疾病如脊髓肌肉萎缩症(SMA)和肌萎缩性脊髓侧索硬化症(ALS)与星形胶质细胞的功能丧失有关[44]。因此,使用外源性抗氧化剂有利于保护中枢神经系统。
本研究发现OGSD/R诱导的细胞凋亡过程中,经肉桂鞣质B-1处理的细胞ERK磷酸化的水平升高。因此推测肉桂鞣质B-1对正常培养的星形胶质细胞有影响。与正常培养的星形胶质细胞相比,10μM肉桂鞣质B-1显著提高细胞的存活率,而ERK磷酸化抑制剂PD98059可逆转这种作用。此外,EdU染色结果显示,肉桂鞣质B-1具有促进星形胶质细胞增殖的作用,而PD98059则阻断这种作用。综上所述,肉桂鞣质B-1通过MAPK通路,至少是通过ERK磷酸化作用于星形胶质细胞。
综上,在OGSD/R诱导的细胞凋亡过程中,肉桂鞣质B-1通过调节ROS的产生保护星形胶质细胞,并且通过MAPK通路促进细胞增殖。肉桂鞣质B-1对缺血/再灌注有关的疾病具有一定的治疗作用。
[1]Erten SF,Kocak A,Ozdem ir I,etal.Protectiveeffectofmelatonin on experimental spinal cord ischem ia.Spinal Cord, 2003,41(10):533-538.
[2]Hirose K,Okajima K,Taoka Y,etal.Activated protein C reduces the ischemia/reperfusion-induced spinal cord injury in rats by inhibiting neutrophilactivation.Ann Surg,2000,232 (2):272-280.
[3]Emmez H,Yildirim Z,Kale A,etal.Anti-apoptotic and neuroprotective effects of alpha-lipoic acid on spinal cord ischemia-reperfusion injury in rabbits.Acta Neurochir,2010, 152(9):1591-1600;discussion:1600-1601.
[4]Faulkner JR,Herrmann JE,Woo MJ,et al.Reactive astrocytes protect tissue and preserve function after spinal cord injury.JNeurosci,2004,24(9):2143-2155.
[5]Ouyang YB,Voloboueva LA,Xu LJ,et al.Selective dysfunction of hippocampal CA1 astrocytes contributes to de-
layed neuronal damage after transient forebrain ischemia.J Neurosci,2007,27(16):4253-4260.
[6]Chen Y,Vartiainen NE,YingW,etal.Astrocytesprotectneurons from nitric oxide toxicity by a glutathione-dependent mechanism.JNeurochem,2001,77(6):1601-1610.
[7]Wang P,Cao X,Nagel DJ,etal.Activation of ASK1 during reperfusion of ischem ic spinal cord.Neurosci Lett,2007, 415(3):248-252.
[8]Halestrap AP,Kerr PM,Javadov S,etal.Elucidating themolecular mechanism of the permeability transition pore and its role in reperfusion injury of the heart.Biochim Biophys Acta,1998,1366(1-2):79-94.
[9]Verspohl EJ,Bauer K,Neddermann E.Antidiabetic effectof Cinnamomum cassia and Cinnamomum zeylanicum in vivo and in vitro.Phytother Res,2005,19(3):203-206.
[10]Khan A,Safdar M,Ali Khan MM,et al.Cinnamon improves glucoseand lipidsof peoplew ith type2 diabetes.Diabetes Care,2003,26(12):3215-3218.
[11]Fine AM.Oligomeric proanthocyanidin complexes:History,structure,and phytopharmaceutical applications.A ltern Med Rev,2000,5(2):144-151.
[12]Ho KY,Huang JS,Tsai CC,et al.Antioxidant activity of tannin components from Vaccinium vitis-idaea L.JPharm Pharmacol,1999,51(9):1075-1078.
[13]Zayachkivska OS,Gzhegotsky MR,Terletska OI,et al.Influence of Viburnum opulus proanthocyanidins on stress-induced gastrointestinalmucosal damage.JPhysiol Pharmacol,2006,57(Suppl5):155-167.
[14]Black JA,Sontheimer H,Waxman SG.Spinal cord astrocytes in vitro:Phenotypic diversity and sodium channel immunoreactivity.G lia,1993,7(4):272-285.
[15]Reichert SA,Kim-Han JS,Dugan LL.Themitochondrial permeability transition pore and nitric oxide synthasemediate early m itochondrial depolarization in astrocytes during oxygen-glucose deprivation.JNeurosci,2001,21(17):6608-6616.
[16]Meng ZX,Nie J,Ling JJ,etal.Activation of liver X receptors inhibits pancreatic islet beta cell proliferation through cellcyclearrest.Diabetologia,2009,52(1):125-135.
[17]Hajos F,Kalman M.Distribution of glial fibrillary acidic protein(GFAP)-immunoreactive astrocytes in the rat brain. II.Mesencephalon,rhombencephalon and spinal cord.Exp Brain Res,1989,78(1):164-173.
[18]DeGracia DJ,M ontie HL.Cerebral ischem ia and the unfolded protein response.JNeurochem,2004,91(1):1-8.
[19]Dugan LL,Kim-Han JS.Astrocytem itochondria in in vitro models of ischem ia.J Bioenerg Biomembr,2004,3.4): 317-321.
[20]Harding HP,Zhang Y,Zeng H,etal.An integrated stress response regulates am ino acid metabolism and resistance to oxidative stress.MolCell,2003,11(3):619-633.
[21]Jiang Z,Zhang Y,Chen X,et al.Activation of Erk1/2 and Akt in astrocytes under ischem ia.Biochem Biophys Res Commun,2002,294(3):726-733.
[22]Diermeier-Daucher S,Clarke ST,Hill D,et al.Cell type specific applicability of 5-ethynyl-2'-deoxyuridine(EdU) for dynam ic proliferation assessment in flow cytometry.Cytometry A,2009,75(6):535-546.
[23]Rafehi H,Ververis K,Karagiannis TC.Controversies surrounding the clinical potential of cinnamon for themanagementof diabetes.DiabetesObesMeTable,2012,14(6):493-499.
[24]Bagchi D,Sen CK,Ray SD,et al.Molecularmechanisms of cardioprotection by a novel grape seed proanthocyanidin extract.MutatRes,2003,523-524:87-97.
[25]Yamakoshi J,Kataoka S,Koga T,et al.Proanthocyanidinrich extract from grape seeds attenuates the development of aortic atherosclerosis in cholesterol-fed rabbits.A therosclerosis,1999,142(1):139-149.
[26]Ben Amor N,Bouaziz A,Romera-Castillo C,etal.Characterization of the intracellularmechanisms involved in the antiaggregant properties of cinnam tannin B-1 from bay wood in human platelets.JMed Chem,2007,50(16):3937-3.4.
[27]Gonzalez A,Santofim ia-Castano P,Rivera-Barreno R,etal. Cinnam tannin B-1,a naturalantioxidant that reduces the effects of H2O2on CCK-8-evoked responses inmouse pancreatic acinar cells.JPhysiol Biochem,2012,68(2):181-191.
[28]Anderson RA,Broadhurst CL,Polansky MM,et al.Isolation and characterization of polyphenol type-A polymers from cinnamon w ith insulin-like biological activity.JAgric Food Chem,2004,52(1):65-70.
[29]Jacobson J,Duchen MR.M itochondrial oxidative stress and cell death in astrocytes--Requirement for stored Ca2+ and sustained opening of the permeability transition pore.J Cell Sci,2002,115(Pt6):1175-1188.
[30]Turrens JF,Boveris A.Generation of superoxide anion by the NADH dehydrogenase of bovine heart m itochondria. Biochem J,1980,191(2):421-427.
[31]Bernardi P,Scorrano L,Colonna R,etal.Mitochondriaand cell death.Mechanistic aspects and methodological issues. Eur JBiochem,1999,264(3):687-701.
[32]Crompton M.The mitochondrial permeability transition pore and its role in cell death.Biochem J,1999,341(Pt 2): 233.49.
[33]Yeo JE,Kim JH,Kang SK.Selenium attenuates ROS-mediated apoptotic cell death of injured spinal cord through prevention of m itochondria dysfunction;in vitro and in vivo study.Cell Physiol Biochem,2008,21(1-3):225-238.
[34]RepiciM,ZanjaniHS,Gautheron V,etal.Specific JNK inhibition by D-JNKI1 protects Purkinje cells from cell death in Lurchermutantmouse.Cerebellum,2008,7(4):534-538.
[35]Chen HS,He X,Qu F,etal.Differential roles of peripheral m itogen-activated protein kinase signal transduction pathways in bee venom-induced nociception and inflammation in conscious rats.JPain,2009,10(2):201-207.
[36]Kim J,Wong PK.Oxidative stress is linked to ERK1/2-p16 signaling-mediated grow th defect in ATM-deficient astrocytes.JBiolChem,2009,284(21):14396-14404.
[37]K luck RM,Bossy-Wetzel E,Green DR,etal.The releaseof cytochrome c from m itochondria:A primary site for Bcl-2 regulation of apoptosis.Science,1997,275(5303):1132-1136.
[38]Itoh N,Tsujimoto Y,Nagata S.Effectof Bcl-2 on Fas antigen-mediated cell death.JImmunol,1993,151(2):621-627.
[39]Reed JC.Double identity for proteins of the Bcl-2 fam ily. Nature,1997,387(6635):773-776.
[40]Desagher S,Glow inski J,Premont J.Astrocytes protectneurons from hydrogen peroxide toxicity.JNeurosci,1996,16 (8):2553-2562.
[41]Jakel RJ,Kern JT,Johnson DA,etal.Induction of the protective antioxidant response element pathway by 6-hydroxydopam ine in vivo and in vitro.Toxicol Sci,2005,87(1):176-186.
[42]Ishii T,Itoh K,Yamamoto M.Roles of Nrf2 in activation of antioxidant enzyme genes via antioxidant responsive elements.Methods Enzymol,2002,348:182-190.
[43]Makar TK,Nedergaard M,Preuss A,etal.Glutam ine transaminase K and omega-amidaseactivities in primary cultures of astrocytes and neurons and in embryonic chick forebrain: Marked induction of brain glutam ine transam inase K at time of hatching.JNeurochem,1994,62(5):1983-1988.
[44]Stewart VC,Heales SJ.Nitric oxide-induced m itochondrial dysfunction:Implications for neurodegeneration.Free Radic BiolMed,2003.4(3):287-303.
Cinnam tannin B-nin B-11 regulates cellproliferation of spinal cord l cord astrocytesand protects the cells from oxygen-glucose-serum deprivation/reoxygenation-induced apoptosis*
CUIGuofeng1,WU Junlong2△,BIZhenggang1,LIFuchun1**
(1.Departmentof Orthopaedics,the FirstAffiliated Hospital,Harbin MedicalUniversity,Harbin 150001;
2.Departmentof Orthopedics,Luoyang CentralHospital,Zhengzhou University,Luoyang 471009,Henan,China)
ords:Astrocytes;Cinnam tannin B-1;Ischem ia-reperfusion;Apoptosis
2095-9958(2015)02-0 071-07
10.3969/j.issn.2095-9958.2015.01-014
黑龙江省卫生计生委科研课题(2014-272);2015哈尔滨医科大学附属第一医院科研基金
**通信作者:李福春,E-mail:lfcmxl@163.com△共同第一作者

