盐胁迫下深色有隔内生真菌D575对樟子松生长及耐盐性的影响
邓 勋,宋小双,尹大川,崔文峰,宋瑞清
(1.黑龙江省森林保护研究所,哈尔滨150040;2.沈阳农业大学林学院,沈阳110000;3.黑龙江省林业科学院,哈尔滨150040;4.东北林业大学林学院,哈尔滨150040)
樟子松(Pinus sylvestris var.mongolica)是我国北方主要造林树种,在生态建设、环境修复方面发挥重要作用[1],我国盐渍土主要分布在华北、东北和滨海地区,造成森林和草原退化。培育耐盐树种或者通过人为引进植物根际有益微生物(包括内生真菌、菌根菌、促生细菌等)与宿主植物的互作实现促进苗木生长、增强苗木抗逆性,并以“菌化苗”形式在后续逆境造林中提高苗木成活率,是实现盐碱地改造、恢复植被和改善生态的有效途径。
深色有隔内生真菌(Dark Septate Endophytes,DSE)是植物内生真菌的主要类群,是植物根部的内生菌[2],从沿海滩涂到内陆高原山地;从热带、温带到冻原地区及南北极地区均有DSE的分布[3]。在针叶树中深色有隔内生真菌种类以子囊菌(Ascomycetes)中 的 Phialocephala fortinii s.l.—Acephala applanata species complex(PAC)类群集合为主[4],在针叶树的根系中占据主导地位[5]。研究表明,DSE真菌可提高植物抗逆性,包括可提高植物对干旱[6]以及重金属污染[7-9]等逆境胁迫的抗性、诱导植物产生系统抗性,抵御病原菌生物胁迫[10-12]等。
D575是分离自樟子松根部的深色有隔内生真菌,在离体试验中[13-14],表现出较强的耐盐性,在 CNaCl≤0.4 mol/Lm 和 C Na2SO4≤0.2 mol/Lm的低中浓度盐胁迫条件下,D575菌丝生长和对碳、磷相对利用率受抑制程度均较低,生长速率同对照相比相差不大,本文在离体研究基础上,测定内生真菌-樟子松共生体在盐胁迫条件下的生长及生理相应,探讨盐胁迫条件下,D575对樟子松生长及耐盐性的影响。
1 材料与方法
1.1 实验材料
实验菌株:深色有隔内生真菌D575分离自樟子松根部,经菌落形态和16S rDNA序列测定初步鉴定为Phialocephala fortinii,属于Phialocephala fortinii s.l.—Acephala applanata species complex(PAC),为典型的针叶树种根部深色有隔内生真菌,保存于黑龙江省林业科学院森林保护研究所。
樟子松种子来源:2014年购自辽宁彰武章古台樟子松苗木繁育基地,由辽宁省防风固沙研究所提供,保存于-20℃冰箱备用。
1.2 樟子松育苗与菌剂制备
(1)无菌制备方法。将草炭土、蛭石和河沙按体积比2∶1∶1的比例配制混合土,置高温高压灭菌器中121℃下灭菌2 h,放置7 d后装入营养钵(直径15 cm×高13 cm)中备用。
(2)种植处理及播种方法。种子处理及播种参考尹大川[15]方法进行,将经催芽的樟子松种子播入营养钵中,每钵30颗种子,上覆2 cm厚无菌土,浇透水后放入大棚中培养,待幼苗出土后,定苗至每钵20株。进行常规的日常管护,每2 d浇一次水(100 ml/钵)。
(3)菌剂制备方法。用直径5 mm的无菌打孔器,切取在PDA平板培养基上培养好的内生真菌D575接种于盛有250 mL PD液体培养基的三角瓶(500 mL)中,每瓶接种3片。置于摇床上(25℃、150 r/min)振荡培养10 d,得到液体菌剂,使用前用搅碎机将菌丝体搅碎做匀浆处理。
1.3 接种及盐胁迫实验设计
(1)接种处理。在播种出苗1个月后,进行深色有隔内生真菌的接种处理,设置2种处理方式:处理1:接种深色有隔内生真菌D575(D575);处理2:PD培养基空白对照(CK)。采用液体菌剂,在苗木根际打孔,接种液体菌剂,每钵接种100 ml菌剂,每组处理25盆,共50盆。
(2)盐胁迫处理设计。参考张峰峰[16]的方法,接种 D575菌剂 1个月后,在 0.1、0.2 mol/Lm NaCl,0.1、0.2 mol/Lm Na2SO4,4 种不同的盐溶度水平下进行盐胁迫实验,以不施盐为对照。每个处理5个重复,共50盆(2个接种处理×5个盐胁迫处理×5个重复)盆苗木。结合浇Hoagland营养液,每次每盆浇溶液200 ml,每天浇一次,共浇5次,使达到预计浓度,置于大棚中培养。
1.4 取样及相关指标测定
在接种3个月后,每处理随机挖取30株樟子松苗木,进行苗木生长指标测定、菌根合成率调查,生理指标测定、抗氧化酶活性测定、抗病害保护酶活性测定。每个处理3次重复。
(1)生长指标。对于苗高和地径测定,采用直尺和游标卡尺分别测量,苗木取样后,用刷子小心清理掉根际泥土,用电子天平测定苗木鲜重后,在鼓风干燥箱中85℃烘干后称量苗木的干重。
(2)内生菌侵染率。将根尖剪成1 cm长根段,用Phillips&Hayman的染色方法[17]对根段染色,计算菌根侵染率。菌根菌侵染率(%)=外生菌根菌侵染的根段数/检查的总根段数×100%,所得结果取平均值。
(3)抗逆生理指标。
可溶性蛋白含量测定采用考马斯亮蓝G250法测定[18]。
叶绿素与类胡萝卜素含量测定采用丙酮-乙醇混合液法测定[19]。
抗氧化酶(SOD酶、POD酶、CAT酶)活性采用南京建成生物工程公司的抗氧化检测试剂盒利用光度计法进行酶活测定[20]。
丙二醛含量采用硫代巴比妥酸法[21]测定。
游离脯氨酸采用酸性茚三酮比色法[22]测定。
1.5 数据处理
所得数据用SPSS 13.0进行单因素差异显著性分析(ANOVA),α=0.05,并以平均值 ±标准差的形式表示。
2 结果与分析
2.1 不同盐分胁迫对樟子松苗木生物量的影响
(1)对苗高的影响。盐胁迫和接种内生真菌处理对樟子松苗高均有显著影响(见表1),同对照相比,在 NaCl(0.1 ~0.2 mol/Lm)和 Na2SO4(0.1 ~0.2 mol/Lm)胁迫下,未接种D575樟子松苗高降低6.57% ~17.31%,其中对照与 NaCl(0.12 mol/Lm)相比,苗高差异不显著(P >0.05),NaCl(0.2 mol/Lm)和 Na2SO4(0.1 ~0.2 mol/Lm)处理,未接种D575樟子松苗高之间差异不显著(P>0.05),说明樟子松对低浓度NaCl胁迫有一定的耐受性,而高浓度NaCl和Na2SO4胁迫对樟子松苗木高成长有显著影响。非盐胁迫条件下,同对照相比,接种D575苗高增加7.49%,二者存在显著性差异(P<0.05),同时接种D575可缓解盐胁迫对樟子松苗木生长的抑制作用,在NaCl(0.1~0.2 mol/Lm)和Na2SO4(0.1~0.2 mol/Lm)胁迫下,同对照相比,苗高增加9.32% ~13.26%,盐胁迫浓度越大,苗高增加越多,说明内生真菌对樟子松促生作用越明显。在接种D575条件下,低浓度盐分胁迫(NaCl 0.1 mol/Lm、Na2SO40.1 mol/Lm)对樟子松苗高影响不显著(P >0.05)。
(2)对地径的影响:同苗高表现相同,不同盐分胁迫和接种内生真菌均对对樟子松苗木地径均有显著影响(见表1),不同处理条件存在显著性差异(P<0.05)。非盐胁迫条件下,接种D575同对照相比,樟子松苗木地径提高7.61%,二者存在显著性差异(P<0.05)。在接种内生真菌D575条件下,不同盐分胁迫处理后,对照相比地径增加6.09% ~10.34%。在接种 D575条件下,低浓度NaCl(0.1 mol/Lm)对樟子松地径影响不显著(P>0.05)。
(3)对生物量的影响:不同盐分胁迫和接种内生真菌对樟子松苗木鲜重和干重均有显著影响(见表1),不同处理之间生物量存在显著性差异(P<0.05)。非盐胁迫条件下,在接种内生真菌D575后,同对照相比,对樟子松苗木鲜重和干重分别提高20.00%和19.81%,可明显促进生物量积累,增加抗逆性。盐胁迫处理后,接种内生真菌D575可促进樟子松苗木鲜重增加7.40% ~14.28%,干重增加5.19% ~16.86%,结果表明,内生真菌的存在可消除部分盐胁迫的影响,增加宿主植物生物量的积累。
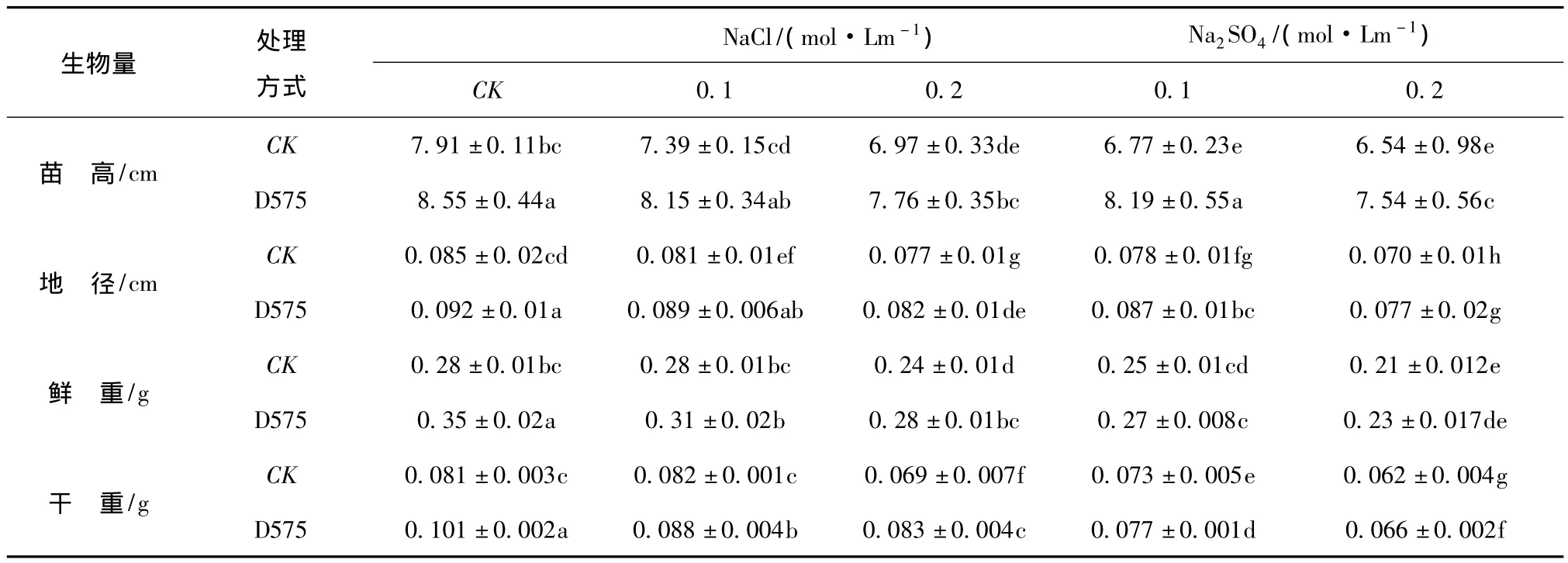
表1 盐胁迫下深色有隔内生真菌D575对樟子松生物量的影响Tab.1 The effect of endophyte fungi D575 on P.sylvestris var.Mongolica biomass under salt tolerance
2.2 不同盐分胁迫对内生菌侵染率的影响
盐胁迫的存下降低内生菌的侵染率(如图1所示),其中低浓度NaCl(0.1 mol/Lm)同对照相比,内生菌侵染率不存在显著性差异(P>0.05),而NaCl(0.2 mol/Lm)和 Na2SO4(0.1 ~0.2 mol/Lm)胁迫下,同对照相比,内生菌侵染率存在显著性差异(P<0.05),结果表明,不同浓度盐分胁迫对内生菌侵染效果的影响不同。
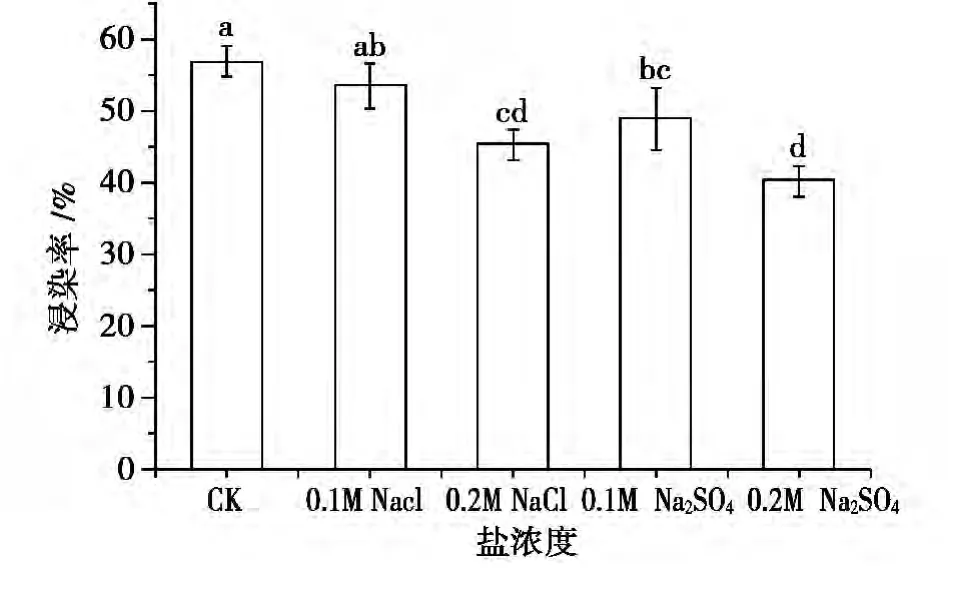
图1 不同盐胁迫对内生菌侵染率的影响Fig.1 The infection rate of endophyte fungi D575 under different salt tolerance
2.3 不同盐分胁迫对樟子松苗木生理指标的影响
(1)对苗木叶绿素和可溶性蛋白的影响。研究结果表明,无论是否接种内生真菌,盐胁迫后宿主植物的叶绿素含量均有所降低(见表2),接种内生真菌后,同对照相比,可提高宿主植物叶绿素含量,从而提高植物的光和效率,生物量增加。非盐胁迫条件下,接种内生真菌对叶绿素a和b分别提高25.59%和36.12%。不同处理之间差异显著(P<0.05)。在 NaCl(0.1 ~ 0.2 mol/Lm)和 Na2SO4(0.1~0.2 mol/Lm)胁迫下,接种内生真菌后,同对照相比,叶绿素a增加28.13% ~32.66%,叶绿素b增加28.36% ~37.19%,盐分胁迫浓度越大,叶绿素增加越多,表明内生真菌对宿主植物的促进作用越高,提高植物耐盐效应越显著。可溶性蛋白含量也是衡量益生菌对植物促生作用的指标,非盐胁迫条件下,同对照相比,宿主植物可溶性蛋白含量提高 21.01%,在 NaCl(0.1 ~0.2 mol/Lm)和 Na2SO4(0.1 ~0.2 mol/Lm)胁迫下,同对照相比,可溶性蛋白含量增加14.55% ~25.43%,接种内生真菌后,NaCl(0.1~0.2 mol/Lm)和Na2SO4(0.1 mol/Lm)胁迫处理,可溶性蛋白含量变化同对照相比,差异不显著(P>0.05),而未接种内生真菌5种处理之间差异均不显著(P>0.05),说明盐胁迫对植物可溶性蛋白含量影响不明显。
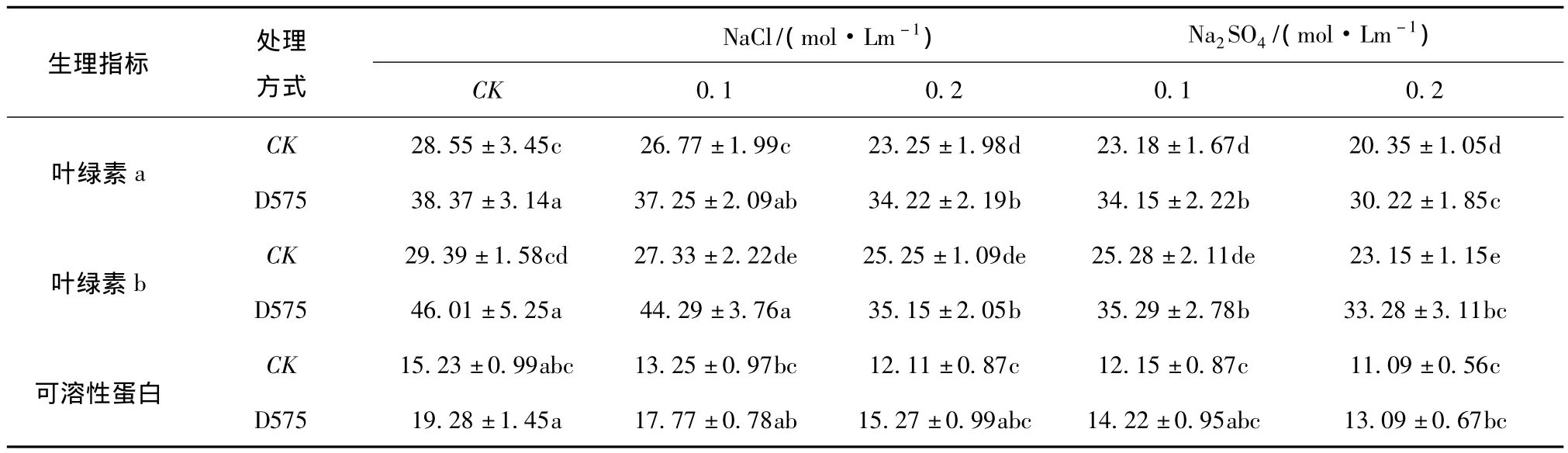
表2 盐胁迫下深色有隔内生真菌D575对樟子松苗木生理指标的影响Tab.2 The effect of endophyte fungi D575 on P.sylvestris var.Mongolica physiological index under salt tolerance
(2)对保护酶活性的影响。植物在非生物胁迫条件下会直接或间接形成过量的活性氧自由基(ROS),对植物细胞膜系统具有破坏作用,逆境条件下,植物体内的保护酶系统能够清除多余的自由基,从而提高植物抗逆性,不受逆境胁迫伤害[23]。超氧化物岐化酶(SOD酶)、过氧化物酶(POD酶)和过氧化氢酶(CAT酶)是植物重要的保护酶,非盐胁迫条件下,接种内生真菌D575后,樟子松苗木SOD酶、POD酶和CAT酶通对照相比分别增加30.08%、54.49%和42.85%,可显著提高植物的抗逆性(见表3)。在盐胁迫条件下,同对照相比,SOD酶活增加29.65% ~35.11%,POD酶活增加50.55%-55.83%,CAT 酶 活 增 加 41.37% ~47.05%。均有大幅度的提高,进一步证明,内生真菌D575的存在,可显著提高植物的抗逆性,有效抵御盐胁迫对植物的伤害。
(3)对丙二醛含量的影响。活性氧代谢是植物对逆境胁迫的初始反应,盐胁迫条件下,植物体内活性氧的积累加剧,导致膜质过氧化产物丙二醛含量迅速增加,而内生真菌可提高宿主植物保护酶系活性,从而清除盐胁迫所产生的超氧自由基和活性氧,减轻逆境对宿主植物的伤害[24]。未接种内生真菌D575条件下,盐胁迫处理后,樟子松丙二醛含量显著增加(见表3),而无论是否有盐胁迫,D575的存在均降低了植物体内的丙二醛含量,在NaCl(0.1 ~0.2 mol/Lm)和 Na2SO4(0.1 ~0.2 mol/Lm)胁迫下,同对照相比,丙二醛含量分别降低13.33% ~17.91%,盐胁迫浓度越高,降低效果越明显,证明内生真菌可降低宿主植物丙二醛含量,降低盐分对植物的伤害。
(4)对脯氨酸含量的影响。植物在逆境下积累脯氨酸具有一定普遍性,脯氨酸可作为渗透调节物、膜和酶的保护物质及自由基清除剂等,而对植物起保护作用[25]。在未接种条件下,非盐胁迫的樟子松脯氨酸含量低于盐胁迫下樟子松的脯氨酸含量,差异显著(P<0.05)(见表3),说明盐分胁迫提高了樟子松脯氨酸含量。无论是否有盐胁迫,接种D575均可降低樟子松体内脯氨酸含量。在NaCl(0.1 ~0.2 mol/Lm)和 Na2SO4(0.1 ~0.2 mol/Lm)胁迫下,同对照相比,丙二醛含量分别降低25.04% ~38.01%。
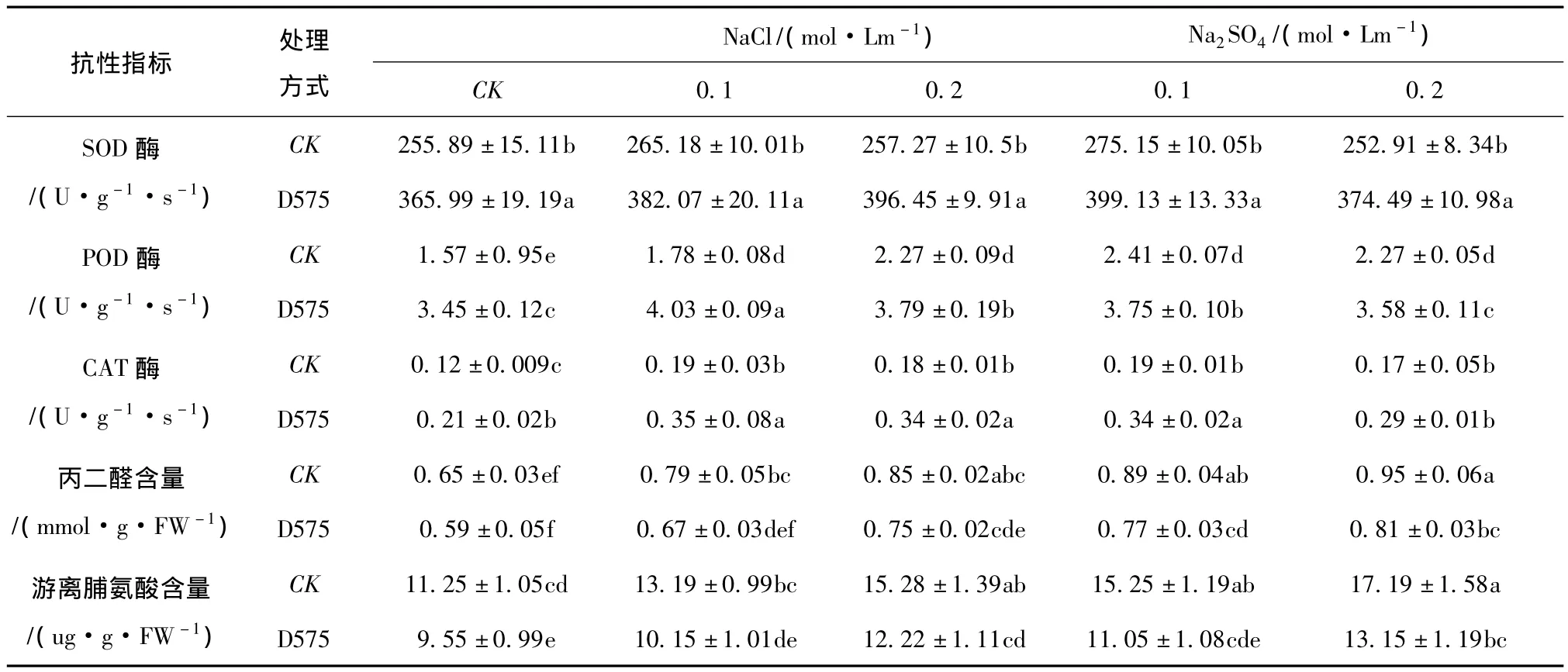
表3 盐胁迫下深色有隔内生真菌D575对樟子松抗逆指标的影响Tab.3 The effect of endophyte fungi D575 on P.sylvestris var.Mongolica stress resistance physiological index under salt tolerance
3 结论与讨论
(1)深色有隔内生真菌D575可侵染樟子松,在与宿主植物互作过程中,通过提高宿主植物叶绿素含量,增强光合作用效率,进而增加苗高、地径和干物质积累。
(2)深色有隔内生真菌D575可提高樟子松苗木耐盐性,与宿主植物互作后提高保护酶(SOD酶、POD酶和CAT酶)活性、同时降低丙二醛和游离脯氨酸含量缓解盐胁迫对宿主植物的伤害。
植物根际益生菌与宿主植物的互作机制是近年研究的热点问题,通过人为引入植物根际益生菌可促进植物生长和养分吸收,提高宿主植物抗逆性,并在生态修复中发挥重要作用。益生菌提高植物耐盐性机制包括:缓解植物细胞中过量活性氧自由基的积累,诱导植物细胞产生糖类和氨基酸等能够调节渗透压的物质缓解植物的渗透压压力,减少由逆境环境所诱导产生的丙二醛等应激化合物产生[26]。如玉米接种丁香假单胞菌(Pseudomonas syringae)、荧光假单胞菌(P.fluorescens)、产肠杆菌(Enter-obacter aerogenes)后,对盐碱环境的耐受性显著提高[27]。菌根菌可显著提高植物耐盐性[28-31],外生菌根菌如 Suillus bovinus、S.luteus[16]、Laccaria bicolor对一定浓度的盐胁迫有较强的耐受性,并且可以显著提高针叶树种的耐盐碱能力,Picea glauca和Pinus banksiana的实生苗在接种L.bicolor后,明显提高了两种针叶树在盐胁迫土壤上的存活率和生长量[32],与对照相比,针叶受到胁迫的伤害明显减少[33]。
深色有隔内生真菌是针叶树重要的根际微生物,针叶树根部深色有隔内生真菌以Phialoceph ala fortinii s.l.—Acephala applanata species complex(PAC)类群集合为主,同菌根菌相比,其对宿主植物的益生作用研究较少,如通过代谢抑菌成分抑制病原菌、筛选低毒菌株控制土壤病原菌等方面证明了其生物防治能力[34-37],但目前还没有其与宿主植物互作提高耐盐性的报道。离体实验证明,深色有隔内生真菌对盐胁迫具有较强的耐受性[13-14],在 CNaCl≤0.4 mol/Lm 和 C Na2SO4≤0.2 mol/Lm的低中浓度盐胁迫条件下,D575菌丝生长和对碳、磷相对利用率受抑制程度均较低,生长速率同对照相比相差不大。通过人工接种实验进一步证明内生真菌D575可提高宿主植物对盐胁迫的耐受性,增加植物生物量积累,如在NaCl和Na2SO4胁迫下,同对照相比,苗高增加9.32% ~13.26%,盐胁迫浓度越大,苗高增加越多,说明内生真菌对樟子松促生作用越明显。此外,接种内生真菌D575后,显著增加植物体内保护酶活性,并降低丙二醛和游离脯氨酸的含量,最大程度降低盐胁迫对植物的伤害。上述实验为进一步田间实验打下基础。
[1]施汉钰,张楠.樟子松根系菌根菌与宿主共生关系的研究[J].森林工程,2014,30(4):39-41.
[2] Jumpponen A,Trappe J M.Dark septate endophytes:A review of facultative biotrophic root-colonizing fungi[J].New Phytologist,1998,140(2):295-310.
[3]刘茂军,张兴涛,赵之伟.深色有隔内生真菌(DSE)研究进展[J].菌物学报,2009,28(06):888-894.
[4] Grunig C,Queloz V,Sieber T,et al.Dark septate endophytes(DSE)of the Phialocephala fortinii s.l.- Acephala applanata species complex in tree roots:classification,population biology,and ecology[J].Botany,2008,86(12):1355-1369.
[5] Zhang C,Yin L,Dai S.Diversity of root-associated fungal endophytes in Rhododendron fortunei in subtropical forests of China[J].Mycorrhiza,2009,19(6):417-423.
[6] Barrow J R.Atypical morphology of dark septate fungal root endophytes of Bouteloua in arid southwestern USA rangelands[J].Mycorrhiza,2003,13(5):239-247.
[7] Ban Y,Tang M,Chen H,et al.The response of dark septate endophytes(DSE)to heavy metals in pure culture[J].PLoS ONE,2012,7(10):e47968.
[8] Zhan F,He Y,Li T,et al.Tolerance and antioxidant response of a dark septate endophyte(DSE),exophiala pisciphila,to cadmium stress[J].Bulletin of Environmental Contamination and Toxicology,2015,94(1):96-102.
[9] Zhao D,Li T,Shen M,et al.Diverse strategies conferring extreme cadmium(Cd)tolerance in the dark septate endophyte(DSE),Exophiala pisciphila:Evidence from RNA-seq data[J].Microbiological Research,2015,170(2):27-35.
[10] Narisawa K,Hambleton S,Currah R S.Heteroconium chaetospira,a dark septate root endophyte allied to the Herpotrichiellaceae(Chaetothyriales)obtained from some forest soil samples in Canada using bait plants[J].Mycoscience,2007,48(5):274-281.
[11] Narisawa K,Usuki F,Hashiba T.Control of verticillium yellows in Chinese cabbage by the dark septate endophytic fungus LtVB3[J].Phytopathology,2004,94(5):412-418.
[12] Narisawa K,Ohki K T,Hashiba T.Suppression of clubroot and verticillium yellows in Chinese cabbage in the field by the root endophytic fungus,Heteroconium chaetospira [J].Plant Pathology,2001,49(1):141-146.
[13]宋小双,邓 勋,遇文婧,等.盐胁迫对深色有隔内生真菌D575和D377生长及营养代谢的影响[J].中国农学通报,2015,31(13):36-42.
[14]邓 勋,宋小双,尹大川,等.盐胁迫对2株深色有隔内生真菌(DSE)生长及营养代谢的影响[J].中南林业科技大学学报,2015,35(5):1-8.
[15] 尹大川,邓 勋,Ilan Chet,等.厚环乳牛肝菌(Suillus grevillei)N40与绿木霉(Trichoderma virens)T43复合接种下樟子松苗木的生理响应[J].生态学杂志,2014,33(8):2142-2147.
[16]张峰峰.甘肃盐碱土植物菌根真菌资源与耐盐性研究[D].杨凌:西北农林科技大学,2007.
[17] Phillips J M,Hayman D S.Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J].Transactions of the British Mycological Society,1970,55(1):118-158.
[18]李 娟,张耀庭,曾 伟,等.应用考马斯亮蓝法测定总蛋白含量[J].中国生物制品学杂志,2000,13(2):118-120.
[19]张宪政.植物叶绿素含量测定——丙酮乙醇混合液法[J].辽宁农业科学,1986(3):26-28.
[20]李冲伟,杨立宾,邓 勋,等.木霉菌株对金黄壳囊孢菌的抑菌效应及机制[J].林业科学,2012,48(9):88-94.
[21]张永峰,殷波.混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J].草业学报,2009,18(1):46-50.
[22]张殿忠,汪沛洪,赵会贤.测定小麦叶片游离脯氨酸含量的方法[J].植物生理学通讯,1990(4):62-65.
[23]李 健,蒋志荣,王继和,等.水分胁迫下四种滨藜属植物保护酶活性的变化[J].甘肃农业大学学报,2006,41(5):76-80.
[24]孙淑萍,邱 靖,万 欣,等.SO2对3种垂直绿化植物丙二醛及保护酶的影响[J].林业科技开发,2010,24(5):50-52.
[25]肖 强,陈 娟,吴飞华,等.外源NO供体硝普钠(SNP)对盐胁迫下水稻幼苗中叶绿素和游离脯氨酸含量以及抗氧化酶的影响[J].作物学报,2008,34(10):1849-1853.
[26] Glick B R.Modulation of plant ethylene levels by the bacterial enzyme ACC deaminase[J].FEMS Microbiology Letters,2005,251(1):1-7.
[27] Barassi C A,Ayrault G,Creus C M,et al.Seed inoculation with Azospirillum mitigates NaCl effects on lettuce[J].Scientia Horticulturae,2006,109(1):8-14.
[28]张峰峰,赵玉洁,谢凤行,等.AM真菌提高植物耐盐性研究进展与展望[J].天津农业科学,2008,14(6):66-70.
[29]贺忠群,贺超兴,张志斌,等.丛枝菌根真菌提高植物耐盐性的作用机制[J].西北植物学报,2007,27(2):414-420.
[30]王桂君,张丽辉,赵骥民,等.盐性条件下的AM真菌以及AM真菌提高植物耐盐性研究[J].长春师范学院学报,2004,23(10):64-68.
[31]冯固,李晓林,张福锁,等.VA菌根提高植物耐盐性研究进展[J].西北农业大学学报,1999,27(3):97-103.
[32] Grégory B,J B F,Annick B,et al.Ectomycorrhizal fungi affect the physiological responses of Picea glauca and Pinus banksiana seedlings exposed to an NaCl gradient.[J].Tree Physiology,2006,26(9):1185-1196.
[33] Calvo-Polanco M,Zwiazek J J,Jones M D,et al.Effects of NaCl on responses of ectomycorrhizal black spruce(Picea mariana),white spruce(Picea glauca)and jack pine(Pinus banksiana)to fluoride[J].Physiologia Plantarum,2009,135(1):51-61.
[34] Hugentobler I,Reininger V,Sieber T N.Control of pathogenic PAC strains by non-pathogenic PAC strains in planta does not correlate with higher competitiveness of non-pathogenic PAC strains ex planta[J].Mycological Progress,2014,13(4):1241-1247.
[35] Tellenbach C,Sumarah M W,Grünig C R,et al.Inhibition of Phytophthora species by secondary metabolites produced by the dark septate endophyte Phialocephala europaea[J].Fungal Ecology,2013,6(1):12-18.
[36] Tellenbach C,Sieber T N.Do colonization by dark septate endophytes and elevated temperature affect pathogenicity of oomycetes?[J].FEMS Microbiology Ecology,2012,82(1):157-168.
[37]宋小双,邓 勋,遇文婧,等.一株生防内生真菌D202对立枯丝核菌的抑制作用及生理学特性研究[J].安徽农业科学,2014,42(27):9274-9275.

