黄玉米籽粒发育过程中类胡萝卜素与色泽的变化
章 园,宋江峰,何美娟,李大婧,3,刘春泉,3,*,陈洁琼
(1.南京农业大学食品科技学院,江苏 南京 210095;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.国家蔬菜加工技术研发分中心,江苏 南京 210014)
黄玉米籽粒发育过程中类胡萝卜素与色泽的变化
章 园1,2,宋江峰2,何美娟1,2,李大婧2,3,刘春泉1,2,3,*,陈洁琼1,2
(1.南京农业大学食品科技学院,江苏 南京 210095;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.国家蔬菜加工技术研发分中心,江苏 南京 210014)
利用C30柱及高效液相色谱-二极管阵列检测-大气压化学电离质谱(high performance liquid chromatography atmospheric-diode array detection-atmospheric pressure chemical ionization-mass spectrometry,HPLC-DAD-APCI-MS)法,对黄玉米在籽粒形成期、乳熟期和蜡熟期主要类胡萝卜素进行定性、定量检测,研究籽粒中类胡萝卜素的积累规律,分析类胡萝卜素各组分与色泽之间的关系。结果表明:整个发育过程中,黄玉米籽粒总类胡萝卜素含量与色泽的变化趋势基本一致,随着成熟度的增加,总类胡萝卜素含量不断增加,籽粒逐渐变黄,其中乳熟期是类胡萝卜素积累的关键时期。各类胡萝卜素组分含量变化较大,花药黄质、玉米黄质、叶黄素、α-隐黄质和β-隐黄质含量总体呈上升趋势,而新黄质含量一直下降,α-胡萝卜素和β-胡萝卜素含量变化不显著。通过对类胡萝卜素含量与色泽的相关性分析发现,玉米黄质、花药黄质、α-隐黄质及β-隐黄质含量均与L*、a*、b*和C值成极显著或显著正相关,与H值成负相关。
黄玉米;类胡萝卜素;发育;色泽
黄玉米(Zea mays L. ssp. mays)是国内外普遍种植的玉米,除了含有丰富的淀粉和脂肪外,还含有多种氨基酸、微量元素和类胡萝卜素,对人体具有重要的医疗保健功效[1]。其中,类胡萝卜素具有良好的VA源活性、抗氧化、防癌、预防夜盲症等活性功能。自然界中,仅植物和微生物可自行合成类胡萝卜素,人类只能通过摄食获取,水果和蔬菜是主要来源[2]。黄玉米中富含类胡萝卜素,其含量大致在0.1~90 mg/kg,主要包括叶黄素(lutein)和玉米黄质(zeaxanthin)等。类胡萝卜素不仅是决定黄玉米外观品质的重要因子,也是衡量黄玉米籽粒内在品质的重要指标[3]。发育过程中果蔬类胡萝卜素组分与含量受内源酶作用的影响存在差异,王伟杰等[4]认为宫内伊予柑在成熟过程中果皮α-胡萝卜素、β-胡萝卜素和叶黄质等含量下降,β-隐黄质及玉米黄质含量上升,果实颜色由绿转黄。熊作明等[5]发现枇杷果实着色期间叶黄素含量下降,α-胡萝卜素、β-胡萝卜素、β-隐黄质和玉米黄素成分均呈上升趋势。李赫等[6]对不同成熟期枸杞中类胡萝卜素变化规律的研究结果表明,随着枸杞成熟度的增加,玉米黄素双棕榈酸酯含量逐渐增加,玉米黄素双棕榈酸酯是枸杞中类胡萝卜素积累的主要形式。崔丽娜等[7]以黄、红、黑、紫4 种不同颜色的玉米籽粒为研究对象,发现不同颜色的玉米色素组成、存在部位均有所不同,其中黄色玉米的色素主要是类胡萝卜素。但目前对黄玉米籽粒在不同发育时期类胡萝卜素各组分动态积累方面的研究很少。因此,本实验拟以‘苏玉29’黄玉米为研究对象,对发育期间类胡萝卜素含量、籽粒色泽的动态变化进行监测,以期明确黄玉米籽粒各类胡萝卜素组分的变化特点,为探索类胡萝卜素的积累和转化规律提供理论依据。
1 材料与方法
1.1 材料与试剂
供试品种‘苏玉29’于2013年5月种植于江苏省农业科学院六合动物科学基地实验田。从黄玉米开花抽丝期结束、籽粒形成第1天开始,每隔2~3 d采样一次,每次选取授粉时间相同、大小均一的玉米10 穗,直至第35天蜡熟期结束,共取样12 次。采摘后立即运至实验室,经液氮研磨成粉后迅速置于-80 ℃超低温冰箱,以备类胡萝卜素萃取使用。
标准品叶黄素、玉米黄质、β-胡萝卜素、β-隐黄质美国Sigma公司;甲基叔丁基醚(methyl tert-butyl ether,MTBE)、甲醇(均为色谱纯) 美国天地公司;正己烷、丙酮、甲苯、无水乙醇、无水硫酸钠、氢氧化钾等为国产分析纯。
1.2 仪器与设备
高效液相色谱仪、6530 Q-TOF精确质量级四极杆-飞行时间质谱仪(大气压化学电离源(atmospheric pressure chemical ionization,APCI)) 美国Agilent公司;WSC-S型色差仪 上海精密科学仪器有限公司;冷冻干燥机 北京博医康实验仪器有限公司;RE52CS旋转蒸发器、B-220恒温水浴锅 上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式真空泵 上海东玺制冷仪器设备有限公司;D10氮气吹扫仪 杭州奥盛仪器有限公司。
1.3 方法
1.3.1 类胡萝卜素提取及含量测定
1.3.1.1 类胡萝卜素提取
准确称取3.0 g冻干玉米粉置于磨口锥形瓶中,加入30 mL正己烷-乙醇-丙酮-甲苯(10∶6∶7∶7,V/V)混合萃取液,静置3~4 h,加入2 mL 40% KOH-甲醇溶液,摇匀后置于暗处25 ℃皂化16 h,将皂化液转入分液漏斗,加30 mL正己烷,振荡摇匀,再加入38 mL 10%硫酸钠溶液,弃去下层液,收集上层溶液。重复处理2 次,混合上层溶液,旋转蒸发,氮气吹干,用2 mL甲醇溶解,待高效液相色谱-二极管阵列检测-质谱(high performance liquid chromatography atmospheric-diode array detectionmasss pectrometry,HPLC-DAD-MS)分析。
1.3.1.2 HPLC-DAD-MS分析条件
HPLC条件:色谱柱为YMC-C30色谱柱(4.6 mm× 250 mm,5 μm),柱温:25 ℃;流动相:A液为水-MTBE-甲醇(5∶25∶70,V/V),B液为水-MTBE-甲醇(5∶85∶10,V/V);流速:0.6 mL/min;进样量:20 μL;检测器:DAD,检测波长450 nm,梯度洗脱条件见表1。

表1 HPLC梯度洗脱条件Table 1 HPLC gradient elution conditions
MS条件:色谱柱流出组分进入质谱仪的流速为10 μL/min;离子源:APCI+;m/z扫描范围:80~1 000;毛细管电压:2 500 V;干燥气体体积:5 L;雾化气压:20 psi;汽化温度:350 ℃;蒸汽温度:400 ℃;电晕电流:4 μA。
1.3.1.3 类胡萝卜素组分定性定量分析方法
对于有标样的组分,对照标样,利用保留时间的一致性进行鉴定,基于外标法构建的回归方程对样品类胡萝卜素各组分含量进行量化分析。对于没有标样的组分,利用DAD在波长200~600 nm范围和质谱的扫描结果对照相关文献资料进行鉴定。
根据文献[8]报道的替换计算方法,对无标品组分进行定量时,叶黄素洗脱前出现的类胡萝卜素组分和叶黄素异构体采用叶黄素标准曲线定量,α-隐黄质及其顺式异构体采用β-隐黄质标准曲线定量,α-胡萝卜素及其顺式异构体采用β-胡萝卜素标准曲线定量。
总类胡萝卜素含量为鉴定的主要类胡萝卜素含量的总和。
1.3.2 黄玉米籽粒色泽测定
采用色差仪CIE Lab表色系统测定黄玉米籽粒粉的L*、a*、b*值,每个样品重复3 次。根据a*、b*值计算H、C值。其中L*为亮度变量,测定值越大则表示样品表面亮度越高。a*为红色或绿色值,正值表示红色,负值表示偏绿色,绝对值越大则说明红色或绿色越深。b*为黄色或蓝色值,正值表示为黄色,负值则表示偏蓝色,绝对值越大说明黄色或蓝色越深。C为色饱和度,C值越大表明颜色越纯,C=[(a*)2+(b*)2]1/2。H为色调角,当a*>0、b*>0时,H=tan-1(b*/a*);当a*<0、b*<0时,H=180+tan-1(b*/a*)。H值从0 °到180 °分别代表颜色为紫红(0 °)、红、橙红、橙、黄(90 °)、黄绿、绿和蓝绿色(180 °)。
1.4 数据统计分析
实验数据利用SAS软件进行单因素方差分析及组间差异的Duncan’s多重比较,相关性分析采用SPSS分析变量间的Pearson相关系数判定。
2 结果与分析
2.1 类胡萝卜素鉴定结果
根据de Rosso[8]、陈鹏飞[9]和Aman[10]等对果蔬中类胡萝卜素鉴定过程的报道,本研究通过HPLC图谱中色谱峰的吸收波长、紫外-可见光谱特性、保留时间和质谱离子碎片特性(质荷比m/z)等指认不同发育阶段黄玉米籽粒中类胡萝卜素组成,如图1所示,共鉴定出8 种主要的类胡萝卜素,包括新黄质、花药黄质、叶黄素、玉米黄质、α-隐黄质、β-隐黄质、α-胡萝卜素和β-胡萝卜素,不同发育阶段各组分含量不同。

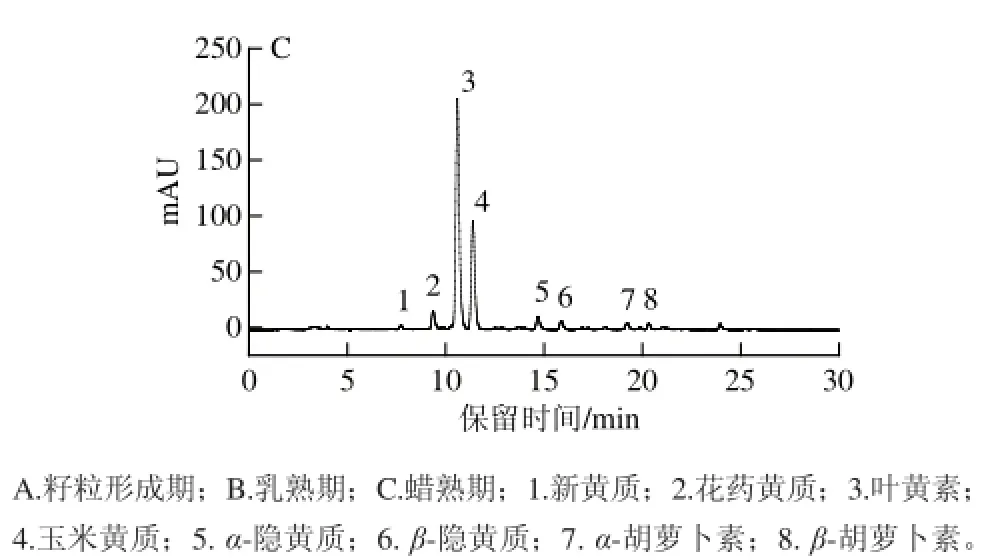
图1 不同发育时期黄玉米籽粒中类胡萝卜素的HPLC图Fig.1 HPLC chromatograms of carotenoids in yellow corn grain at different developmental stages
2.2 不同发育时期类胡萝卜素组成及含量变化
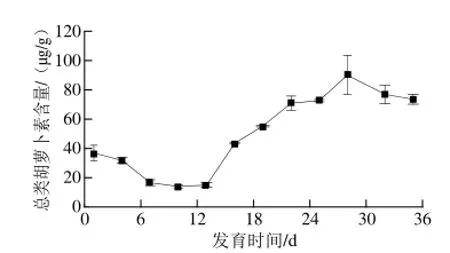
图2 黄玉米发育过程中总类胡萝卜素含量变化Fig.2 Changes in total carotenoid content of yellow corn grain during development
如图2所示,黄玉米籽粒发育过程中第1~14天为籽粒形成期,14~29 d为乳熟期,29~35 d为蜡熟期。籽粒形成初期,总类胡萝卜素含量显著下降(P<0.05),后期下降缓慢,第10天总类胡萝卜素含量仅为13.99 μg/g(以干质量计,下同),比第1天降低了近60%;但进入乳熟期后,总类胡萝卜素含量开始迅速上升,第29天时总类胡萝卜素含量达到最大值90.01 μg/g,至蜡熟期总类胡萝卜素含量有所下降,并维持稳定在75 μg/g左右。由此可知,黄玉米籽粒中类胡萝卜素积累主要在籽粒发育乳熟期至蜡熟期期间,这与番茄[11]、桃[12]等果实发育阶段总类胡萝卜素含量的变化趋势一致。其原因可能是经过灌浆期,黄玉米籽粒中水分含量高达90%,籽粒基本形成,当进入乳熟期,籽粒处于脱水状态,胚乳呈清浆状,水分含量开始下降,类胡萝卜素生物合成反应被激活,其含量快速增加[13-14]。
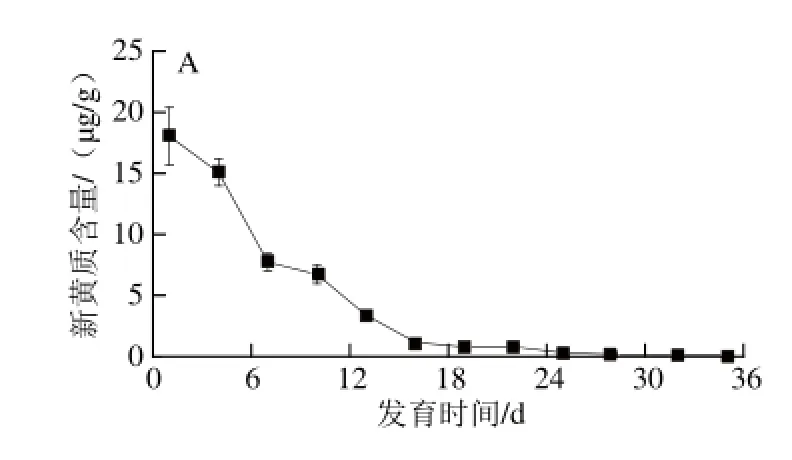
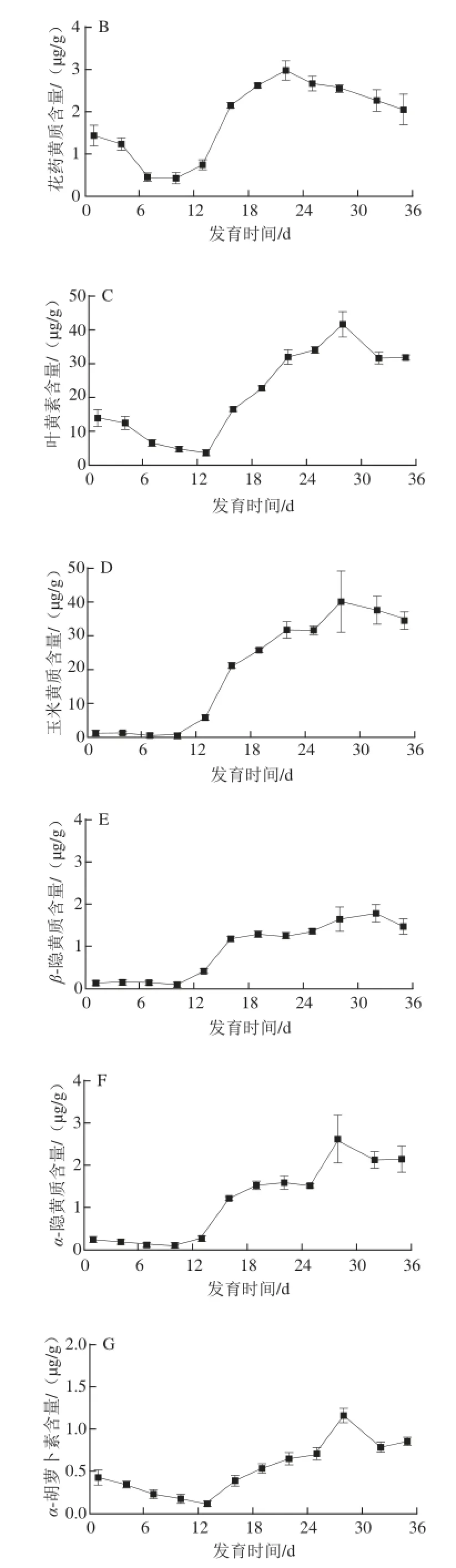
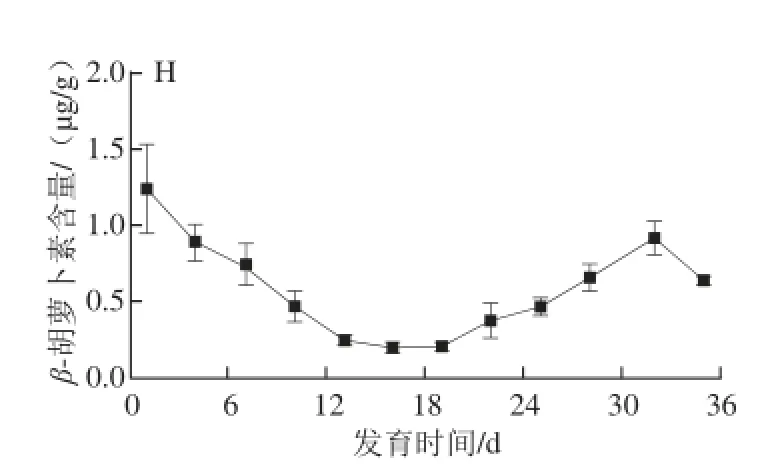
图3 黄玉米籽粒发育过程中主要类胡萝卜素含量变化Fig.3 Changes in the contents of individual carotenoids in yellow corn grain during development
由图3可知,黄玉米籽粒中8 种主要类胡萝卜素在不同发育时期的含量变化存在一定差异。在黄玉米籽粒形成初期,新黄质和叶黄素含量最高,均达10 μg/g以上,但随着籽粒的成熟,新黄质含量不断下降,至蜡熟期几乎检测不出,这可能因为新黄质是类胡萝卜素合成β链的最终产物,随着籽粒发育,使得上游产物花药黄质倾向于合成植物脱落酸(abscisic acid,ABA)[15],合成底物的不足及自身的转化导致含量不断降低;而叶黄素含量仅在籽粒形成期内有所下降,进入乳熟期,其含量迅速上升,最高可达41.61 μg/g,占籽粒中总类胡萝卜素含量的50%左右,蜡熟期基本保持稳定,这与宽皮柑桔果实发育过程中叶黄素含量的变化一致[16]。造成叶黄素在乳熟期大量积累的原因可能与转录水平上的基因表达调控有关。Kang Baoshan等[17]认为转录调控对于有色西瓜中类胡萝卜素的积累起到重要作用。在黄色西瓜成熟的过程中,LCYB酶基因高水平转录,从而使得叶黄素大量积累,而番茄红素则被大量分解。
玉米黄质与叶黄素有相似的变化趋势,在蜡熟期其含量升至39.59 μg/g,值得注意的是,蜡熟期玉米黄质含量是籽粒形成期的近30 倍,是玉米籽粒发育过程中含量变化最大的类胡萝卜素,其在乳熟期含量急剧增加可能是由玉米黄质所在类胡萝卜素合成β链的合成酶基因大量表达所致。Kato等[18]研究发现,在柑橘果实成熟的过程中,LYCB酶基因表达增强,LYCE酶基因表达消失,导致玉米黄质大量积累。因此,本研究推测玉米黄质对黄玉米籽粒在生长发育过程中类胡萝卜素的积累起关键作用。
花药黄质是玉米黄质的下游产物,与玉米黄质有相似的变化趋势,在乳熟期其含量达到最大值2.96 μg/g;α-隐黄质和β-隐黄质蜡熟期含量均在2.00 μg/g左右;α-胡萝卜素和β-胡萝卜素在黄玉米籽粒发育过程中最大含量均仅在1.00 μg/g左右,这与李小丽[19]、Ruiz[20]等发现β-胡萝卜素是影响类胡萝卜素积累总量和果实色泽主要因素的结果不同,这可能与不同植物体内细胞β-胡萝卜素的合成部位以及酶基因表达有关[21],也可能由于籽粒生长发育过程中新陈代谢旺盛,含氧活性基团较多,更易生成含氧类胡萝卜素[22]。相比而言,花药黄质、α-胡萝卜素、β-胡萝卜素、α-隐黄质和β-隐黄质对黄玉米籽粒发育过程中类胡萝卜素积累的影响较小。
2.3 黄玉米籽粒色泽的变化
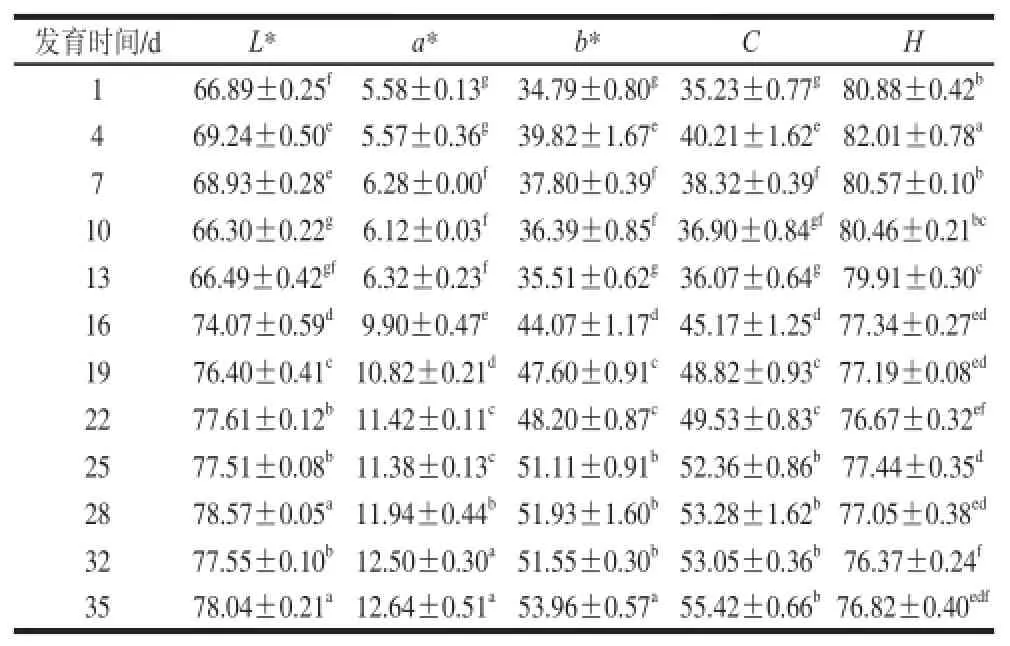
表2 黄玉米籽粒发育过程中色泽指标变化Table 2 Changes in color parameters of yellow corn grain during developpmmeenntt
由表2可知,L*、a*、b*和C值均有相似的变化趋势,在籽粒形成期内基本保持稳定,进入乳熟期急剧上升,直至蜡熟后期又保持稳定,说明随着黄玉米成熟度的增加,籽粒的色泽逐渐变黄,与黄玉米发育中总类胡萝卜素含量的变化规律基本一致,这与高飞飞[23]、戴雄泽[24]等对荔枝、辣椒的研究结果类似。H值总体上呈降低趋势,说明随着黄玉米成熟度的增加,籽粒色泽从黄色逐渐向橙红色转变。

表3 类胡萝卜素各组分含量与籽粒发育过程中色泽的相关性Table 3 Correlation analysis between color parameters and individual carotenoid contents during grain development
各类胡萝卜素组分含量与色泽的相关性分析见表3,玉米黄质、花药黄质、α-隐黄质及β-隐黄质含量均与L*、a*、b*和C值成极显著或显著正相关,与H值成负相关或显著负相关;叶黄素含量与b*、C值成极显著正相关,与L*值成显著正相关;α-胡萝卜素含量与b*、C值成显著正相关;β-胡萝卜素及新黄质含量与色泽参数间无显著相关性。在黄玉米籽粒后期发育过程中,玉米黄质和叶黄素含量急剧升高,显著高于其他类胡萝卜素(P<0.01),可能是影响黄玉米籽粒色泽形成的主要因素,这与颜少宾[12]对桃颜色差异的研究结果一致,新黄质和β-胡萝卜素含量对色泽的影响较小,而在菠萝[25]、枸杞[6]和枇杷[5]等果实中β-胡萝卜素是影响其果皮色泽的主要因素,原因可能与黄玉米籽粒发育过程中β-胡萝卜素的含量较低有关。
3 结 论
整个发育过程中,黄玉米籽粒总类胡萝卜素含量与籽粒色泽的变化趋势基本一致,乳熟期不仅是类胡萝卜素积累的关键时期,也是籽粒颜色变黄的主要时期。各类胡萝卜素组分在籽粒发育过程中的变化差异较大,在籽粒形成期,新黄质含量最高,随着黄玉米籽粒成熟度的增加,新黄质含量不断下降,而其他鉴定的7 种类胡萝卜素含量均呈上升趋势,至乳熟期,玉米黄质和叶黄素含量占籽粒中总类胡萝卜素含量近80%。通过类胡萝卜素含量与籽粒色泽的相关性分析表明,玉米黄质含量与L*、a*、b*值均成极显著正相关,花药黄质、α-隐黄质和β-隐黄质含量均与L*、a*值成极显著正相关,对黄玉米籽粒色泽影响最大。
[1] 刘晓涛. 玉米的营养成分及其保健作用[J]. 中国食物与营养, 2009, 15(3): 60-61.
[2] KHOO H E, PRASAD K N, KONG K W, et al. Carotenoids and their isomers: color pigments in fruits and vegetables[J]. Molecules, 2011, 16(2): 1710-1738.
[3] FARRÉ G, SANAHUJA G, NAQVI S, et al. Travel advice on the road to carotenoids in plants[J]. Plant Science, 2010, 179(1): 28-48.
[4] 王伟杰, 徐建国, 徐昌杰. 宫内伊予柑果实发育期间色泽和色素的变化[J]. 园艺学报, 2006, 33(3): 461-465.
[5] 熊作明, 周春华, 陶俊. 不同类型枇杷果实着色期间果肉类胡萝卜素含量的变化[J]. 中国农业科学, 2007, 40(12): 2910-2914.
[6] 李赫, 陈敏, 马文平, 等. 不同成熟期枸杞中类胡萝卜素含量的变化规律[J]. 中国农业科学, 2006, 39(3): 599-605.
[7] 崔丽娜, 高荣岐, 孙爱清, 等. 不同基因型玉米籽粒类胡萝卜素与花色苷色素积累规律[J]. 作物学报, 2010, 36(5): 818-825.
[8] de ROSSO V V, MERCADANTE A Z. Identification and quantification of carotenoids, by HPLC-PDA-MS/MS from Amazonian fruits[J]. Journal of Agricultural and Food Chemistry, 2007, 55(13): 5062-5072.
[9] 陈鹏飞, 刘栓桃, 张志刚, 等. 大白菜的类胡萝卜素种类鉴定[J]. 中国农学通报, 2011, 27(19): 137-143.
[10] AMAN R, BIEHL J, CARLE R, et al. Application of HPLC coupled with DAD APcI-MS and NMR to the analysis of lutein and zeaxanthin stereoisomers in thermally processed vegetables[J]. Food Chemistry, 2005, 92(4): 753-763.
[11] 李京, 惠伯棣, 裴凌鹏. 番茄果实在成熟过程中类胡萝卜素含量的变化[J]. 中国食品学报, 2006, 6(2): 122-125.
[12] 颜少宾. 桃果实发育阶段类胡萝卜素的变化分析[D]. 南京: 南京农业大学, 2012.
[13] BOUDRIES H, KEFALAS P, HOMERO-MÉNDEZ D. Carotenoid composition of Algerian date varieties (Phoenix dactylifera) atdifferent edible maturation stages[J]. Food Chemistry, 2007, 101(4): 1372-1377.
[14] ROCA M, MÍNGUEZ-MOSQUERA M I. Carotenoid levels during the period of growth and ripening in fruits of different olive varieties (Hojiblanca, Picual and Arbequina)[J]. Journal of Plant Physiology, 2003, 160(5): 451-459.
[15] 杨秋玲, 季静, 王罡, 等. 类胡萝卜素合成途径终产物脱落酸的合成调控与生物学效应[J]. 天津农业科学, 2011, 17(5): 24-27.
[16] 王伟杰. 柑桔果实色泽与类胡萝卜素积累的关系研究[D]. 杭州: 浙江大学, 2006.
[17] KANG Baoshan, ZHAO Wenen, HOU Yaobing, et al. Expression of carotenogenic genes during the development and ripening of watermelon fruit[J]. Scientia Horticulturae, 2010, 124(3): 368-375.
[18] KATO M, IKOMA Y, MATSUMOTO H, et al. Accumulation of carotenoids and expression of carotenoid biosynthetic genes during maturation in citrus fruit[J]. Plant Physiology, 2004, 134(2): 824-837.
[19] 李小丽, 梁远学, 郜凌超, 等. 油棕果实不同发育时期类胡萝卜素的含量变化[J]. 华中农业大学学报, 2015, 34(1): 23-27.
[20] RUIZ D, EGEA J, TOMÁS-BARBERÁN F A, et al. Carotenoids from new apricot (Prunus armeniaca L.) varieties and their relationship with fl esh and skin color[J]. Journal of Agricultural and Food Chemistry, 2005, 53(16): 6368-6374.
[21] 于洋, 翁倩, 周宝利. 番茄果实成熟过程中不同部位类胡萝卜素和糖含量变化及其相关性[J]. 沈阳农业大学学报, 2012, 42(6): 683-687.
[22] ANDERSSON S C, RUMPUNEN K, JOHANSSON E, et al. Carotenoid content and composition in rose hips (Rosa spp.) during ripening, determination of suitable maturity marker and implications for health promoting food products[J]. Food Chemistry, 2011, 128(3): 689-696.
[23] 高飞飞, 尹金华, 陈大成, 等. 荔枝果皮叶绿素、类胡萝卜素、花色苷的形成规律及对果色的影响[J]. 华南农业大学学报, 2000, 21(1): 16-18.
[24] 戴雄泽, 王利群, 陈文超, 等. 辣椒果实发育过程中果色与类胡萝卜素的变化[J]. 中国农业科学, 2009, 42(11): 4004-4011.
[25] 杨祥燕, 蔡元保, 孙光明. 菠萝果肉颜色的形成与类胡萝卜素组分变化的关系[J]. 果树学报, 2010, 27(1): 135-139.
Changes in Carotenoid Content and Color of Yellow Corn Grain during Development
ZHANG Yuan1,2, SONG Jiangfeng2, HE Meijuan1,2, LI Dajing2,3, LIU Chunquan1,2,3,*, CHEN Jieqiong1,2
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. Institute of Farm Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 3. National Research and Development Center for Vegetable Processing, Nanjing 210014, China)
Changes in color and carotenoid content of yellow corn grain during grain fi lling, milky and dough stages were investigated by high performance liquid chromatography atmospheric-diode array detection-atmospheric pressure chemical ionization-mass spectrometry HPLC-DAD-APCI-MS with a C30column. The accumulation pattern of caroteniods and the relationship between carotenoid content and color were also discussed. The results showed that consistent trends of total carotenoid content and color were observed for yellow corn grain during the whole developmental process. As the maturation proceeded, the total carotenoid content constantly increased, and corn grain gradually turned yellow; the milky stage was the critical period of carotenoid accum ulation. The changes in individual carotenoid content were different during the whole developmental process. The contents of antheraxanthin, zeaxanthin, lutein, α-cryptoxanthin and β-cryptoxanthin had an upward trend, while the content of neoxanthin tended to decline as the developmental stage progressed although α-carotene and β-caotene had no significant change. Correlation analysis between carotenoid content and color indicated highly signifi cantly or signifi cantly positive relationships between the contents of antheraxanthin, zeaxanthin, lutein, α-cryptoxanthin and β-cryptoxanthin and L*, a*, b* and C color values, whereas these carotenoids were negatively related to H value.
yellow corn; carotenoids; development; color
TS255.2
A
1002-6630(2015)19-0077-06
10.7506/spkx1002-6630-201519014
2014-12-28
江苏省农业科技自主创新资金项目(CX(14)2055)
章园(1991-),女,硕士研究生,研究方向为农产品加工与贮藏。E-mail:2013108087@njau.edu.cn
*通信作者:刘春泉(1959-),男,研究员,硕士,研究方向为农产品精深加工及产业化开发。E-mail:liuchunquan2009@163.com

