β-Bi2O3修饰Bi2WO6光催化降解苯酚及其可能机理
李晓金 盛珈怡 陈海航 许宜铭(浙江大学化学系,硅材料国家重点实验室,杭州310027)
β-Bi2O3修饰Bi2WO6光催化降解苯酚及其可能机理
李晓金 盛珈怡 陈海航 许宜铭*
(浙江大学化学系,硅材料国家重点实验室,杭州310027)
采用简单混合法制备了一系列Bi2O3/Bi2WO6复合光催化剂.在紫外光降解水中苯酚的过程中,Bi2O3/ Bi2WO6的光催化活性随Bi2O3含量的增加呈现先增大后减小的趋势.当Bi2O3最佳负载量等于12.5%(质量分数,w)时,该复合光催化剂的活性大约是单一Bi2WO6的4倍.固体样品表征表明,Bi2O3主要以β-Bi2O3存在,复合光催化剂是Bi2O3和Bi2WO6的简单混合物.此外,在电催化氧化水的过程中,β-Bi2O3/Bi2WO6薄膜电极的光电流远大于β-Bi2O3和Bi2WO6薄膜电极的光电流之和.Bi2O3对Bi2WO6光催化的促进作用是由于前者接受后者的光生空穴,提高Bi2WO6光生载流子的分离效率,从而加快了O2的还原和苯酚的降解.
氧化铋;钨酸铋;光催化;电荷转移;有机物降解
1 引言
半导体光催化降解有机物被认为是治理环境污染的重要方法之一.一直以来,TiO2因其高效、廉价和稳定等优点而被广泛研究.1-3然而,TiO2的禁带宽度较宽,只能吸收紫外光.为此,人们不断寻求一种高效的可见光催化剂.例如,Bi2WO6是一种良好的可见光光催化活性,能吸收波长小于440 nm的太阳光,引发许多有机物的降解.4-7但是,Bi2WO6的光催化活性较低.这主要是由于光生载流子的分离效率低,并由于O2多电子还原较慢的缘故.6,8,9已有文献报道,采用Bi2O3修饰Bi2WO6,能够显著提高光催化降解有机物的效率.10-16许多作者认为,这是因为Bi2O3向Bi2WO6导带注入电子,Bi2WO6向Bi2O3价带注入空穴,从而提高了光生载流子的分离效率.但是,这些报道没有测定这二种半导体的电化学数据.再者,以有机染料为模拟分子,以β-Bi2O3/Bi2WO6与α-Bi2O3和Bi2WO6比较,也存在不当之处.众所周知,有机染料既能通过半导体光催化降解,也能通过光敏化过程降解.17最近,Jiao等18报道,α-和β-Bi2O3都属于n型半导体,它们在pH=0的水溶液中的平带电位分别等于0.19和0.50 V(vs NHE(标准氢电极)).根据Bi2WO6的平带电位(0.20 V(vs NHE)8),Bi2O3既可以向Bi2WO6导带注入电子,也可以从Bi2WO6导带得到电子.因此,Bi2O3对Bi2WO6光催化的影响及其机理还需要进一步佐证.
©Editorial office ofActa Physico-Chimica Sinica
本文采用简单混合法,将商品Bi2O3与煅烧过的Bi2WO6混合,制备了一系列Bi2O3/Bi2WO6复合光催化剂.这种方法将不会改变Bi2O3和Bi2WO6的基本物理参数.再者,本文以无色的苯酚作为模拟分子避免了光敏化的影响.因此,实验观察到的Bi2O3影响一定归结于它对Bi2WO6光催化过程的影响.催化剂采用X射线衍射(XRD)、N2吸附-脱附等温线和紫外-可见(UV-Vis)漫反射等方法表征.此外,本文还通过电化学方法,研究了Bi2O3对Bi2WO6光电催化氧化H2O的影响,并提出了可能的反应机理.
2 实验部分
2.1 试 剂
Na2WO4·2H2O购于国药集团化学试剂有限公司,Bi(NO3)3·5H2O和Bi2O3购于阿拉丁试剂公司,苯酚购于上海化学试剂集团公司,HNO3购于浙江中星化学试剂有限公司,色谱纯甲醇购于淮安市恒天工贸有限公司.除甲醇为外,其他试剂均为分析纯.实验用水为Mill-Q超纯水.
Bi2WO6样品通过水热法进行合成.4,5将1.26 g Na2WO4·2H2O和3.64 g Bi(NO3)3·5H2O分别溶于40 mL H2O和0.4 mol·L-1HNO3.然后,将Na2WO4· 2H2O溶液逐滴加入到Bi(NO3)3·5H2O溶液中,生成白色的前驱体悬浊液.继续搅拌30 min,超声30 min.将该悬浊液转移到150 mL聚氟乙烯管中,并加入H2O使反应液体积达到聚氟乙烯管容积的80%.在160°C下反应20 h以后,冷却,过滤,水洗,烘干.最后,样品在空气氛围和350°C下煅烧3 h.
Bi2O3/Bi2WO6样品通过以下方法合成:适量Bi2WO6与40 mL H2O混合,分别搅拌和超声30 min.然后,向该悬浮液加入所需比例的商品Bi2O3,再分别搅拌和超声30 min.该混合液置于80°C烘箱中烘干,所得样品再用玛瑙研钵研磨.
2.2 主要仪器
X射线粉末衍射谱图由D/max-2550/PC (Rigaku,日本)衍射仪测定,Cu Kα为X射线源,工作电压为40 kV,工作电流为300 mA.根据最强衍射峰和Scherrer公式,计算晶粒尺寸.UV-Vis吸收光谱在Shimadzu UV-2550光度计上测定,以BaSO4为参比物,并采用文献方法计算样品的禁带宽度.10氮气吸附-脱附等温线在ASAP2020(麦克,美国)分析仪上测定,温度77 K.
2.3 光催化实验和分析
光催化反应在Pyrex夹层反应器中进行,反应器内径为2.9 cm,高为9.1 cm.实验光源为300 W高压汞灯(亚明,上海),其到达反应器的光强为3.2 mW·cm-2(光强计,北京师范大学制).通过循环水,维持反应器温度为25°C.在50 mL反应液中,催化剂浓度为1.3 g·L-1,苯酚浓度为0.21 mmol·L-1.光照前,避光搅拌60 min.光照后,每隔一段时间,移取2.0 mL反应液,经0.22 μm滤膜过滤.通过Dionex P680高效液相色谱仪,定量分析滤液中有机物浓度.色谱柱为Apollo C18反相色谱柱,流动相为体积比为1:1的甲醇和水混合液,并含0.1%(体积分数)的乙酸.
2.4 电化学实验
采用Doctor-Blade方法,制备以下三种薄膜电极:(1)将4.85 g Bi(NO3)3·5H2O溶于18 mL的2 mol· L-1硝酸溶液中,制备β-Bi2O3胶体.19加入1.92 g柠檬酸(CA)和1 g聚乙烯醇(PEG2000),搅拌6 h.然后,在导电玻璃上,制备β-Bi2O3薄膜.(2)将1 g Bi2WO6粉末与330 μL H2O混合,研磨均匀.加入1 mL含有0.5 g PEG20000的水溶液,继续研磨.再在导电玻璃上制备Bi2WO6薄膜.最后,以上二种电极再经400°C煅烧3 h,去除有机物.(3)在β-Bi2O3膜上,滴加50 μL的1 g·L-1Bi2WO6悬浮液.80°C烘干,200°C煅烧20 min,最后制得β-Bi2O3/Bi2WO6薄膜电极.
电化学工作站为CHI660 E(上海辰华),Pt电极为对电极,饱和甘汞电极(SCE)为参比电极,0.5 mol· L-1NaClO4溶液为电解质溶液(pH=6.98),并以N2排除溶解O2.扫描速率为10 mV·s-1,光源为500 W高压氙灯(畅拓,北京),波长大于320 nm,光强为10 mW·cm-2.通过E(vs NHE)=E(vs SCE)+0.24 V,本文电位数据均被换算成标准氢电极电位.
3 结果与讨论
3.1 样品表征
图1(A)为固体样品的XRD谱图.本文合成得到的Bi2WO6在2θ=28.2°,32.8°,47.2°,55.9°,58.6°处出现衍射峰,这与正交晶型Bi2WO6的标准图谱(PDF No.39-0256)一致.本文制得的Bi2O3薄膜在2θ= 28.0°,30.4°,31.7°,32.8°,46.3°,47.1°,54.2°,55.7°, 57.9°处出现衍射峰,这与β-Bi2O3的标准图谱(PDF No.27-0050)一致(注:在2θ=35.2°处出现的衍射峰归属于ITO导电玻璃).商品Bi2O3主要在2θ=28.1°, 31.9°,32.8°,46.3°,47.0°,54.4°,55.6°,57.9°处出现衍射峰,对应于β-Bi2O3.此外,商品Bi2O3还在2θ= 27.0°,27.4°,33.4°处出现微弱的衍射峰,改组衍射峰与α-Bi2O3的标准图谱(PDF No.65-2366)一致.根据XRD衍射峰的相对强度,可以判断商品Bi2O3主要是β-Bi2O3.当商品Bi2O3与Bi2WO6混合以后,Bi2O3和Bi2WO6的特征峰衍射强度随Bi2O3含量的增加而分别上升和下降.这是因为晶体的衍射峰强度一般与它在混合物中的含量呈正比.当Bi2O3含量为12.5% (w)时,在2θ=27.4°,30.4°处分别出现α-Bi2O3(120)和β-Bi2O3(211)晶面的特征峰.通过Scherrer公式计算, Bi2WO6晶粒的尺寸大约等于16 nm,且几乎不受Bi2O3含量的影响(表1).此外,根据N2吸附-脱附等温线,Bi2WO6的比表面积和孔体积都远大于商品Bi2O3.但是,当Bi2O3含量较低时,Bi2O3/Bi2WO6的比表面积则明显小于理论计算值.由于Bi2O3的比表面积只有0.32 m2·g-1,这可能说明Bi2WO6的表面或孔道被Bi2O3小颗粒占据,从而导致比表面下降.
图1(B)为固体样品的紫外-可见漫反射吸收光谱图.在200到450 nm的范围内,纯Bi2WO6具有较强的吸收,其带边约为450 nm.该吸收带归结于O 2p和Bi 6s杂化轨道到W 5d轨道跃迁.7商品Bi2O3为深黄色粉末,比Bi2WO6具有更宽的吸收区域,能吸收波长小于580 nm的可见光.通过微分计算法, Bi2WO6和Bi2O3的禁带宽度分别等于2.87和2.51 eV.前者与文献10-14报道基本一致,后者则分别大于和接近α-Bi2O3(2.6-2.8 eV)和β-Bi2O3(2.48 eV)的禁带宽度).12,13,18光谱分析进一步表明:商品Bi2O3主要是β-Bi2O3.当Bi2WO6与Bi2O3混合以后,吸收光谱随Bi2O3含量的增加而逐渐红移.显然,这是由于混合物中Bi2O3的吸收特征造成的.以上固体分析表明, Bi2O3/Bi2WO6是Bi2O3和Bi2WO6的简单混合物,本文所用温和制备方法没有显著改变它们的晶粒大小、比表面积和光吸收等基本物理参数.

图1 样品的XRD(A)和UV-Vis漫反射光谱图(B)Fig.1 X-ray diffraction(XRD)patterns(A)and UV-Vis diffuse reflection spectra(B)of the samples

表1 固体样品的物理参数Table 1 Physical parameters of solid samples
3.2 苯酚的光催化降解
在可见光作用下(波长大于400 nm),Bi2WO6能够引发水溶液中无色苯酚的氧化或降解,但反应较慢.8为了研究的方便,图2(A)表示在波长大于320 nm的光作用下,苯酚在水溶液中的浓度随反应时间的变化关系.可以看出,Bi2O3/Bi2WO6的活性明显高于Bi2WO6.对照实验表明,苯酚不仅难以吸附在催化剂表面(<5%),而且自身光解很慢.因此,观察到的苯酚浓度下降一定是由于半导体光催化反应引起的.再者,苯酚的浓度与时间的变化曲线满足一级动力学过程.由于光强和催化剂浓度保持恒定,这表明Bi2WO6和Bi2O3/Bi2WO6不仅能够光催化还原O2,而且也具有较高的稳定性.11,14图2(B)表示经一级动力学方程拟合后的苯酚氧化表观速率常数.随着Bi2O3含量的增加,Bi2O3/Bi2WO6的光催化活性呈现先增加后下降的趋势.前者表明,Bi2O3对Bi2WO6光催化降解苯酚确实具有促进作用.后者可能归结于Bi2WO6主体光催化剂的浓度下降.当Bi2O3的最佳混合比等于12.5%时,Bi2O3/Bi2WO6的光催化活性大约是Bi2WO6的4倍.由于这些混合光催化剂具有不同的比表面积(Asp,表1),我们又以Asp归一化苯酚降解的表观速率常数(kobs),结果列于图2(B).可以看到,kobs/Asp随Bi2O3浓度的变化趋势与kobs几乎一致.也就是说,Bi2O3/Bi2WO6光催化活性的提高并不是比表面积变化造成的.9,20,21
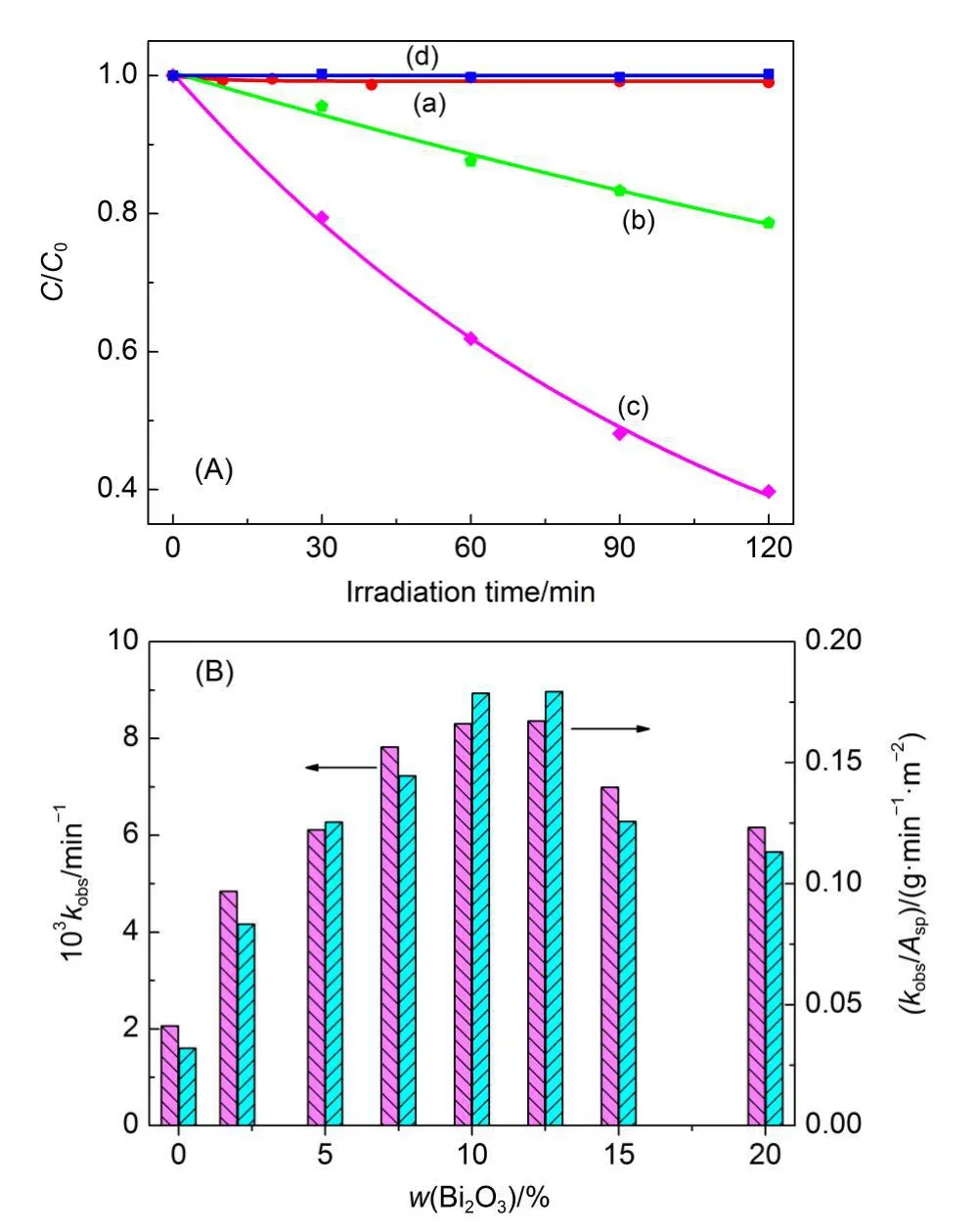
图2 (A)紫外光光照下苯酚的降解曲线;(B)苯酚降解的表观速率常数(kobs)和归一化速率常数(kobs/Asp)Fig.2(A)Time profiles of phenol degradation under UV light;(B)apparent rate constant(kobs)and normalized rate constants(kobs/Asp)of phenol degradation

图3 在N2下测定电极的暗态(虚线)和光照(实线)线性扫描伏安曲线Fig.3 Linear sweep voltammetry curves of electrodes obtained in the dark(dot line)and UV light (solid line)under N2atmosphere
3.3 光电化学实验
为了排除有机物在催化剂表面的弱吸附可能带来的影响,我们采用光电化学方法,直接测定光生空穴氧化H2O而产生的光电流.因商品Bi2O3主要是β-Bi2O3,我们单独制备了β-Bi2O3薄膜电极,再表面沉积Bi2WO6而得到β-Bi2O3/Bi2WO6薄膜电极.图3表示在除氧的NaClO4电解质溶液中,β-Bi2O3、Bi2WO6和β-Bi2O3/Bi2WO6薄膜电极的线性扫描伏安曲线.在暗态条件下,这些电极产生的电流很小,并且随外加电压(0.2-1.2 V(vs NHE))的变化不很明显.这是因为外加电压小于O2/H2O电对的标准电极电势(1.23 V (vs NHE))与O2析出过电位之和.但是,在波长大于320 nm的紫外光照射下,三种薄膜电极均能产生光电电流.在相同的偏压条件下,光电流的大小顺序为β-Bi2O3/Bi2WO6>β-Bi2O3>>Bi2WO6.由于体系不含有机物,观察到的光电流一定来源于水氧化.该实验证实,β-Bi2O3与Bi2WO6之间确实存在相互作用.在pH 0的水溶液中,Bi2WO6和β-Bi2O3电极的平带电位分别等于0.25和0.51 V(vs NHE).8,18对于n型半导体,导带边的电位与平带电位数值相近.8,22-25根据禁带宽度的数据,计算出Bi2WO6和β-Bi2O3的价带电位分别等于3.12和3.02 V(vs NHE).从热力学上来看,它们的价带空穴都能氧化水,从而产生光电流.由于Bi2WO6的价带电位比β-Bi2O3正0.10 V,它的价带空穴可以转移到β-Bi2O3,10,12-16从而提高光生载流子的分离效率,进一步加快O2的还原和H2O或苯酚的氧化.另一方面,Bi2WO6的导带边电位比β-Bi2O3负0.26 V,它的导带电子也有可能转移到β-Bi2O3.但是,Bi2WO6和β-Bi2O3的导带边电位差较大,不利于它们的前线轨道发生重叠.因此,相比于空穴转移,这种电子转移较慢或不易发生.再者,如果同时发生空穴和电子转移,则相当于Bi2WO6受光激发而产生的一对空穴和电子又在β-Bi2O3表面重新复合,这应该导致Bi2WO6的光催化活性下降.显然,这与事实不符.苯酚和水被氧化的实验均表明,Bi2O3对Bi2WO6光催化反应确实具有促进作用.因此,我们认为,这种促进作用是由于Bi2O3接受Bi2WO6的光生空穴,从而降低了与光生电子之间的复合,同时提高了光生空穴和电子的利用率(示意图1).

示意图1 Bi2O3/Bi2WO6光催化活性提高的可能机理Scheme 1 Possible mechanism of the enhanced photocatalytic activity of Bi2O3/Bi2WO6
4 结论
利用苯酚作为降解底物,考查了Bi2O3修饰对Bi2WO6光催化活性的影响.Bi2WO6的光催化活性随着Bi2O3修饰量的增加而呈现先上升后下降的趋势, Bi2O3的最佳修饰量为12.5%(w).通过光电化学实验,证明Bi2WO6的光生空穴可以转移至Bi2O3,从而抑制了Bi2WO6光生载流子的复合.该复合光催化剂制备简单,或许对于有机废水的处理具有一定的应用价值.
(1)Hoffmann,M.R.;Martin,S.T.;Choi,W.Y.;Bahnemann,D.W. Chem.Rev.1995,95,69.doi:10.1021/cr00033a004
(2)Carp,O.;Huisman,C.L.;Reller,A.Prog.Solid State Chem.2004,32,33.doi:10.1016/j.progsolidstchem.2004.08.001
(3)Tachikawa,T.;Fujitsuka,M.;Majima,T.J.Phys.Chem.C2007,111,5259.
(4)Amano,F.;Nogami,K.;Abe,R.;Ohtani,B.J.Phys.Chem.C2008,112,9320.doi:10.1021/jp801861r
(5)Zhang,L.S.;Wang,W.Z.;Chen,Z.G.;Zhou,L.;Xu,H.L.; Zhu,W.J.Mater.Chem.2007,17,2526.doi:10.1039/b616460a
(6)Sun,S.M.;Wang,W.Z.;Zhang,L.J.Phys.Chem.C2012,116, 19413.doi:10.1021/jp306332x
(7)Fu,H.B.;Pan,C.S.;Yao,W.Q.;Zhu,Y.F.J.Phys.Chem.B2005,109,22432.doi:10.1021/jp052995j
(8)Sheng,J.Y.;Li,X.J.;Xu,Y.M.ACS Catal.2014,4,732.doi: 10.1021/cs400927w
(9)Sheng,J.Y.;Li,X.J.;Xu,Y.M.Acta Phys.-Chim.Sin.2014,30,508.[盛珈怡,李晓金,许宜铭.物理化学学报,2014,30, 508.]doi:10.3866/PKU.WHXB201312302
(10)Ge,M.;Li,Y.F.;Liu,L.;Zhou,Z.;Chen,W.J.Phys.Chem.C2011,115,5220.doi:10.1021/jp108414e
(11)Gui,M.S.;Zhang,W.D.J.Phys Chem.Solids2012,73, 1342.doi:10.1016/j.jpcs.2012.06.009
(12)Li,X.N.;Huang,R.K.;Hu,Y.H.;Chen,Y.J.;Liu,W.J.;Yuan, R.S.;Li,Z.H.Inorg.Chem.2012,51,6245.doi:10.1021/ ic300454q
(13)Wang,H.L.;Li,S.J.;Zhang,L.S.;Chen,Z.G.;Hu,J.Q.;Zou, R.J.;Xu,K.B.;Song,G.S.;Zhao,H.H.;Yang,J.M.;Liu,J.S. CrystEngComm2013,15,9011.doi:10.1039/c3ce41447g
(14)Li,Z.Q.;Chen,X.T.;Xue,Z.L.J.Colloid Interface Sci.2013,394,69.doi:10.1016/j.jcis.2012.12.002
(15)Gui,M.S.;Zhang,W.D.;Su,Q.X.;Chen,C.H.J.Solid State Chem.2011,184,1977.doi:10.1016/j.jssc.2011.05.057
(16)Gui,M.S.;Zhang,W.D.Nanotechnology2011,22,265601. doi:10.1088/0957-4484/22/26/265601
(17)Saison,T.;Chemin,N.;Chaneac,C.;Durupthy,O.;Ruaux,V.; Mariey,L.;Mauge,F.;Beaunier,P.;Jolivet,J.P.J.Phys.Chem. C2011,115,5657.doi:10.1021/jp109134z
(18)Hou,J.G.;Yang,C.;Wang,Z.;Zhou,W.;Jiao,S.Q.;Zhu,H. M.Appl.Catal.B2013,142-143,504.
(19)Timonah,N.S.;Yang,C.H.;Yu,Y.;Niu,Y.H.;Sun,L.Curr. Appl.Phys.2010,10,1372.doi:10.1016/j.cap.2010.04.006
(20)Sun,Q.;Xu,Y.M.J.Phys.Chem.C2010,114,18911.doi: 10.1021/jp104762h
(21)Cong,S.;Xu,Y.M.J.Phys.Chem.C2011,115,21161.doi: 10.1021/jp2055206
(22)Chen,H.H.;Leng,W.H.;Xu,Y.M.J.Phys.Chem.C2014,118,9982.doi:10.1021/jp502616h
(23)Leng,W.H.;Zhang,Z.;Zhang,J.Q.;Cao,C,N.J.Phys.Chem. B2005,109,15008.doi:10.1021/jp051821z
(24)Cheng,X.F.;Leng,W.H.;Liu,D.P.;Xu,Y.M.;Zhang,J.Q.; Cao,C.N.J.Phys.Chem.C2008,112,8725.doi:10.1021/ jp7097476
(25)Fei,H.;Leng,W.H.;Li,X.;Cheng,X.F.;Xu,Y.M.;Zhang,J. Q.;Cao,C.N.Environ.Sci.Technol.2011,45,4532.doi: 10.1021/es200574h
Improved Photocatalytic Degradation of Phenol over β-Bi2O3Modified Bi2WO6and Possible Mechanism
LI Xiao-Jin SHENG Jia-Yi CHEN Hai-Hang XU Yi-Ming*
(State Key Laboaratory of Silicon,Departement of Chemistry,Zhejiang University,Hangzhou 310027,P.R.China)
In this study,a series of Bi2O3-containing Bi2WO6catalysts were prepared by a simple mixing method.We used the oxidation of phenol in water under UV light as a model reaction,and found that as the amount of Bi2O3in the mixture increased,its photocatalytic activity increased,and then started to decrease.A maximum activity was observed with the catalyst containing 12.5%(mass fraction,w)of Bi2O3,about 4 times that of Bi2WO6.Solid characterization revealed that the composite was a mixture of β-Bi2O3and Bi2WO6.The water oxidation photocurrent over the β-Bi2O3/Bi2WO6thin film electrode was much larger than the sum of the photocurrents of the β-Bi2O3and Bi2WO6thin film electrodes.It is proposed that there is a valence hole transfer from Bi2WO6to β-Bi2O3,which improves the charge separation efficiency,and consequently increases the rate of phenol degradation.
Bismuth oxide;Bismuth tungstate;Photocatalysis;Charge transfer; Organic degradation
O643
10.3866/PKU.WHXB201501131www.whxb.pku.edu.cn
Received:October 30,2014;Revised:January 12,2015;Published on Web:January 13,2015.
∗Corresponding author.Email:xuym@zju.edu.cn;Tel:+86-571-87952410.
The project was supported by the National Natural Science Foundation of China(21377110)and National Key Basic Research Program of China (973)(2011CB936003).
国家自然科学基金(21377110)和国家重点基础研究发展规划项目(973)(2011CB936003)资助

