猪源马链球菌兽疫亚种类M蛋白原核表达及其小鼠免疫保护力分析
猪源马链球菌兽疫亚种类M蛋白原核表达及其小鼠免疫保护力分析
周俊明,何孔旺,倪艳秀,祝昊丹,俞正玉,茅爱华,吕立新,温立斌,张雪寒,王小敏,汪伟,李彬,郭容利
(江苏省农业科学院兽医研究所,农业部兽用生物制品工程技术重点实验室,国家兽用生物制品工程技术研究中心,江苏南京210014)

摘要:为了原核表达猪源马链球菌兽疫亚种去除信号肽的类M蛋白质,并分析该蛋白质对小鼠的免疫保护力,克隆了马链球菌兽疫亚种CY菌株去除信号肽的类M蛋白质基因Szp,并将Szp基因插入pET28a表达载体,IPTG诱导,获得重组类M蛋白质,弗氏佐剂乳化重组类M蛋白质后,3次免疫小鼠,用同源菌株CY攻击。诱导获得分子量约5.8×10`4的重组蛋白质,免疫印迹结果表明该重组类M蛋白质能够被马链球菌兽疫亚种猪多抗识别。类M蛋白质免疫小鼠的存活率为60%,弗氏佐剂乳化灭活CY免疫小鼠的存活率为70%,PBS对照组小鼠攻毒后6 d内全部死亡。表达的类M蛋白质可以给予ICR小鼠部分的免疫保护力,保护效果略低于CY全菌灭活苗,提示可以对马链球菌兽疫亚种多种免疫保护性抗原进行联合,从而进一步提高对动物的免疫保护力。
关键词:马链球菌兽疫亚种;类M蛋白质;原核表达;疫苗
doi:10.3969/j.issn.1000-4440.2015.03.020
收稿日期:2014-10-08
基金项目:公益性行业(农业)科研专项经费项目(201303041);江苏省自主创新探索性研究项目
作者简介:周俊明(1983-),男,江苏东台人,硕士,助理研究员,主要研究方向为动物传染病防治。(Tel)025-84390988;(E-mail)zhoujm075@163.com
中图分类号:S858.282.61`+1
文献标识码:A
文章编号:1000-4440(2015)03-0590-05
Abstract:An open reading frame encoding M-like protein from strain CY of Streptococcus equi subsp. zooepidemicus of porcine origin without signal sequence was amplified by PCR using chromosomal DNA of CY as template. Amplicon was inserted into plasmid pET28a and transformed into Escherichia coli BL21 (DE3). A His-tag fusion protein SzP was then induced with IPTG. Mice were immunized three times with SzP and challenged by the homologous strain CY. The fusion protein SzP with molecular weight about 5.8×10`4 showed the specific immunoreactivity with pig antiserum against strain CY. Six SzP-vaccinated mice survied out of 10 tested mice, and the figure was 7 for whole cell bacterin-vaccinated mice. Meanwhile, the control mice vaccinated with PBS all died 6 days post-infection. It is indicated that the fusion protein SzP delivered certain protection against Streptococcus equi subsp. zooepidemicus.
Prokaryotic expression of M-like protein fromStreptococcusequisubsp.zooepidemicusof porcine origin and its immunoprotection in mice
ZHOU Jun-ming,HE Kong-wang,NI Yan-xiu,ZHU Hao-dan,YU Zheng-yu,MAO Ai-hua,LÜ Li-xin,WEN Li-bin,ZHANG Xue-han,WANG Xiao-min,WANG Wei,LI Bin,GUO Rong-li
(InstituteofVeterinaryMedicine,JiangsuAcademyofAgriculturalSciences/KeyLaboratoryofVeterinaryBiologicalEngineeringandTechnology,MinistryofAgriculture/NationalCenterforEngineeringResearchofVeterinaryBio-products,Nanjing210014,China)
Key words:Streptococcusequisubsp.zooepidemicus;M-like protein;prokaryotic expression;vaccine
马链球菌兽疫亚种(Streptococcusequisubsp.zooepidemicus,S.zooepidemicus,Sz)是革兰氏阳性菌,属于链球菌兰氏分群C群,可感染多种宿主,包括马、牛、猪、家禽、羊、狗,偶尔也有感染人的病例出现[1-3]。在中国该菌是一种重要的猪病原菌,能引起猪链球菌病,临床表现有败血症、脑膜炎、心内膜炎和关节炎。1975年四川省暴发了猪链球菌病,病原即Sz,大量猪发病死亡,导致严重的经济损失。刘佩红等对上海地区1998年至1999年发病猪体内分离的15株猪链球菌进行鉴定,发现仍以C群链球菌为主,并且发现所分离的链球菌对多种抗生素产生了较强的耐药性,因此可以采取免疫手段控制该菌引起的猪链球菌病。
目前国内已有多种C群链球菌灭活疫苗和弱毒苗,但是效果不佳,所以亟需研制出安全、有效的替代疫苗。Hofman等利用马链球菌马亚种的类M蛋白质,成功地控制了马腺疫。A群链球菌的M蛋白质可有效地刺激机体产生免疫应答。Moore等报道Sz表面有一种耐酸、耐热的蛋白质,类似于A群链球菌的M蛋白质,故称该蛋白质为类M蛋白质(SzP)。Timoney等首次克隆表达马源SzW60菌株的SzP,发现用表达该蛋白质的大肠杆菌裂解物免疫小鼠,能够提供小鼠部分抵抗W60菌株攻击的能力;并且在后期研究中,对去除信号肽的SzP进行了原核表达及纯化,发现纯化的SzP对ICR小鼠的免疫保护力为90%[10]。范红结等[11]研究发现,国内分离的8株猪源Sz类M蛋白质基因的核苷酸同源性为95.4%~99.9%,与马源W60株、人源25064株的同源性分别为84.8%~87.0%和89.0%~91.8%,提示猪源Sz的SzP,可能有别于马源Sz。本试验通过pET28a载体,表达猪源马链球菌兽疫亚种CY菌株去除信号肽的SzP,选择小鼠为研究对象,旨在评估猪源Sz的SzP亚单位疫苗,为SzP亚单位疫苗的进一步研制奠定基础。
1材料与方法
1.1 材料
马链球菌兽疫亚种菌株CY(分离自发生败血症的病猪体内)、pET-28a表达质粒、Sz猪抗血清等均由本实验室保存;THB培养基,购于美国BD公司;BamHⅠ酶、XhoⅠ酶、T4 DNA连接酶、Ex-TaqDNA聚合酶,购自大连宝生物工程有限公司;DNA凝胶回收试剂盒、AxyPrepTMPlasmid Miniprep kit,购自AXYGen公司;BL21感受态细胞、Trans5α感受态细胞,购自北京全式金生物技术有限公司;HRP标记的羊抗猪IgG、HRP标记的羊抗鼠IgG、DAB显色液,购自武汉博士德生物工程有限公司;TMB购自Amersco公司;ELISA板购自Costar公司;Protino Ni-TED 2 000 packed columns,购自MACHEREY-NAGEL公司。
1.2 SzP编码基因的扩增
用THB培养基培养菌株CY,利用煮沸法提取其模板,参照GenBank登录的马链球菌兽疫亚种CY类M蛋白质编码基因Szp序列AY26599,设计1对扩增Szp基因112~1 152 bp区域的引物(P1:5′-AAGGATCCGATTCTGTTGAGTCAGCTAA-3′;P2:5′-CCTCTCGAGTTAGTTTTCTTTGCGTCTT-3′),并分别在两端添加BamH Ⅰ 和XhoⅠ 酶的酶切位点(引物中下划线部分),交由上海立菲生物技术公司进行合成。利用合成的上下游引物对Szp基因进行PCR扩增,PCR产物经过琼脂糖凝胶电泳鉴定,用DNA凝胶回收试剂盒回收Szp片段。
1.3 pET28a- Szp重组质粒的构建与鉴定
将回收的Szp片段和pET28a质粒,分别用BamHⅠ、XhoⅠ双酶切;在T4 DNA连接酶作用下,将双酶切后的Szp片段和pET28a于4 ℃连接16 h,再转化进入感受态BL21;将转化的BL21细菌平铺于含卡那霉素(30 μg/ml)的LB平板,37 ℃培养过夜。挑取平板上的菌落,接种于含卡那霉素(30 μg/ml)的LB液体培养基中,37 ℃培养过夜,提取重组细菌的质粒进行BamHⅠ、XhoⅠ双酶切鉴定,获得重组质粒pET28a-Szp,送至上海立菲生物技术公司进行测序鉴定。
1.4 阳性重组菌的诱导表达
利用含有卡那霉素的LB液体培养基,体外培养转化有pET28a-Szp的重组菌,振荡培养(220 r/min),至OD600值达到0.4~0.6时,加入终浓度1 mmol/L的IPTG诱导表达3 h。
1.5 SzP重组蛋白质的纯化
收集诱导后的菌液,离心获取菌体沉淀,参照Protino Ni-TED蛋白质纯化手册,进行重组蛋白质的纯化。利用RC DC Protein Assay试剂盒(美国BioRad公司产品),测定纯化蛋白质浓度。
1.6 SzP融合表达蛋白质的Western-blot分析
参照文献[12],将pET28a-Szp阳性重组菌诱导前、后的菌液分别进行离心,PBS重悬菌体后,沸水浴10 min,离心取上清;联合纯化的SzP重组蛋白质,共3份样品,进行SDS-PAGE,转印到PVDF膜上,1%脱脂奶封闭PVDF膜;将Sz猪阳性血清稀释1 000倍作为一抗, HRP标记的羊抗猪IgG稀释5 000倍作为二抗,DAB显色,双蒸水终止反应。
1.7 重组蛋白质免疫小鼠保护力分析
30只清洁级6周龄ICR雌性小鼠(购自扬州大学比较医学中心)随机分为3组,每组10只,依次皮下注射SzP重组蛋白质、CY全菌灭活苗和PBS,其中SzP亚单位疫苗用量为每只40 μg,CY全菌灭活苗用量为每只108CFU。首免时对免疫物添加弗氏完全佐剂乳化,随后进行2次免疫弗氏不完全佐剂乳化的免疫物,免疫间隔14 d。末次免疫后14 d,用CY菌株腹腔注射小鼠,接种剂量为5×107CFU。攻毒后连续观察10 d。
2结果
2.1 马链球菌兽疫亚种类M蛋白质基因的扩增
PCR产物经电泳后,显示1条1 000 bp左右的条带(图1),大小与预期一致。
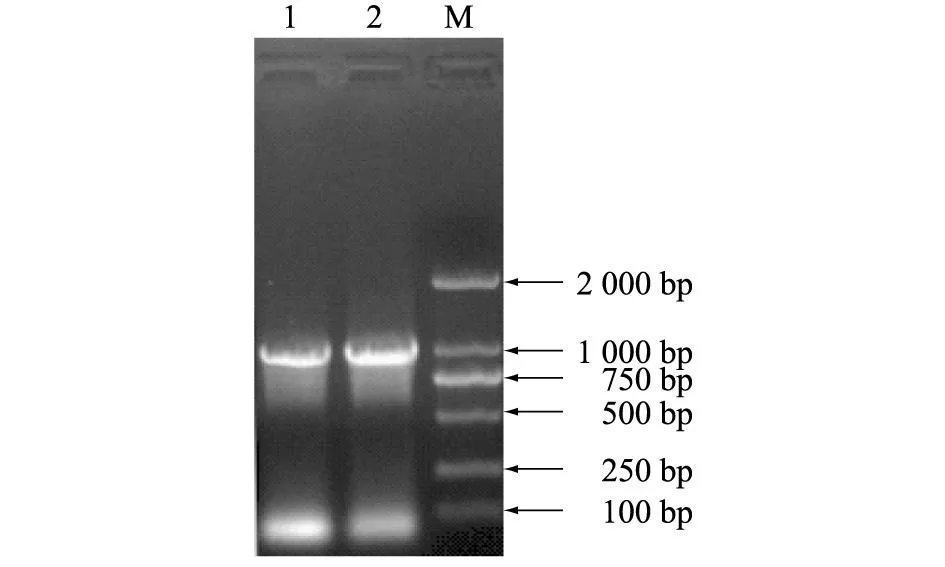
1、2:Szp的PCR扩增片段;M:DL-2 000 marker。 图1 Szp基因的PCR扩增 Fig.1 The PCR amplification of Szp gene
2.2 pET28a- Szp重组质粒的构建与鉴定
构建的pET28a-Szp重组质粒经过BamHⅠ、XhoⅠ双酶切,得到约5 000 bp及1 000 bp左右的条带(图2),表明扩增的Szp基因片段已经插入到pET28a质粒中。
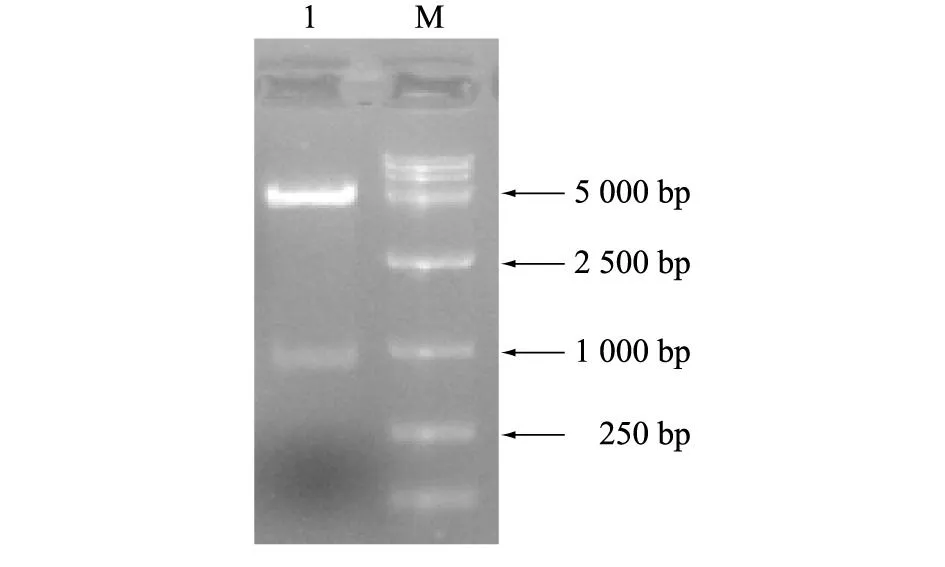
1:pET28a-Szp的BamH Ⅰ和XhoⅠ双酶切;M:DL-15 000 marker。 图2 重组质粒pET28a-Szp的酶切鉴定 Fig.2 Restriction endonuclease identification of recombinant expression plasmid pET28a-Szp
测序结果显示克隆进入pET28a载体的Szp基因长度为1 041 bp,与已发表的CY菌株Szp基因存在1个碱基的错配,致使307位碱基由G突变为A,编码氨基酸密码子由GCA(丙氨酸Ala)突变为ACA(苏氨酸Thr),未形成终止密码子。
2.3 SzP重组蛋白质诱导、纯化及Western-blot分析
阳性重组菌经过IPTG诱导3 h后,获得分子量约5.8×104的SzP重组蛋白质。经过Ni柱亲和层析后,获得单一的SzP重组蛋白质。利用马链球菌兽疫亚种猪抗血清,用Western-blot法检测到5.8×104的SzP重组蛋白质(图3)。

1: Ni柱纯化的SzP重组蛋白质;2:pET28a-Szp阳性重组菌粒诱导后;3:pET28a-Szp阳性重组菌诱导前;M:蛋白质Marker。 图3 SzP重组蛋白质纯化(A)及Western-blot分析(B) Fig.3 Purification(A) and Western-blot(B) of the recombinant protein SzP
2.4 小鼠免疫保护试验
小鼠攻毒后,对照组小鼠2 d内死亡率达到60%,免疫组小鼠攻毒后4 d存活率维持在90%,之后陆续出现死亡。发病较重的小鼠临床表现被毛粗立、精神沉郁、行动迟缓。在死亡小鼠肝脏中能够分离到马链球菌兽疫亚种菌株。SzP重组蛋白质对小鼠的保护率为60%(6/10),CY灭活疫苗对小鼠的保护率为70%,PBS对照组小鼠全部死亡(图4)。

图4 免疫小鼠攻毒后的存活率 Fig.4 The survival rates of the immunized mice post-infection
3讨论
马链球菌兽疫亚种是引发猪链球菌病的一种重要病原菌。范红结等按马源兽疫亚种W60菌株的SzP编码基因设计引物,扩增了猪源马链球菌兽疫亚种35246菌株的SzP编码基因,该段基因包含了SzP的信号肽编码序列,随后扩增的基因片段插入pET32a载体,重组质粒转化进入BL21,经过IPTG诱导,未能获得重组SzP[13]。2011年Lin等利用猪痘病毒载体,表达了35246菌株去除信号肽的SzP,并通过小鼠免疫试验,发现该重组SzP对小鼠有70%免疫保护力[14]。Timoney等利用原核表达载体pET15b,表达了马源SzNC78菌株去除信号肽的SzP,并利用纯化的SzP免疫小鼠,发现90%受免小鼠可以抵抗NC78的攻击。
本研究首次对猪源Sz去除信号肽的类M蛋白质进行了原核表达及纯化,获得分子量约5.8×104的重组蛋白质,明显高于推测的重组蛋白质分子量3.7×104。对插入pET28载体的Szp基因序列测序,发现推导的重组蛋白质C端LPSTGE上游存在11个重复PEPK,推测由于该部分富含脯氨酸,造成蛋白质迁移率下降,出现表达的重组SzP蛋白质表观分子量大于理论分子量的现象,该结果与Timoney等观察到的结果一致。
SzP能抗吞噬细胞的吞噬作用,有利于细菌在动物体内的生存和繁殖。针对SzP的抗体,具备调理素作用,可增强C3b在细菌表面的沉积[15],并且中和SzP下调肺泡巨噬细胞表达TNF、TLR6的能力[16]。本研究对纯化的SzP进行小鼠免疫保护力分析,发现该蛋白质3次免疫小鼠后,对小鼠的免疫保护率为60%,略低于Sz灭活疫苗的保护率,与痘病毒表达的类M蛋白质保护率相当[14]。猪源Sz的类M蛋白质对小鼠的免疫保护率,比马源Sz类M蛋白质的保护率低,一方面与Sz菌株分离来源不同相关,不同地域和不同宿主分离的Sz菌株可能会存在致病力上的差异,另一方面类M蛋白质编码基因在猪源Sz和马源Sz之间存在一定差异,从而引起不同的免疫保护表现。Timoney等利用基因文库,从马源SzNC78菌株中筛选获得一系列免疫原性蛋白质,对其中11种蛋白质进行了表达、纯化,并分析了这些蛋白质对ICR小鼠的免疫保护力,发现M蛋白质(SzM)、膜锚定蛋白质(MAP)和丝氨酸蛋白酶(ScpC)组合形成的三价疫苗,与单组份亚单位疫苗相比较,可提高10倍小鼠耐受的攻毒剂量。另外,Timoney等还提出,ScpC、SzM和链激酶(SKC)组合形成的亚单位疫苗,理论上可以减轻Sz对肺脏的损伤。尽管上述具备良好免疫保护力的蛋白质是在研究马源Sz的基础上获得的,但是马源Sz和猪源Sz细菌在分类上归属同一种,仅仅是细菌分离的宿主不同,所以,对猪源Sz中类似蛋白质进行组合研究,或许可以补充单组份亚单位疫苗的不足,对控制Sz引发的猪链球菌病有积极作用。
参考文献:
[1]BERES S B, SESSO R, PINTO S W, et al. Genome sequence of a Lancefield group CStreptococcuszooepidemicusstrain causing epidemic nephritis: new information about an old disease . PLOS One, 2008, 3(8):e3026.
[2]EYRE D W, KENKRE J S, BOWLER I C, et al.Streptococcusequisubspecieszooepidemicusmeningitis--a case report and review of the literature . Eur J Clin Microbiol Infect Dis, 2010, 29(12):1459-1463.
[3]MORI N, GUEVARA J M, TILLEY D H, et al.Streptococcusequisubsp.zooepidemicusmeningitis in Peru . J Med Microbiol, 2013, 62( 2):335-337.
[4]LIU P H, SHUN S F, WANG Y K, et al. Identification of swineStreptococcusisolates in Shanghai . Chin J Vet Med, 2001, 21(1):42-46.
[5]FENG Z G, HU J S. Outbreak of swine streptococcosis in Sichuan province and identification of pathogen . Anim Husbandry Vet Med Lett, 1977, 2:7-12.
[6]HOFMAN A M, STAEMPFLI H R, PRESCOTT J F. Field-evaluation of a commercial M-protein vaccine againstStreptococcus-equiinfection in foals . Amer J Vet Res, 1991, 52(4):589-592.
[7]ROBINSON J H, KEHOE M A. Group-AStreptococcal-M proteins virulence factors and protective antigens . Immunol Today, 1992, 13(9):362-366.
[8]MOORE B O, BRYANS J T. Antigenic classification of group C animal streptococci . J Am Vet Med Assoc, 1969, 155(2): 416-421.
[9]TIMONEY J F, WALKER J, ZHOU M, et al. Cloning and sequence analysis of a protective M-like protein gene fromStreptococcusequisubsp.zooepidemicus. Infect Immun, 1995, 63(4): 1440-1445.
[10]VELINENI S, TIMONEY J F. Identification of novel immunoreactive proteins ofStreptococcuszooepidemicuswith potential as vaccine components . Vaccine, 2013, 31(38): 4129-4135.
[11]范红结,陆承平,唐家琪. 猪源马链球菌兽疫亚种中国分离株类M基因特性分析. 中国农业科学,2006, 39(1):210-214.
[12]汪家政,范明. 蛋白质技术手册. 北京:科学出版社, 2000.
[13]范红结,陆承平,唐家琪. 马链球菌兽疫亚种类M蛋白的基因克隆、序列分析及其在猪源链球菌的检测. 微生物学报,2004, 44(5):617-620.
[14]LIN H X, HUANG D Y, WANG Y, et al. A novel vaccine againstStreptococcusequissp.zooepidemicusinfections: The recombinant swinepox virus expressing M-like protein . Vaccine, 2011, 29(40): 7027-7034.
[15]MA Z, ZHANG H, YI L, et al. Interaction between M-like protein and macrophage thioredoxin facilitates antiphagocytosis forStreptococcusequisubsp.zooepidemicus. PLoS ONE, 2012, 7(2):e32099.
[16]MA Z, ZHANG H, YI L, et al. Microarray analysis of the effect ofStreptococcusequisubsp.zooepidemicusM-like protein in infecting procine pulmonary alveolar macrophages . Plos One, 2012, 7(5):e36452.
(责任编辑:张震林)
王金玲,王永,刘鲁蜀,等. 草地藏系绵羊生长激素释放激素基因部分cDNA的克隆及生物信息学分析[J].江苏农业学报,2015,31(3):595-599.

