鹅坦布苏病毒囊膜蛋白结构域II在大肠杆菌中的表达及免疫学鉴定
鹅坦布苏病毒囊膜蛋白结构域II在大肠杆菌中的表达及免疫学鉴定
赵冬敏,黄欣梅,刘宇卓,韩凯凯,杨婧,谢星星,刘晓燕,李银
(江苏省农业科学院兽医研究所,农业部兽用生物制品工程技术重点实验室,国家兽用生物制品工程技术研究中心,江苏南京210014)

摘要:为了实现鹅坦布苏病毒囊膜蛋白(E蛋白)结构域II在大肠杆菌中的表达并对其进行免疫学鉴定,根据鹅坦布苏病毒JS804株囊膜蛋白基因序列,利用人工合成法获得鹅坦布苏病毒囊膜蛋白结构域II编码基因并引入限制性酶切位点,片段大小为507 bp。将合成的基因片段克隆入pGEX-4t-1原核表达载体中,构建重组表达载体pGEX-EII并转化至BL21(DE3)中。通过优化表达条件获得重组蛋白质并进行免疫学鉴定。结果显示,重组蛋白质分子量约为 4.4×10`4,Western-blot和间接免疫荧光检测结果表明重组蛋白质具有良好的免疫原性。
关键词:鹅坦布苏病毒;囊膜蛋白;结构域II
doi:10.3969/j.issn.1000-4440.2015.03.025
收稿日期:2014-11-11
基金项目:国家自然科学基金项目(31172345);江苏省自然科学基金项目(BK2012376);江苏省农业科学院基本科研业务专项项目[ZX(15)4005]
作者简介:赵冬敏(1982-),女,山东兖州人,博士,副研究员,主要从事家禽重大疫病流行病学和致病分子机制研究。(Tel)025-84390047;(E-mail)zhaodongmin126@126.com
通讯作者:李银,(E-mail)muziyin08@163.com
中图分类号:S858.322.5`+2
文献标识码:A
文章编号:1000-4440(2015)03-0619-05
Abstract:To express and immunoidentify goose tembusu virus envelope domain II in Escherichia coli, the encoding gene of goose tembusu virus JS804 strain envelope protein domain II was artificially synthesized with the length of 507 bp. The synthesized gene was then inserted into the prokaryotic vector pGEX-4t-1 for the construction of recombinant expression plasmid pGEX-EII and then transformed into E. coli BL21 (DE3). The recombinant protein with the molecular mass of 4.4×10`4 was successfully expressed in E. coli by optimizing the conditions of expression. Western-blot and IFA revealed the good immunogenicity exhibited by the recombinant protein.
Expression and immunology of domain II of goose tembusu virus envelope protein inEscherichiacoli
ZHAO Dong-min,HUANG Xin-mei,LIU Yu-zhuo,HAN Kai-kai,YANG Jing,XIE Xing-xing,LIU Xiao-yan,LI Yin
(InstituteofVeterinaryMedicine,JiangsuAcademyofAgriculturalSciences/KeyLaboratoryofVeterinaryBiologicalsEngineeringandTechnology,MinistryofAgriculture/NationalCenterforEngineeringResearchofVeterinaryBio-products,Nanjing210014,China)
Key words: goose tembusu virus;envelope protein;domain II
鹅坦布苏病毒属于黄病毒科黄病毒属成员。水禽感染该病毒后,其临床病症为卵泡出血、萎缩、变性及瘢痕化,部分出现脑膜出血,食欲急剧减退、产蛋量骤降,群内发病率高达100%,死亡率为 5%~28%[1-3]。鸭鹅坦布苏病毒自2010年暴发以来,已连年在中国多省大面积流行,并且感染的宿主谱还在不断扩大,蛋鸭、种鸭、雏鸭、蛋鹅、种鹅及蛋鸡等均出现坦布苏病毒感染的病例[4-6]。该病毒病已成为危害中国鸭鹅养殖业的重要疫病之一。
鹅坦布苏病毒基因组为单股正链RNA,基因组全长约为11 kb,包含1个开放阅读框架(ORF),编码1个多聚蛋白质。囊膜蛋白(E蛋白)是黄病毒主要的结构蛋白,由约500个氨基酸残基组成,分子量约为 5.5×104~ 6.0×104,2个囊膜蛋白单体分子以反向平行方式构成同源二聚体,90个E蛋白同源二聚体排列于成熟病毒颗粒的表面[7-8]。囊膜蛋白在病毒吸附,与宿主细胞膜融合以及病毒组装过程中具有重要作用。同时,囊膜蛋白也是黄病毒主要的病毒抗原,含有多种抗原表位,可通过诱发中和抗体产生保护性免疫应答。囊膜蛋白属于II型跨膜蛋白,X射线晶体学阐明,囊膜蛋白的晶体结构中,β-折叠占绝大多数,在空间上形成3个不同的结构域:结构域I、II和III(DI、DII和DIII)。囊膜蛋白结构域II由2个不连续片段组成,折叠成指样结构(Finger-like structure)。该区域cd环富含甘氨酸且完全疏水,在几乎所有的黄病毒属病毒中均是保守的,它对病毒的融合活性非常重要,定点突变试验已证实它可在囊膜蛋白由二聚体向三聚体转变的过程中插入胞膜,参与病毒与宿主细胞膜融合,被认为是病毒的融合多肽(Fusion peptide)。I和II区界面存在1个分子铰链区,该区可通过酸性pH介导的构象变化使融合多肽移向宿主细胞膜,并形成融合多肽的突出部分[10-11]。
由于黄病毒属坦布苏病毒引起的疫病是新发疫病,目前尚未见有关鹅坦布苏病毒囊膜蛋白结构域II的研究报道。本研究通过人工合成法合成鹅坦布苏病毒囊膜蛋白结构域II的编码基因并克隆入表达载体pGEX-4t-1中,利用大肠杆菌表达系统表达重组囊膜蛋白质结构域II并对其进行免疫学鉴定,为进一步研究鹅坦布苏病毒囊膜蛋白结构和功能及研制亚单位疫苗打下基础。
1材料与方法
1.1 试验材料
鹅坦布苏病毒JS804株囊膜蛋白结构域II基因核苷酸片段由南京金斯瑞生物有限公司合成。pGEX-4t-1原核表达载体、宿主菌BL21(DE3)、E蛋白阳性血清,均由江苏省农业科学院兽医研究所家禽重大疫病防控项目组保存。
1.2 主要试剂
琼脂糖凝胶回收试剂盒、小量提取质粒试剂盒等购自Axygen公司;T4 DNA连接酶、限制性内切酶、DNA marker等购自大连宝生物有限公司;GST抗体、碱性磷酸酯酶标记山羊抗小鼠IgG、BCIP/NBT碱性磷酸酯酶显色试剂盒购自碧云天生物技术研究所;其他试剂均为进口分装或国产分析纯。
1.3 鹅坦布苏病毒囊膜蛋白结构域II基因片段的合成
根据GenBank中登录的鹅坦布苏病毒JS804株(登录号:JF895923)E基因序列,由南京金斯瑞生物有限公司人工合成结构域II基因片段并分别在5′和3′端加入EcoR I(GAATTC)和SalI(GTCGAC)酶切位点,片段全长为507 bp。
1.4 重组表达质粒的构建与鉴定
将合成的结构域II基因片段和pGEX-4t-1质粒分别用EcoRⅠ和SalI双酶切。用T4 DNA连接酶将酶切后的结构域II基因与pGEX-4t-1载体连接,构建重组表达载体pGEX-EII,转化BL21(DE3)感受态细胞。经酶切鉴定后,挑选阳性克隆质粒送南京金斯瑞生物有限公司进行基因序列测定,并进行序列分析。
1.5 结构域II蛋白的诱导表达与SDS-PAGE分析
取含重组质粒pGEX-EII的阳性BL21(DE3)菌液,接种于5 ml含有氨苄青霉素(100 μg/ml)的LB液体培养基中,37 ℃培养过夜。次日取100 μl接种于10 ml含有氨苄霉素(100 μg/ml)的LB液体培养基中,37 ℃振荡培养至OD600值达 0.3~0.4。以终浓度1 mmol/L IPTG诱导表达,分别于诱导后0 h、3 h、4 h、5 h取500 μl菌液,12 000r/min离心5 min,弃上清液。沉淀用生理盐水重悬后与4×蛋白质电泳上样缓冲液混匀,沸水浴5 min,以pGEX-4t-1空载体进行同样的操作为对照,进行SDS-PAGE蛋白质电泳观察结果。
1.6 重组结构域II蛋白在菌体中的分布分析
取5 ml 1 mmol/L IPTG诱导5 h的菌液,12 000r/min离心5 min,弃上清液。沉淀用3 ml菌体裂解液重悬,超声波破碎15 min,12 000r/min离心5 min。分别取上清液和沉淀与4×蛋白质电泳上样缓冲液混匀,沸水浴5 min,进行SDS-PAGE蛋白质电泳观察结果,以确定表达蛋白质存在的位置。
1.7 重组蛋白质的Western-blot鉴定
重组蛋白质经12%SDS-PAGE分离后,采用湿法将蛋白质转印至硝酸纤维膜(NC)上,采用70 V电压,作用1 h。5% BSA、37 ℃封闭2 h,TBST(0.05% Tween-20)洗涤后分别加入GST标签单抗和E蛋白阳性血清并于4 ℃过夜。TBST(0.05% Tween-20)洗涤后加入碱性磷酸酶(AP)标记的羊抗鼠IgG于37 ℃孵育1 h。TBST(0.05% Tween-20)洗涤后按照BCIP/NBT碱性磷酸酶显色试剂盒说明书显色。
1.8 鼠抗重组蛋白质血清的制备及其效价的测定
将纯化的重组蛋白质与等量弗氏完全佐剂混合并充分乳化后皮下多点免疫BALB/c小鼠,每只免疫重组蛋白质的剂量为70 μg,免疫后7 d采集血清。以纯化的重组蛋白质包被ELISA板,PBST洗涤3次后每孔加入100 μl梯度稀释的小鼠血清,37 ℃孵育1 h。PBST洗涤后每孔加1∶10 000稀释的HRP标记的羊抗鼠IgG二抗100 μl,37 ℃孵育1 h。PBST洗涤3次,加 入TMB底物避光显色10 min。以2 mol/L H2SO4终止反应,450 nm波长下读取OD450值。
1.9 间接免疫荧光(IFA)鉴定
利用鹅坦布苏病毒JS804株感染BHK-21细胞,感染后4 d弃去培养上清,用无水乙醇固定,加入 1∶50稀释的鼠抗重组蛋白质血清,37 ℃孵育1 h。PBST洗3次,加入 1∶200稀释的 FITC 标记的羊抗鼠IgG二抗,37 ℃孵育1 h。PBST洗3次,置于荧光显微镜下观察并记录结果,以正常BHK-21细胞作对照。
2结果
2.1 鹅坦布苏病毒囊膜蛋白结构域II基因的获得
利用EcoR I和SalI双酶切含有结构域II人工合成基因的质粒pUC57-simple-EII,获得大小约为507 bp的片段,与预期大小相符(图1)。
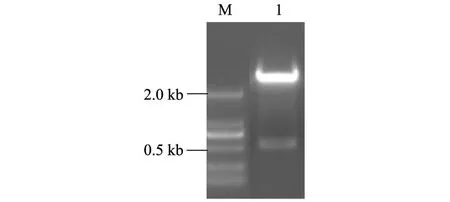
M:DL2000 marker;1:结构域II基因片段。 图1 人工合成结构域II基因片段 Fig.1 Synthetic domain II gene fragment
2.2 鹅坦布苏病毒囊膜蛋白结构域II重组表达质粒的构建
提取重组质粒pGEX-EII,限制性内切酶EcoRⅠ和SalⅠ酶切,琼脂糖凝胶电泳检测,得到2个片段,大小与预期相符(图2)。测序结果表明结构域II片段以正确方式插入pGEX-4t-1载体中且序列正确。
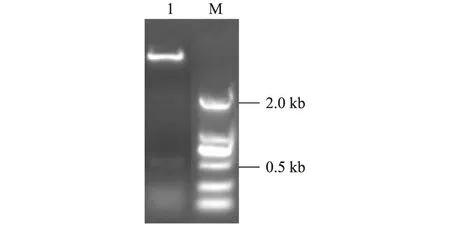
1:重组质粒pGEX-EII Eco RⅠ和SalⅠ酶切;M:DL2000 marker。 图2 重组质粒pGEX-EII的酶切鉴定 Fig.2 Identification of recombinant plasmid pGEX-EII by enzyme digestion
2.3 鹅坦布苏病毒囊膜蛋白结构域II的诱导表达与SDS-PAGE分析
将鉴定为阳性的细菌进行IPTG诱导表达。经SDS-PAGE检测后发现,以1 mmol/L IPTG诱导时,pGEX-EII在诱导后4 h出现目的条带,大小约为 4.4×104的融合蛋白质,与预期蛋白质大小一致,在诱导4 h时表达量最高(图3)。
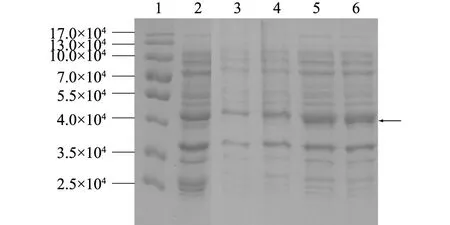
1:蛋白质分子量marker;2:pGEX空载体;3~6:诱导后0 h、3 h、4 h、5 h表达的蛋白质。 图3 pGEX- EII重组蛋白质的SDS-PAGE检测 Fig.3 Analysis of pGEX-EII fusion protein by SDS-PAGE
2.4 重组鹅坦布苏病毒囊膜蛋白结构域II在菌体中的分布
将诱导表达5 h的细菌进行超声波裂解,经SDS-PAGE电泳分析,发现pGEX-EII融合蛋白质以包涵体形式存在(图4)。
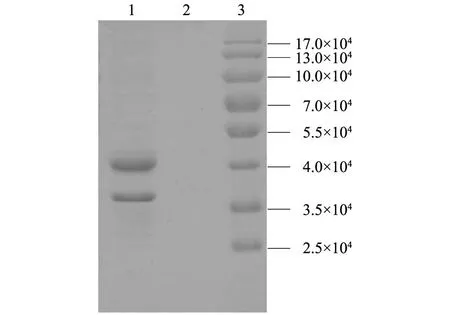
1:超声裂解后沉淀;2:超声裂解后上清液;3:蛋白质分子量marker。 图4 pGEX-EII重组蛋白质在菌体中的分布 Fig.4 Distribution of pGEX-EII fusion protein in recombinant E. coli
2.5 重组鹅坦布苏病毒囊膜蛋白结构域II的Western-blot鉴定
分别利用GST单抗和囊膜蛋白阳性血清Western blot检测重组结构域II蛋白,结果显示GST单抗和E蛋白阳性血清均检测到特异性条带,表明重组结构域II蛋白具有良好的免疫原性(图5、图6)。

1:重组结构域II蛋白;2:蛋白质分子量marker。 图5 GST单克隆抗体鉴定pGEX-EII表达的融合蛋白 Fig.5 Western-blot identification of pGEX-EII fusion protein with GST McAb
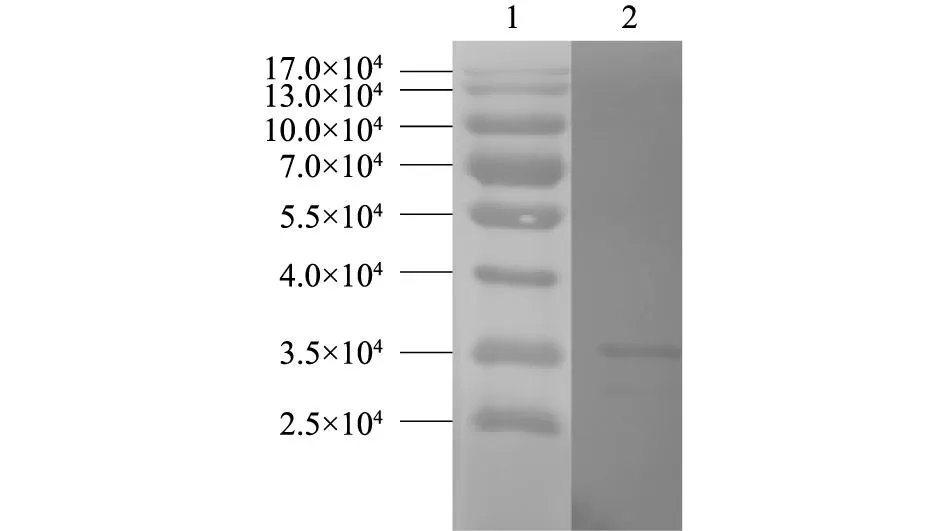
1:蛋白质分子量marker;2:重组结构域II蛋白。 图6 E蛋白阳性血清鉴定pGEX-EII融合蛋白 Fig.6 Western-blot identification of pGEX-EII fusion protein with positive serum for E protein
2.6 鼠抗重组蛋白质血清的制备及其效价的测定
用纯化的重组蛋白质免疫小鼠获得抗血清后,利用间接ELISA方法检测血清效价。将纯化的重组蛋白质包被ELISA板,以获得的小鼠抗血清作为一抗。结果显示,免疫后7 d,抗体效价可达 1∶800,表明利用大肠杆菌表达的E蛋白结构域II具有良好的免疫原性,免疫后可诱导机体产生特异性免疫应答。
2.7 间接免疫荧光(IFA)鉴定
用大肠杆菌表达的重组蛋白质免疫小鼠获得抗血清后,利用间接免疫荧光对该血清进行鉴定。结果显示,获得的血清可与鹅坦布苏病毒JS804株发生特异性结合,表明该血清具有较好的特异性(图7)。

A:未感染的空白BHK-21细胞;B:鹅坦布苏病毒JS804株感染的BHK-21细胞。 图7 抗血清的间接免疫荧光鉴定 Fig.7 Indirect immunofluorescence analysis of the murine anti-serum
3讨论
2010年4月以来,福建、河北、浙江、山东、江苏、北京等省市的鸭鹅陆续暴发了一种以食欲急剧减退、产蛋量骤降为主要特征的新发疫病,给鸭鹅养殖业造成了重大经济损失。研究者通过病原分离和系统的实验室诊断,确定该病由黄病毒科黄病毒属的坦布苏病毒感染引起[12-13]。
黄病毒属病毒囊膜蛋白结构域II内的cd环是病毒的融合多肽,参与病毒与宿主细胞膜融合。研究结果表明,该区某些位点的突变可通过破坏病毒与宿主细胞膜融合而影响病毒的神经毒力。结构域II末端与茎干区相接触的b、d和j链,以及bc环上的氨基酸突变均可直接破坏囊膜蛋白外侧与prM和(或)其他囊膜蛋白单聚体之间的作用,并选择性地改变结构域II顶端的构象,干扰融合多肽的出现。因此,黄病毒属病毒囊膜蛋白结构域II与病毒的致病性密切相关[14-15]。深入研究鹅坦布苏病毒囊膜蛋白结构域II将有助于开发基于囊膜蛋白的新型疫苗和特异性药物,为鹅坦布苏病毒病的防控以及抗病毒药物的设计提供理论基础。
本研究通过基因合成的方法获得编码鹅坦布苏病毒囊膜蛋白结构域II的基因片段,将其插入原核表达载体pGEX-4t-1中,构建了重组质粒pGEX-EII,并在大肠杆菌中成功表达了鹅坦布苏病毒囊膜蛋白结构域II。Western blot鉴定结果表明,该蛋白质可与E蛋白阳性血清和GST标签单克隆抗体发生特异性反应。利用纯化后的重组蛋白质免疫小鼠,免疫后7 d抗血清效价可达 1∶800。间接免疫荧光试验检测结果表明,该血清可与感染BHK-21细胞的鹅坦布苏病毒发生特异性反应,表明重组蛋白质具有良好的免疫原性。
由于鹅坦布苏病毒感染在中国主要鹅养殖地区广泛存在,严重危害鹅养殖业的健康发展,因此,有效预防及控制鹅坦布苏病毒病的发生和流行越来越受到人们的重视。本研究为进一步深入研究鹅坦布苏病毒囊膜蛋白结构和功能奠定了基础,此外该重组蛋白质也可作为鹅坦布苏病毒亚单位疫苗的候选疫苗,进行疫苗保护性研究。
参考文献:
[1]HUANG X, HAN K, ZHAO D, et al. Identification and molecular characterization of a novel flavivirus isolated from geese in China. Res Vet Sci, 2013, 94(3): 774-780.
[2]SU J, LI S, HU X, et al. Duck egg-drop syndrome caused by BYD virus, a new tembusu-related flavivirus . PLoS One, 2011, 6 (3): 1-10.
[3]YAN P, ZHAO Y, ZHANG X, et al. An infectious disease of ducks caused by a newly emerged tembusu virus strain in mainland China . Virology, 2011, 417(1): 1-8.
[4]陈仕龙,陈少莺,王劭,等. 一种引起蛋鸡产蛋下降的新型黄病毒的分离与初步鉴定. 福建农业学报, 2011, 26 (2): 170-174.
[5]傅光华,黄瑜,施少华,等. 鸡黄病毒的分离与初步鉴定. 福建畜牧兽医, 2011, 33 (3): 1-2.
[6]李玉峰,马秀丽,于可响,等. 一种从鸭新分离的黄病毒研究初报. 畜牧兽医学报, 2011, 42(6): 885-891.
[7]ALCON S, TALARMIN A, DEBRUYNE M, et al. Enzyme-linked immunosorbent assay specific to dengue virus type 1 nonstructural protein NS1 reveals circulation of the antigen in the blood during the acute phase of disease in patients experiencing primary or secondary infections . J Clin Microbiol, 2002, 40 (2):376-381.
[8]ALCON-LEPODER S, SIVARD P, DROUET M T, et al. Secretion of flaviviral non-structural protein NS1: from diagnosis to pathogenesis . Novartis Found Symp, 2006, 277: 233-247.
[9]邓永强,秦鄂德. 虫媒黄病毒包膜E蛋白的研究进展 . 军事医学科学院院刊, 2006, 30 (6): 575-579.
[10]STIASNY K, BRESSANELLI S, LEPAULT J, et al. Structure of a flavivirus envelope glycoprotein in its low-pH-induced membrane fusion conformation . Embo J, 2004, 23(4): 728-738.
[11]李焱,时莹,徐志凯,等. 登革病毒E蛋白入胞机制研究现状. 热带医学杂志, 2010, 10 (2): 221-222.
[12]黄欣梅,李银,赵冬敏,等. 新型鹅黄病毒JS804毒株的分离与鉴定. 江苏农业学报, 2011, 27(2): 354-360.
[13]苏敬良. 鸭的新型黄病毒BYD引起的产蛋下降综合征. 兽医导刊, 2011(4): 27-29.
[14]PLETNEV A G, BRAY M, HANLEY K A, et al. Tick-borne Langat/mos-quito-borne dengue flavivirus chimera, a candidate live attenuated vaccine for protection against disease caused by members of the tick-borne encephalitis virus complex: evaluation in rhesus monkeys and inmosquitoes . J Virol, 2001, 75(17):8259 -8267.
[15]LI J, BHUVANAKANTHAM R, HOWE J, et al. The glycosylation site in the envelope protein of WestNile virus (Sarafend) plays an important role in replication andmaturation processes . J Gen Virol, 2006, 87(3): 613-622.
(责任编辑:张震林)
李保全,申爱华,周蔚,等. 米糠毛油对肉猪生产性能、脂类代谢及相关基因表达的影响[J].江苏农业学报,2015,31(3):624-629.

