红细胞脂筏成分分离的原子力显微镜观测
红细胞脂筏成分分离的原子力显微镜观测
郝长春, 王佳静, 朱玲青, 穆文宁, 孙润广
(陕西师范大学 物理学与信息技术学院, 陕西 西安 710119)
摘要:用原子力显微镜观测红细胞,利用蔗糖密度梯度离心法在4 ℃下从人血红细胞中分离出不溶于去垢剂Triton X—100的脂筏成分。用红细胞脂筏成分制备Langmuir-Blodgett(LB)单层膜,并进行原子力显微镜观测, 结果表明: 红细胞呈双凹圆盘状,直径约为7.5 μm。脂筏成分呈小的聚集体结构, 大小约210 nm。单层膜结构形态随着表面压力的增加而变化。在较低表面压力时呈现出液态无序和液态有序共存相结构, 当继续压缩单层膜时, 液态有序相微区发生融合连接形成大的平台状结构, 高度起伏约1.55 nm。
关键词:红细胞; 脂筏; 原子力显微镜; LB单层膜
中图分类号:O561.1; Q25 文献标志码: A
Atomic force microscope study of the isolation and reconstruction
of the structure of lipid rafts in erythrocyte
HAO Changchun, WANG Jiajing, ZHU Lingqing, MU Wenning, SUN Runguang
(School of Physics and Information Technology, Shaanxi Normal University, Xi′an 710119, Shaanxi, China)
Abstract:Using the atomic force microscope(AFM) the human red blood cells were observed. Lipid rafts, which do not dissolve in detergent Triton X—100 components, were extracted by the sucrose density gradient centrifugation at 4 ℃. Langmuir-Blodgett (LB) monolayers of erythrocyte ghost were prepared and observed by the AFM. The experimental results show that the red blood cells took on double-concave disc-shaped with the size of 7.5 μm and lipid rafts showed a small granules structure with the size of 210 nm. The monolayer structure and morphology changed with increasing surface pressure. At the low surface pressure, there was liquid disordered and liquid-ordered coexisting phase structure. When continuing to compress the monolayer, the fluid ordered phase fused to form large flat platform structure with the height of 1.55 nm.
Key words: erythrocyte; lipid rafts; atomic force microscope; Langmuir-Blodgett monolayers
生物膜脂筏微区游动于磷脂酰胆碱和磷脂酰乙醇胺为骨架的液晶态双层膜中,是生物膜不被去垢剂所溶解的部分,称为Detergent-insoluble glycolipid-riched domains (DIGs),或Detergent-resistant fractions (DRF)[1-2]。通过冰冻蚀刻电子显微镜、荧光显微镜、荧光共振能量转移、核磁共振、X衍射等技术都证实了生物膜筏状结构的存在。研究表明, 脂筏含有大量的信号分子,可以参与信号转导、蛋白质分选、离子通道的调节、膜的粘连、细胞的生长、分化、衰老、凋亡以及应急反应。它们结构和功能的改变,会引发多种疾病,如肿瘤、糖尿病、神经退行性疾病 (如:老年痴呆症,帕金森氏症,阿尔兹罕默氏病等)[3-4]。
脂筏微区虽然在分子水平上已经被检测到,但是其形成过程并没有得到很好的解释。生物膜中脂筏在低温下能抵抗非离子去垢剂的抽提。利用此性质就可以对脂筏结构进行在体分离[5]。本文在4 ℃下从人血红细胞中分离不溶于去垢剂的脂筏部分,用原子力显微镜对其形态结构进行观察分析,旨在从红细胞分离脂筏成分,体外制备LB单层膜,并用原子力显微镜观察分析脂筏结构。
1 实验材料与方法
1.1红细胞膜脂筏成分的提取
新鲜血液(血库提供)30 mL, 100×g离心10 min,用吸管吸去血浆及红细胞表层的绒毛状沉淀,加入5倍体积的pH 8.0 PBS缓冲液, 2 000×g离心15 min,弃去上清液,重复3次。在沉淀中加入40倍体积pH 8.0的PBS缓冲液, 4 ℃下静置2 h溶血。然后22 000×g离心20 min,重复4次。沉淀用预冷的Triton X—100缓冲液(含0.25 mmol/L蔗糖, 150 mmol/L NaCl, 1 mmol/L EDTA, 20 mmol/L Tris-HCl和1% Triton X—100)重悬,然后用等体积的80%(W/V)蔗糖溶液稀释。取4 mL去垢剂处理过的膜悬浮液移入离心管,然后依次加入4 mL 30%和3.5 mL 5%的蔗糖溶液, 4 ℃, 38 000×g密度梯度离心18 h。在5%和30%蔗糖界面处收集脂筏成份,进行AFM检测。
1.2干燥血影成分的提取
新鲜血液(血库提供)30 mL, 4 ℃, 100×g离心20 min。用吸管吸去血浆及红细胞表层的绒毛状沉淀, 加入3倍预冷的pH 7.4 PBS缓冲液, 4 ℃, 2 000×g离心15 min,弃上清液及表层,重复3次。然后沉淀加入40倍体积预冷的pH7.4 Tris-HCl缓冲液, 4 ℃下静置2 h溶血。然后22 000×g离心20 min,重复5次。得到白色血影膜样品,重悬,冷冻干燥。然后将干燥的膜成分溶解到氯仿/甲醇3∶1(V∶V)中形成1 mg/mL溶液。用微量进样器将10 μL溶液均匀平铺在新解离的云母基片上,进行AFM检测。
1.3血影成分单层膜制备
将血影成分溶解在氯仿/甲醇3∶1(V∶V)中形成浓度为0.5 mmol/L的溶液。KSV-Minitrough (芬兰KSV公司,槽子: 323 mm×75 mm)进行制备。用微量进样器将一定体积的脂溶液滴加到纯水表面,让其自动铺展。15 min后,等液体表面有机溶剂完全挥发后,以10 mm/min的速度压膜。膜表面压力由Wilhelmy吊片式天平检测,π-A曲线由计算机控制自动获得,每组数据最少重复3次。在固定的膜压下,使用垂直提膜法以5 mm/min的速度将单分子层转移到新解离的云母基片上,成膜温度控制在20±0.5 ℃,然后对样品进行原子力显微镜检测。
1.4AFM观测
原子力显微镜(AFM):型号为SPM—9500—J3(日本岛津公司)。测量采用轻敲模式,整个实验观测过程在室温下进行。所采用的是标准扫描头,其最大扫描范围为125 μm×125 μm,微悬臂选用100 μm,探针为T形,材料为Si3N4,悬臂的弹性常数为0.06 N/m,对样品作用力控制在10-8N量级。扫描频率为0.5~1 Hz。
2结果与讨论
2.1红细胞的AFM观测
原子力显微镜通过调节控制针尖与样品间的作用力实现对样品无损伤扫描,在原子级分辨率尺度范围内获得样品的表面形貌图[6]。图1给出了正常

图1 红细胞吸附在云母表面的AFM图
红细胞在新解离云母片上的表面形貌图, 从图中可以展示红细胞呈凹陷圆盘状(图1a), 对应的立体图能更直观展示红细胞在固体衬底表面吸附的形态(图1b和1c)。文献报道正常红细胞表面柔顺光滑[7],直径约7.5 μm,厚度1.7 μm, 体积83 μm3,表面积145 μm2,表面积与体积比值较大,有利于细胞变形、气体交换和携带。通过AFM软件对观测的红细胞进行了统计,红细胞的直径为7.4±0.3 μm,表面积为170±16 μm2,体积为46±1 μm3,厚度为1.4±0.3 μm。对比实验数据发现,实验观测的红细胞直径、表面积大小均在正常范围,体积和厚度有所降低,其原因是红细胞吸附在衬底上时,接触面发生粘附所致。
2.2红细胞膜脂筏结构观测
脂筏是存在于细胞膜中具有特定结构和功能的动态结构域, 低温下不溶于非离子去垢剂。通过蔗糖密度梯度离心方法在4 ℃下抽提不溶于去垢剂Triton X—100的部分,将其以一定的浓度滴在新解离的云母衬底表面进行原子力显微镜检测。AFM检测结果表明,脂筏成分呈现一些小的聚集体结构,如图2a所示。文献报道脂筏微区结构区域大小为50~300 nm[8]。实验中对AFM图中小颗粒结构进行了数值统计,大小分布见图2b所示。从图中可以看出,颗粒体的平均直径大小为210 nm,此颗粒尺寸与文献报道的脂筏微区大小相一致。

图2 红细胞膜脂筏结构抽提液的AFM观测(a)
2.3红细胞血影成分LB膜结构的AFM观测
文献报道的脂筏研究中常采用脂与脂、脂与蛋白混合,制备具有特定相态结构的单层膜或双层膜微区来模拟研究脂筏结构的性质[9-10]。由于脂筏结构中成分较为复杂,所以简单的几种组分混合并不能给出真实情况下微区结构的性质,仅能提供组分分子间相互作用的机理。本实验中提取的红细胞血影含多种组分,所以对其进行研究具有重要的参考意义。实验过程中将干燥的血影成分样品通过LB的方法在不同表面压力下制备出单层膜,利用原子力显微镜对其进行观测。如图3所示,当表面压力为5 mN/m时,单层膜呈现出明显的液态无序和液态有序相共存相共存结构,液态有序相对应图中微区结构,两相高度差为1.55 nm,微区结构大约为200 nm。随着表面压力增大,小的微区结构逐渐融合,连接成大的平台(图3b),从图中可以看出平台并不致密,较为疏松。当表面压力增大到30 mN/m时,所有的微区结构连接到一起形成了具有许多孔洞的大片结构,该形貌与文献中报道的利用多种脂混合模拟脂筏结构形成的形态相一致[11]。
生物膜脂筏结构和功能的研究是当前该领域的热点问题,本实验虽然提取出了脂筏成分,但仍存在一些需要解决的问题: (1) 细胞膜脂筏结构对去垢剂的敏感性有差别,对不同的细胞选择合适的去垢剂是个难解决的问题; (2) 去垢剂的引入会不会造成脂筏上的物质损失或出现成分间的粘连、相变等问题; (3) 生物膜内外页脂筏成分结构的成分有何差异,脂与蛋白间如何相互作用等关键问题[12]; (4) 脂筏与疾病的关系[13-14]。
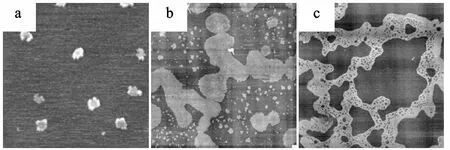
图3 干燥血影成份LB膜结构的AFM观测
3结论
本文用蔗糖密度梯度离心法提取红细胞膜脂筏成分,用原子力显微镜观测红细胞膜脂筏成分制成的LB膜, 实验结果表明脂筏呈现出小聚集体结构,大小约210 nm。LB膜随着成膜压力增加出现了小微区、平台、大片层结构。本实验提供了一个从红细胞分离脂筏成分,在体外制备LB膜, 进行原子力显微镜观测的新方法,对研究脂筏结构的物理化学性质具有一定的参考意义。
参考文献:
[1] Simaons K, Ikonen E. Functional rafts in cell membranes [J]. Nature,1997, 387:569-572.
[2] Rinia H A. Visualizing detergent resistant domains in model membranes with atomic force microscopy [J]. FEBS Letters, 2001, 501:92-96.
[3] Samsonov A V. Characterization of cholesterol-sphingomyelin domains and their dynamics in bilayer membranes [J]. Biophysical Journal,2001, 81:1486-1500.
[4] Luana S, Inna S, Markus J W, et al. Structure of cholesterol/ceramide monolayer mixtures: Implications to the molecular organization of lipid rafts[J].BiophysicalJournal, 2005, 88:3381-3391.
[5] Peter J, Quinn C T, Dominique R, et al. Structure and thermotropic phase behaviour of detergent-resistant membrane raft fractions isolated from human and ruminant erythrocytes[J]. Biochimica et Biophysica Acta-Biomembranes, 2005, 1713: 5-14.
[6] Hao C, Zhang L, Sun R, et al. Interaction between ganglioside GM1 and diosgenin in Langmuir monolayers at the air/water interface [J]. Scanning, 2014, 36: 218-223.
[7] 杨谦, 孙润广, 张静, 等. 结合AFM探测副伤寒沙门氏菌B感染红细胞膜的生物力学特性[J]. 中国科学C辑: 生命科学, 2014,44(2): 197-207.
[8] Marin R, Rojo J, Fabelo N, et al. Lipid raft disarrangement as a result of neuropathological progresses: A novel strategy for early diagnosis[J]. Neuroscience, 2013, 245: 26-29.
[9] Hao C, Sun R, Zhang J. Mixed monolayers of DOPC and Palmitic acid at the liquid-air interface [J]. Colloids and SurfaceB:Biointerfaces, 2013, 112: 441-445.
[10] 郝长春, 张蕾, 孙润广,等. DOPC/DPPC单层膜中分子间的相互作用及形态观测研究[J]. 高等学校化学学报, 2013, 34(10): 2340-2346.
[11] Orsini F, Cremona A, Arosio P, et al. Atomic force microscopy imaging of lipid rafts of human breast cancer cells[J]. Biochimica et Biophysica Acta-Biomembranes, 2012, 1818: 2943-2949.
[12] Fullekrug J, Simons K. Lipid rafts and apical membrane traffic[J]. Annals of the NewYork Academy of Science, 2004, 1014:164-169.
[13] Helms J B, Zurzolo C. Lipids as targeting signals: Lipid rafts and intracellular traffic[J].Traffic, 2004, 5: 247-254.
[14] 郁毅刚, 徐如祥, 姜晓丹. 神经元细胞膜脂筏结构原子力显微镜研究[J]. 中华神经医学杂志, 2005, 4(7): 655-657.
〔责任编辑 李博〕


