ZnCl2胁迫下抗氰呼吸对烟草细胞活力和过氧化氢水平的影响
ZnCl2胁迫下抗氰呼吸对烟草细胞活力和过氧化氢水平的影响
冯汉青, 王婉, 王玉佩, 王庆文, 管冬冬, 贾凌云
(西北师范大学 生命科学学院, 甘肃 兰州 730070)
摘要:以烟草悬浮细胞BY-2为材料,探讨了ZnCl2胁迫下抗氰呼吸对细胞活性和过氧化氢产生的影响。结果表明,随着ZnCl2胁迫程度的增加,BY-2烟草悬浮细胞活力逐渐降低,抗氰呼吸的水平却显著上升。较高水平ZnCl2 (150 mmol/L)的胁迫导致细胞活力的显著性下降及过氧化氢水平的显著性上升;外源过氧化氢的处理也能够导致细胞活力的下降;而H2O2的清除剂则缓解了ZnCl2 胁迫处理下细胞活力的下降,表明ZnCl2 胁迫处理下细胞活力的下降和过氧化氢水平的上升有关。进一步研究了在ZnCl2胁迫下抗氰呼吸对细胞活力及过氧化氢水平的影响。结果显示,在较高水平ZnCl2 (150 mmol/L) 胁迫下加入抗氰呼吸的抑制剂导致细胞活力的进一步下降和过氧化氢的进一步上升。上述结果表明,抗氰呼吸可以缓解ZnCl2胁迫下细胞的氧化压力和细胞活力的下降,在其细胞抵抗高水平ZnCl2胁迫中扮演了一定的角色。
关键词:抗氰呼吸; 细胞活力; 活性氧; 锌胁迫
中图分类号:Q945.1文献标志码: A
文章编号:1672-4291(2015)01-0075-05
doi:10.15983/j.cnki.jsnu.2015.01.316
收稿日期:2014-05-10
基金项目:陕西省自然科学基金资助项目(SF2009178)
The effects of the cyanide-resistant respiration on the cell viability and
hydrogen peroxide production of the tobacco suspension cells under ZnCl2stress
FENG Hanqing, WANG Wan, WANG Yupei, WANG Qingwen, GUAN Dongdong, JIA Lingyun
(College of Life Sciences, Northwest Normal University, Lanzhou 730070, Gansu, China)
Abstract:By using the tobacco (Nicotiana tabacum L. cv. Bright Yellow) cell culture, the effects of the cyanide-resistant respiration on the cell viability and hydrogen peroxide production under ZnCl2 stress were studied. The results showed that with the increase of the concentrations of ZnCl2, the level of cell viability is decreased, while the level of the cyanide-resistant respiration is increased. A higher level of ZnCl2 (150 mmol/L) stress caused a significant decrease of cell viability and a significant increase of the hydrogen peroxide(H2O2) production. Treatment with exogenous H2O2 also caused a decrease of cell viability, and application of the scavenger of H2O2 alleviated the decrease of cell viability under ZnCl2 stress. The effects of the cyanide-resistant respiration on the cell viability and hydrogen peroxide production under ZnCl2 stress were further studied.The ZnCl2-stressed (150 mmol/L) cells pretreated with salicylhydroxamic acid (an inhibitor of the cyanide-resistant respiration) had lower cell viability but higher H2O2 production than the cells exposed to 150 mmol/L ZnCl2 stress only. These results suggest that the cyanide-resistant respiration can function in alleviating the decrease of cell viability and oxidative stress under ZnCl2 stress and thus could be involved in the tolerance of plants to ZnCl2 stress.
Key words: cyanide-resistant respiration; cell viability; hydrogen peroxide; ZnCl2stress
锌(Zn)是植物生长发育必需的微量元素之一;然而,当环境中Zn元素的含量超过植物正常生长需要时就会导致植物生长发育及活力的下降[1]。目前,随着矿业开发和工业废水排放的增加,大量含Zn化合物进入水体及土壤环境中,从而对植物形成了Zn胁迫并造成了上述的不良影响[2]。因此,锌胁迫对植物的毒害作用以及植物对Zn胁迫的耐受机制已越来越引起人们的关注和重视。
研究发现,在锌、铜、镉等金属离子胁迫下,植物细胞活性氧水平上升,使细胞遭受氧化压力,从而导致植物细胞的损伤;而细胞基质中的SOD、CAT、POD 等抗氧化酶类则在抵抗这种氧化压力中起重要作用[3]。然而,除了上述细胞基质中的抗氧化酶类外,细胞的其他部位也存在清除活性氧或降低活性氧生成的机制。目前的研究发现,在植物线粒体呼吸链中存在着一条抗氰呼吸途径。该呼吸途径为交替氧化酶所催化,其运行可以使线粒体呼吸链中的电子直接从UQ库传递到氧分子,避免线粒体呼吸链的过度还原,因而限制线粒体活性氧的产生[4]。同时,由于线粒体活性氧是细胞活性氧的重要来源[5],因而抗氰呼吸途径具有降低细胞整体活性氧的功能[6-7]。然而,抗氰呼吸途径在Zn胁迫下是否也能够改变植物活性氧的生成或影响细胞的活力尚未见报道。
基于此,本文以烟草悬浮细胞BY-2为材料,探讨抗氰呼吸途径在Zn胁迫下对植物细胞过氧化氢和细胞活力的影响,以期进一步深化Zn胁迫植物的毒害作用以及植物对Zn胁迫的耐受机制。
1实验
1.1 材料培养
实验所用烟草悬浮细胞 (NicotianatabacumL. cv. Bright Yellow-2)在含有3%(W/V)蔗糖和0.4 mg/L的 2,4-二氯苯氧乙酸的MS(Murashige和Skoog)液体培养基中于黑暗下震荡培养生长(pH值5.8),培养温度为25 ℃。每隔7 d吸取培养的细胞悬液加入到新鲜的上述液体培养基中传代培养。
1.2实验处理
取进行传代培养3 d后的烟草悬浮细胞,过滤后称取鲜重,并用去离子水洗涤1~2次后进行以下处理。
ZnCl2的处理:分别用0、50、100、150或400 mmol/L的ZnCl2处理细胞5 h,以用去离子水处理的细胞作为对照。
过氧化氢的处理:分别用0、50、100、200、400 mmol/L的H2O2处理细胞5 h,以用去离子水处理的细胞作为对照。
H2O2清除剂的处理: 用5 mmol/L的DMTU(二甲基硫脲,过氧化氢清除剂)预处理细胞5 h后,再加入150 mmol/L的ZnCl2;以去离子水代替5 mmol/L的DMTU并进行上述同样处理的细胞作为对照。
抗氰呼吸抑制剂的处理:所用抗氰呼吸抑制剂为水杨基氧肟酸(SHAM)。用1 mmol/L的SHAM预处理细胞5 h后再置于150 mmol/L的ZnCl2下处理5 h;或用1 mmol/L的SHAM预处理细胞5 h后再置于去离子水中处理5 h。以不含SHAM的溶剂代替1 mmol/L的SHAM并进行上述同样处理的细胞以作为对比。
1.3悬浮培养烟草细胞活力的测定
细胞活力测定使用伊文思蓝染色法。在伊文思蓝存在下,正常具有活力的细胞因具有完整质膜而不会被伊文思蓝染色,而活力下降的细胞因为细胞膜的通透性增大而被伊文思蓝染色。故该法既可显示细胞活力又可表明细胞膜的受损程度。具体方法为:取处理后的细胞悬液加入0.025%的伊文思蓝溶液染色8 min后,在3 000 r/min下离心3 min,去除上清。在沉淀中加入1 mmol/L的磷酸缓冲液冲洗细胞沉淀.之后加入1%的十二烷基磺酸钠(SDS)(用50%甲醇配置)摇匀,于50 ℃水浴30 min使细胞裂解,之后在10 000 r/min下离心10 min,取上清,用分光光度计在595 nm处检测吸光值,即可表示为细胞的相对活力[8]。
1.4细胞抗氰呼吸水平的检测
抗氰呼吸途径的速率测定参照文献[9]所描述的方法进行:将处理后的细胞悬液置于测量杯中,在测量杯中加入氰化钾,并利用Clark氧电极(中国科学院上海植物生理生态研究所制)测量细胞的耗氧速率,所得值为抗氰呼吸途径的速率。
1.5 H2O2的含量检测
取处理后的细胞用5%(W/V)的三氯乙酸磨样,之后在12 000 r/min条件下离心10 min。取0.9 mL上清液与0.1 mL 0.1% (W/V) 硫酸钛形成的Ti- H2O2的复合物用20% (V/V) H2SO4溶解混匀,在405 nm下测定光吸收值,以H2O2标准曲线确定样品H2O2含量[10]。
1.6统计学分析
将结果表示为平均值±标准偏差(SD)。使用最小显著差数法(LSD)进行两两比较和显著性差异水平分析(P<0.05)。
2结果
2.1不同浓度ZnCl2胁迫下烟草悬浮细胞
BY-2的活力变化
50 mmol/L ZnCl2的处理导致烟草悬浮细胞活力的显著性降低(图1)。随着ZnCl2浓度的不断增加,烟草悬浮细胞的活力呈现下降趋势(图1)。在100 mmol/L ZnCl2处理下的细胞活力和150 mmol/L ZnCl2处理下的细胞活力无显著差异,但400 mmol/L ZnCl2处理使得细胞活力进一步降低(图1)。
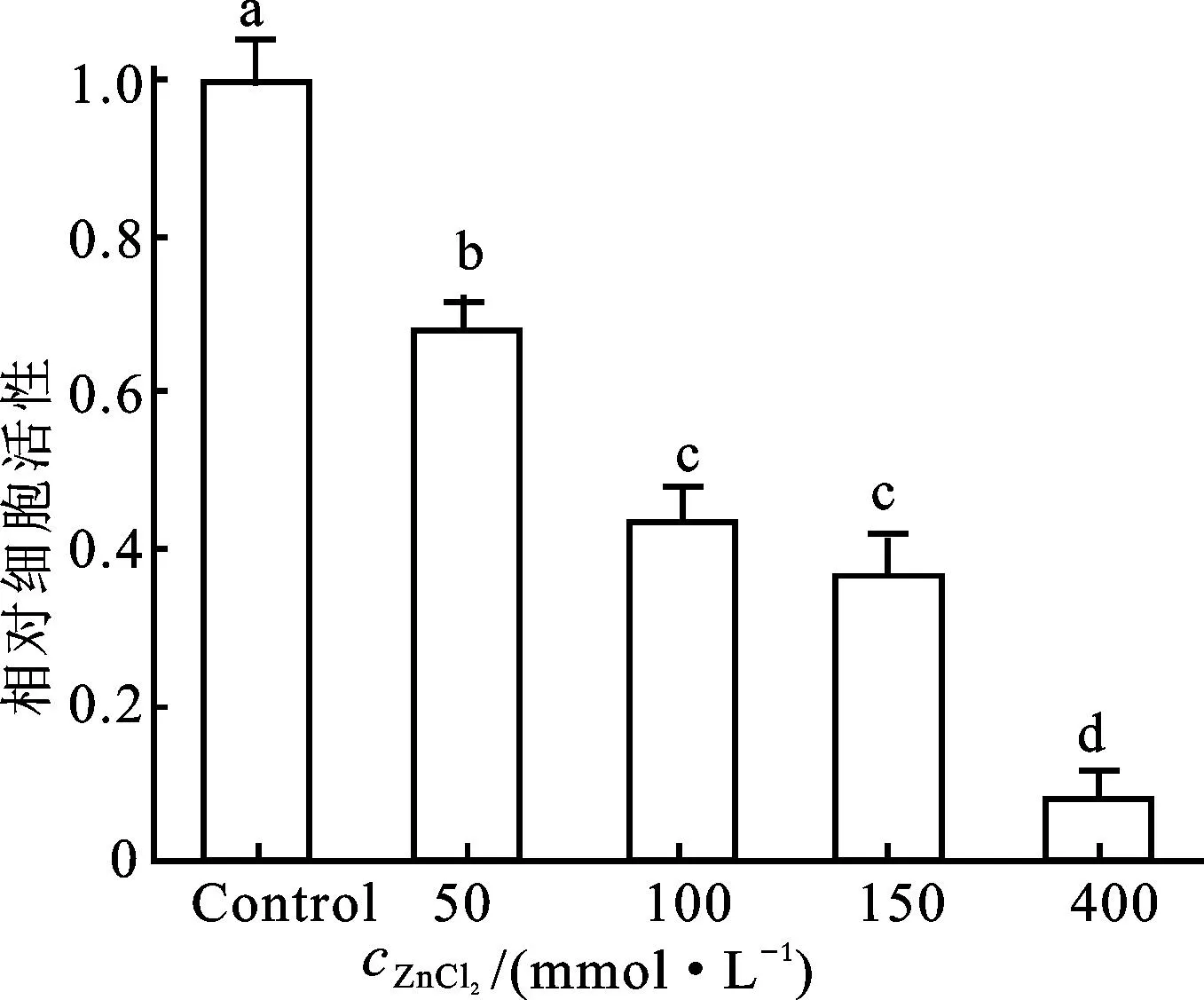
图1 ZnCl 2胁迫对细胞活力的影响
数值为6次平行实验的平均值±标准差。 以无ZnCl2处理的细胞作为对照(Control)并将对照值设为1.0。不同字母表示数值之间在P<0.05水平上具有显著性差异。
2.2不同浓度ZnCl2胁迫下烟草BY-2细胞
抗氰呼吸的变化
50 mmol/L ZnCl2的处理导致烟草悬浮细胞BY-2抗氰呼吸水平的上升,但和对照相比并不显著性(图 2)。在100 mmol/L ZnCl2处理下,悬浮细胞抗氰呼吸的水平显著性上升;在150 mmol/L和400 mmol/L ZnCl2处理下,悬浮细胞抗氰呼吸的水平进一步上升,但上升趋势趋于平缓(图2)。
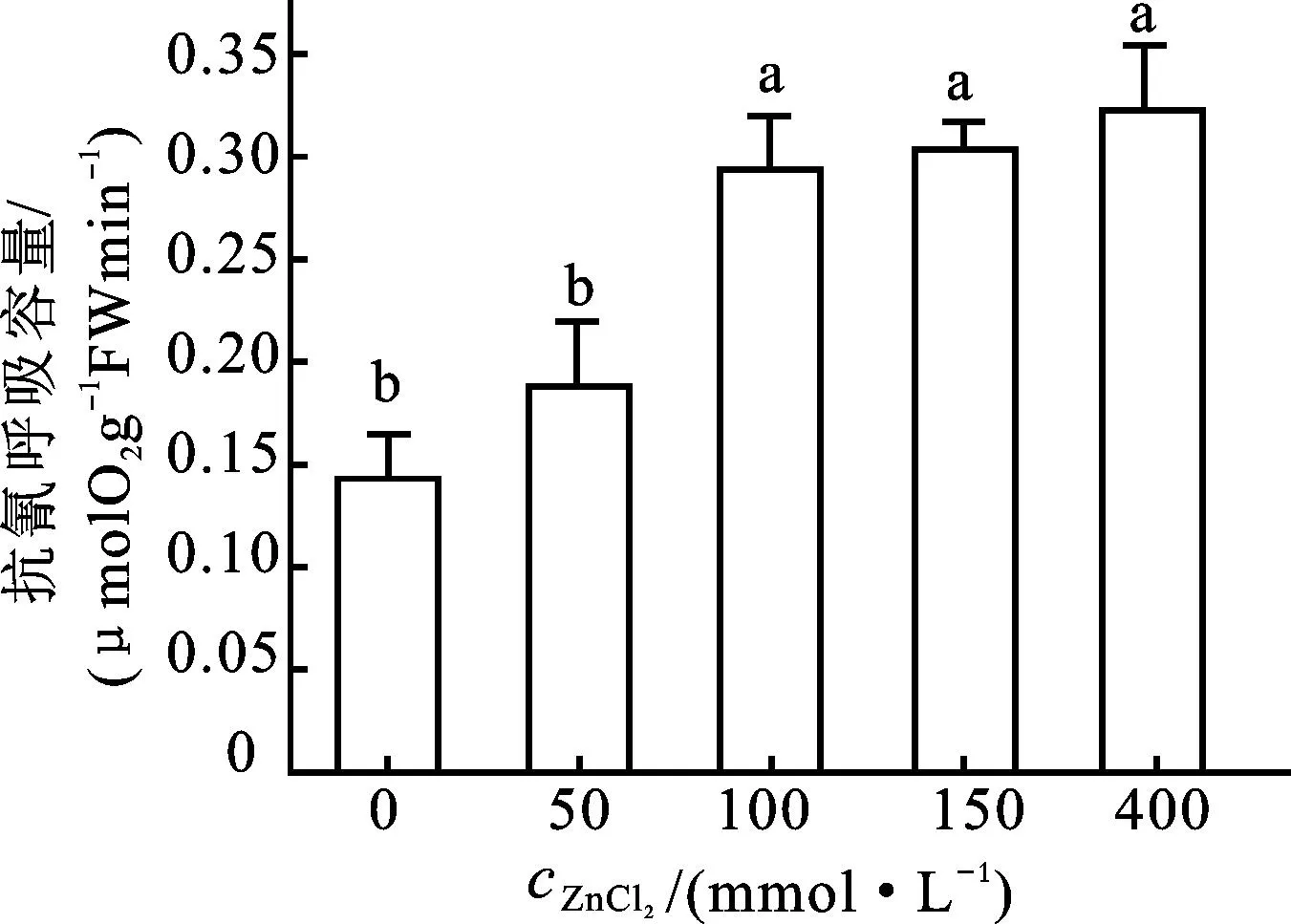
图2 ZnCl 2胁迫对细胞抗氰呼吸的影响
数值为至少3次实验的平均值±标准差。不同字母表示数值之间在P<0.05水平上具有显著性差异。
2.3ZnCl2胁迫下细胞活力的降低和
过氧化氢的上升有关
氧化压力能够引起细胞膜脂的过氧化、细胞膜的损伤乃至细胞活力的丧失[11]。我们首先在150 mmol/L ZnCl2胁迫下的细胞中检测过氧化氢的变化;发现较之对照,150 mmol/L ZnCl2胁迫导致细胞过氧化氢含量显著性增加(图3)。继而在烟草悬浮细胞中检测是否氧化压力的增加能改变细胞的活力。用不同浓度的过氧化氢(50、100、200、400 mmol/L)处理细胞后发现,细胞的活力随外源 H2O2浓度的增大而逐渐降低(图4),表明氧化压力的增加能够导致细胞活力的损失。
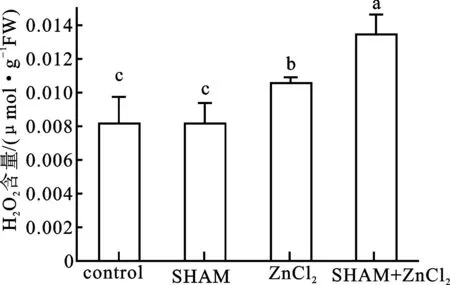
图3 不同处理对细胞过氧化氢水平的影响
将细胞分别置于1mmol/L SHAM (SHAM); 150 mmol/L ZnCl2(ZnCl2)、或1mmol/L SHAM与150 mmol/L ZnCl2的复合处理(SHAM+ZnCl2)下;以无化学试剂处理的细胞作为对照(Control)。数值为3次实验的平均值±标准差。不同字母表示数值之间在P<0.05水平上具有显著性差异。
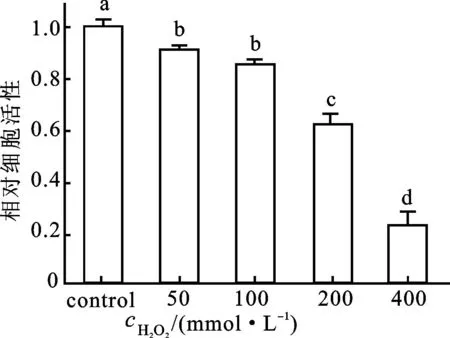
图4 过氧化氢对细胞活力的影响
数值为6次实验的平均值±标准差。不同字母表示数值之间在P<0.05水平上具有显著性差异。
用5 mmol/L的二甲基硫脲(过氧化氢消除剂,dimethylthiourea,DMTU)进一步研究ZnCl2胁迫下植物细胞活力的下降是否与H2O2的积累有关。实验发现,单独向细胞中加入DMTU对细胞死亡无显著性影响。而与单独ZnCl2胁迫的细胞相比,经过DMTU预处理的细胞再置于ZnCl2胁迫下细胞的活力较高,表明过氧化氢消除剂能够明显缓解ZnCl2胁迫下细胞活力的降低(图5)。
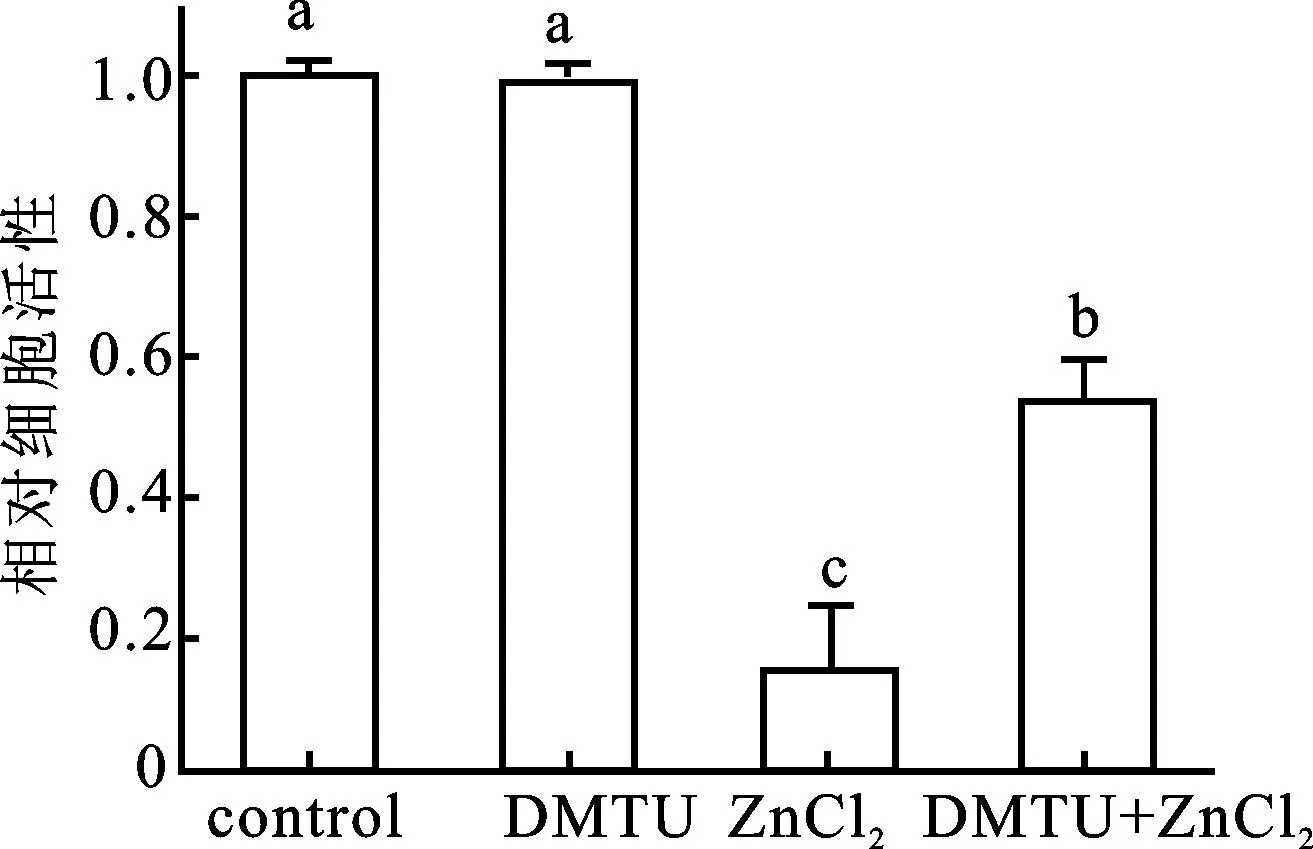
图5 不同处理对细胞死亡水平的影响
将细胞分别置于5 mmol/L的DMTU(DMTU); 150 mmol/L ZnCl2(ZnCl2)、或5 mmol/L DMTU与150 mmol/L的ZnCl2的复合处理(DMTU+ZnCl2)下;以去离子水处理的细胞作为对照(Control)并将对照值设为1.0。数值为4次平行实验的平均值±标准差。不同字母表示数值之间在P<0.05水平上具有显著性差异。
2.4抗氰呼吸对ZnCl2胁迫下细胞活力和
过氧化氢产生的调节
我们利用抗氰呼吸的抑制剂SHAM(水杨基氧肟酸)进一步研究在ZnCl2胁迫下细胞过氧化氢的变化是否和抗氰呼吸具有一定的关系。结果显示,在无ZnCl2胁迫的情况下,1 mmol/L SHAM并没有对细胞过氧化氢的水平造成显著性影响。而经1 mmol/L SHAM预处理后再被150 mmol/L ZnCl2胁迫的细胞的过氧化氢水平则显著高于150 mmol/L ZnCl2单独处理的细胞的过氧化氢水平(图3),说明在 ZnCl2胁迫下抗氰呼吸的抑制会导致细胞氧化压力的进一步增加。
同时我们研究了在ZnCl2胁迫下细胞活力的变化是否和抗氰呼吸有关。相似于过氧化氢的变化,在无ZnCl2胁迫的情况下,1 mmol/L SHAM并没有对细胞的活力造成显著性影响;而经1 mmol/L SHAM预处理后再被150 mmol/L ZnCl2胁迫的细胞活力明显低于ZnCl2单独处理的细胞活力(图6)。说明在 ZnCl2胁迫下抗氰呼吸的抑制会导致细胞活力的进一步下降。
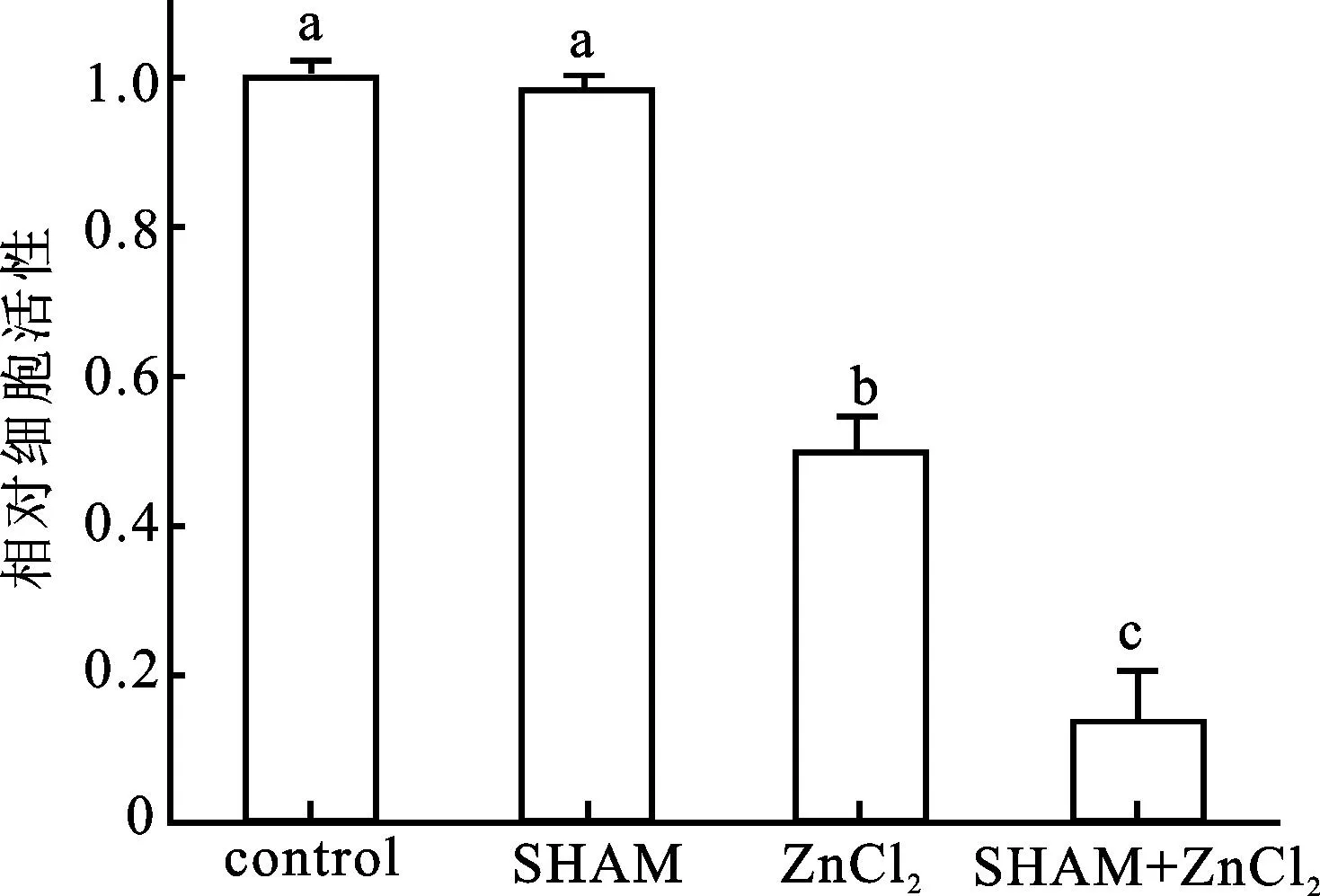
图6 不同处理对细胞活力水平的影响
将细胞分别置于1 mmol/L 的SHAM (SHAM); 150 mmol/L的ZnCl2(ZnCl2)、或1 mmol/L SHAM与150 mmol/L ZnCl2的复合处理(SHAM+ZnCl2)下;以无化学试剂处理的细胞作为对照(Control)并将对照值设为1.0。数值为6次实验的平均值±标准差。不同字母表示数值之间在P<0.05水平上具有显著性差异。
3 讨论
Youssef和Azooz[12]的研究显示,过多的Zn2+会导致植物生长受到抑制。而本文研究表明,ZnCl2胁迫导致细胞活力的下降(图 1),提示前人所观察的过多Zn2+所导致的植物生长抑制可能是细胞活力下降所致。在高盐、低温、干旱等胁迫下,植物抗氰呼吸途径的水平通常有所上升,并且抗氰呼吸途径被发现可以通过调整植物代谢、降低氧化压力等多种方式来缓解上述逆境胁迫对植物造成的不良影响[8]。而我们的工作显示,细胞抗氰呼吸的水平随着ZnCl2胁迫水平的增加而呈现上升趋势(图2),显示抗氰呼吸途径能够被Zn胁迫所诱导的特性。
Youssef和Azooz[12]认为,过多的Zn2+干扰了植物生长和发育过程中正常的代谢过程。而我们的研究显示,较高水平ZnCl2(150 mmol/L)胁迫导致细胞体内过氧化氢水平的上升(图3)。而有研究表明,金属离子胁迫通常会引起植物细胞活性氧水平上升,使细胞遭受氧化压力,从而导致植物细胞膜脂的过氧化、细胞膜损伤乃至细胞死亡[3]。而本研究发现,和ZnCl2胁迫对植物细胞的影响相似,外源加入过氧化氢也可诱导细胞活力的下降(图4)。并且,过氧化氢消除剂能够明显缓解ZnCl2胁迫下细胞活力的降低(图5)。这些观察表明,ZnCl2胁迫可能是通过增加植物的氧化压力而导致植物细胞活力的下降。
从适应性角度讲,如果氧化压力是Zn胁迫导致植物细胞活力下降的重要原因,那么在Zn胁迫下,植物细胞中就应该激活一些缓解或降低氧化压力的防御机制。有研究发现,抗氰呼吸途径具有降低细胞整体活性氧的功能[6-7]。本研究显示,在150 mmol/L ZnCl2胁迫下抗氰呼吸途径的抑制导致细胞过氧化氢水平的进一步上升以及细胞活力的进一步下降(图3和6),表明在ZnCl2胁迫下抗氰呼吸途径的上升具有缓解氧化压力和维持细胞活力的生理学功能,因而可能是细胞抵御外界Zn胁迫的一种生理学反应。从目前的理论看,植物细胞活性氧的过度产生会引起膜脂的过氧化、细胞膜的损伤和细胞活力的降低[11-12],同时考虑ZnCl2胁迫下过氧化氢的产生可能是导致细胞活力降低的原因, 因而抗氰呼吸途径可能是通过限制细胞活性氧的产生从而缓解ZnCl2胁迫下细胞活力的下降。
4结论
抗氰呼吸可以缓解ZnCl2胁迫下细胞的氧化压力和细胞活力的下降,表明抗氰呼吸在植物细胞抵抗Zn胁迫中扮演一定的角色。这一观察有助于扩展目前对于抗氰呼吸功能的认知,也有助于进一步了解植物耐受Zn胁迫的生理学机制。
致谢:实验所用烟草悬浮细胞由香港大学姜里文教授提供。
参考文献:
[1] 龚红梅, 李卫国. 锌对植物的毒害及机理研究进展[J]. 安徽农业科学, 2009, 37(29): 14009-14015.
[2] Nagajyoti P C, Lee K D, Sreekanth T V M. Heavy metals,occurrence and toxicity for plants:a review[J]. Environmental Chemistry Letters, 2010, 8(3): 199-216.
[3] Sytar O, Kumar A, Latowski D, et al. Heavy metal-induced oxidative damage,defense reactions, and detoxification mechanisms in plants[J]. Acta Physiologiae Plantarum, 2013, 35(4): 985-999.
[4] Millenaar F F, Lambers H. The alternative oxidase: in vivo regulation and function[J]. Plant Biology, 2003, 5(1): 2-15.
[5] Boveris A, Cadenas E. Cellular sources and steady-state levels of reactive oxygen species[M]∥Clerch L B, Mazzaro D J. Oxygen, gene expression, and cellular function.New York: Marcel Dekker, Inc., 1997: 1-25.
[6] Amirsadeghi S, Robson C A, McDonald A E, et al. Changes in plant mitochondrial electron transport alter cellular levels of reactive oxygen species and susceptibility to cell death signaling molecules[J]. Plant & Cell Physiology, 2006, 47: 1509-1519.
[7] MizunoM, Tada Y, Uchii K, et al. Catalase and alternative oxidase cooperatively regulate programmed cell death induced by beta-glucan elicitor in potato suspension cultures[J].Planta, 2005, 220(6): 849-853.
[8] Yang S W,Kim S K,Kim W T. Perturbation ofNgTRF1 expression induces apoptosis-like cell death in tobacco BY-2 cells and implicatesNgTRF1 in the control of telomere length and stability[J]. The Plant Cell, 2004, 16(12): 3370-3385.
[9] Bingham I J, Farrar J F. Activity and capacity of respiratory pathways in barley roots deprived of inorganic nutrients[J]. Plant Physiology and Biochemistry, 1989, 27: 847-854.
[10] Patterson B D, MacRae E A, Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium (IV)[J]. Analytical Biochemistry, 1984, 139(2): 487-492.
[11] Circu M L, Aw T Y. Reactive oxygen species, cellular redox systems, and apoptosis[J]. Free Radical Biology and Medicine, 2010, 48(6): 749-762.
[12] Youssef M M, Azooz M M. Biochemical studies on the effects of Zinc and lead on oxidative stress, antioxidant enzymes and lipid peroxidation in Okra(Hibiscusesculentuscv.Hassawi)[J]. Science International,2013, 1(3): 29-38.
[13] Feng Hanqing, Guan Dongdong, Sun Kun, et al. Expression and signal regulation of the alternative oxidase genes under abiotic stresses[J]. Acta Biochimica et Biophysica Sinica, 2013, 45(12): 985-994.
〔责任编辑王勇〕
第一作者:奉艳,女,硕士研究生,研究方向为肿瘤相关基因。E-mail:fengyan0212@126.com
*通信作者:侯颖春,男,教授,博士生导师。E-mail:ychhou@snnu.edu.cn

