蜻蜓凤梨AfWIN1基因的克隆及表达特性
雷 明,王加宾,丛汉卿,李志英,徐 立
(中国热带农业科学院热带作物品种资源研究所/农业部华南作物基因资源与种质创新重点实验室,海南儋州571737)
蜻蜓凤梨AfWIN1基因的克隆及表达特性
雷 明,王加宾,丛汉卿,李志英,徐 立*
(中国热带农业科学院热带作物品种资源研究所/农业部华南作物基因资源与种质创新重点实验室,海南儋州571737)
为利用基因工程手段调控凤梨科植物生长发育奠定基础,基于转录组数据,利用cDNA末端快速扩增(rapid amplification of cDNA ends,RACE)技术从蜻蜓凤梨中克隆APETALA2/Ethylene Response Element Binding Protein(AP2/EREBP)家族的1个转录因子编码序列AfWIN1,并通过在线软件预测其亚细胞定位,利用实时荧光定量PCR(qRT-PCR)方法分析其转录本表达量,且利用染色体步移方法分离其启动子序列。结果表明:AfWIN1cDNA全长995bp,含有1个501bp的开放阅读框(open reading frame,ORF),编码166个氨基酸残基;AfWIN1定位于细胞核的碱性亲水蛋白;AfWIN1的转录本表达量随着植株年龄的增长逐渐上调,但在花器官中表达量很低甚至检测不到;AfWIN1基因5′端上游的调控序列中包含较多响应激素的顺式元件;AfWIN1在幼株和成株心叶中对乙烯响应的方式不尽相同,可能参与蜻蜓凤梨营养生长过程,但不调控花器官发育。
蜻蜓凤梨;热带花卉;AfWIN1;转录因子;乙烯
凤梨科植物(Bromeliaceae)原产于南美,包含58个属,3 000多个种,是广泛分布于新热带区的形态最为多样的一类植物[1-2]。人工栽培种中,除食用凤梨(菠萝,Ananas comosus)外,还有观赏凤梨。观赏凤梨又统称菠萝花,品种繁多,株型优美,花型奇特,花期长达2~6个月,已成为国内外市场上十分畅销的热带花卉之一[3-4]。
AP2/EREBP(APETALA2/Ethylene Responsive Element Binding Protein)转录因子是最大的转录因子家族之一[5]。AP2/EREBP转录因子首次报道发现于拟南芥,其中1个AP2基因参与了花器官和种子的发育[6],后来在烟草中也发现ethylene-responsive element-binding proteins 1-4(EREBP1-4,又分别重命名为ERF1-4)均具有保守的ERF结构域,结合共有的一类顺式元件[7]。以前认为AP2/EREBP为植物所特有,现已发现其也存在于原生生物、蓝藻和真菌中[8-9]。AP2/EREBP转录因子均具有至少1个由约60个氨基酸组成的AP2/ERF结构域[10-11]。根据所含AP2/ERF结构域数目以及其他一些结构上的不同,AP2/EREBP转录因子可以分为AP2、ERF和RAV 3个亚族。其中,AP2亚族含有2个AP2结构域,RAV亚族含有1个AP2结构域和1个B3结构域,而ERF亚族则只含有1个AP2结构域[11]。AP2/EREBP转录因子在生物转录水平的调控中扮演重要角色[12],而作为AP2/EREBP转录因子家族中成员最多的一个亚族,ERF响应茉莉酸(jasmonate acid,JA)、脱落酸(abscisic acid,ABA)等激素以及干旱、高盐、冷、疾病、洪涝等多种生物和非生物胁迫的调控[5,12]。
根据结合DNA序列的不同,ERF亚族又被分为ERF和CBF/DREB 2类[11]。ERF类主要结合AGCCGCC(GCC box)顺式元件调控靶标基因的表达,CBF/DREB类主要结合靶标基因启动子区的A/GCCGAC(DRE/CRT/LTRE)核心顺式元件[11]。进一步研究发现,一些ERF类转录因子也可以识别DRE/CRT元件响应非生物胁迫[13],另一些ERFs则可同时结合GCC box和DRE/CRT元件,调控靶标基因的表达[14]。为了更准确地预测鉴定ERF亚族成员的功能,Nakano等[15]根据结构和进化树分析结果将拟南芥和水稻中所有的ERFs分别分成了12大类和15大类,一些大类中又进一步分出了小类。目前,关于观赏凤梨AP2/EREBP家族转录因子功能的研究较少。本研究基于前期转录组数据结合cDNA末端快速扩增(rapid amplification of cDNA ends,RACE)技术,从观赏凤梨的蜻蜓凤梨(Aechemia fasciata)中克隆到ERF亚族的编码基因AfWIN1,实时荧光定量PCR(qRTPCR)鉴定AfWIN1在蜻蜓凤梨营养生长过程中的基本功能,以丰富凤梨科植物AP2/EREBP转录因子,为基因工程手段调控凤梨科植物生长发育奠定基础。
1材料与方法
1.1材料
蜻蜓凤梨幼株为试管苗移栽后株龄6个月植株,成株为试管苗移栽成活后株龄11~14个月植株,繁于中国热带农业科学院热带作物品种资源研究所离体保存与繁育研究室大棚(30~32℃)。
1.2乙烯利灌心
取10mL浓度为400μL/L的乙烯利灌心分别处理1h、6h、24h,以清水灌心的材料为对照。处理后的材料迅速取下置于液氮中冷冻,-80℃保存备用。
1.3总RNA提取及cDNA第1条链的合成
采用改良CTAB法提取蜻蜓凤梨总RNA[16]。cDNA第1条链的合成采用试剂盒(TranScript-Uni One-Step gDNA Removal and cDNA Synthesis SuperMix Kit,Transgene)。
1.4 5′和3′RACE扩增
采用试剂盒(SMARTerTMRACE cDNA Amplification Kit,Takara)进行目的基因的5′和3′RACE扩增,具体步骤参照说明书。所用引物见表1。采用OMEGA(Omega)的胶回收试剂盒回收PCR扩增得到的特异性条带。纯化后的特异条带连接到pEASY-blunt(Transgene)克隆载体上,测序。
1.5启动子克隆及qRT-PCR
1.5.1启动子克隆 在cDNA序列的基础上,根据ORF首尾序列设计引物从基因组中扩增Af-WIN1基因全序列,在此基础上,采用试剂盒(Genome walking kit,Takara)进行启动子克隆。所用引物见表1。
1.5.2qRT-PCR运用Primer premier 5.0设计用于qRT-PCR的各基因特异引物。选用试剂盒(TransStart Tip Green qPCR SuperMix,Transgene)进行PCR反应,在Therma PikoReal 96TM荧光定量PCR仪(Thermo Fisher Scientific)上进行。反应体系(10μL):qRT-PCR混合反应液SuperMix 5μL,模板1μL,正反向引物各0.3μL,灭菌去离子水补齐至10μL。反应程序:95℃预变性7min,然后在95℃变性5s、60℃退火30s的条件下扩增40个循环,循环结束后65℃延伸30s,20℃停止。每个样品2个生物学重复,3次技术重复。数据分析采用双delta法,综合分析后选取蜻蜓凤梨的β-actin (AfACTB)为内参。通过制作标准曲线获得目的基因和内参基因的扩增效率。所用引物见表1。
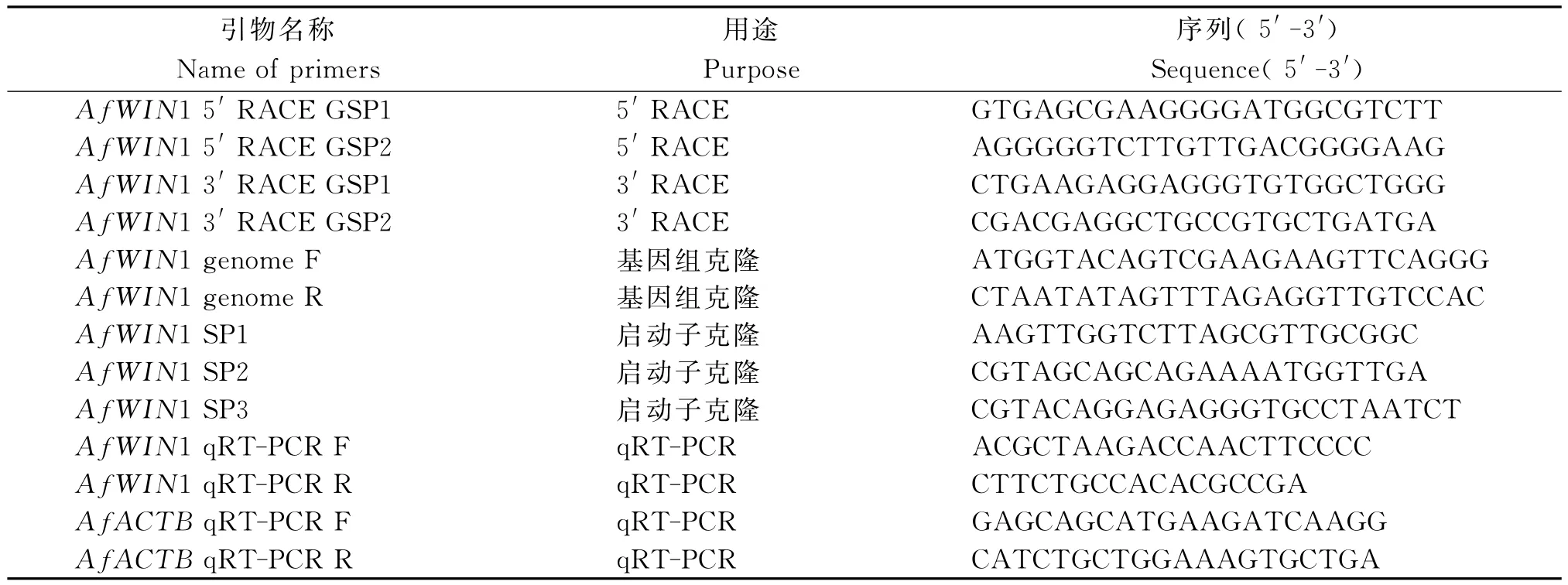
表1 启动子克隆及qRT-PCR各步骤所用的引物Table 1 Primers used in promoter cloning and qRT-PCR
1.6生物信息学分析
利用DNAMAN 6.0软件进行氨基酸序列的同源性比对,利用MEGA 6.0软件和邻接法进行进化树构建[17],其他生物信息学分析软件见表2。

表2 试验所用的生物在线软件Table 2 Online software used in this study
2结果与分析
2.1 AfWIN1cDNA全长的克隆与序列
经cDNA末端快速扩增结合PCR技术获得1条长度为995bp的cDNA序列。该cDNA序列有1个501bp的开放阅读框(open reading frame,ORF),编码166个氨基酸残基。保守结构域分析发现,cDNA编码的氨基酸序列具有1个典型的AP2结构域(图1),BLAST发现其与很多植物中AP2/EREBP家族ERF亚族的WIN或WIN-like蛋白具有很高的相似性,故将其命名为AfWIN1。
对AfWIN1基因组序列分析发现,AfWIN1基因组的第1个外显子编码序列与拟南芥(Arabidopsis thaliana)的WIN1、大豆(Glycine max)的SHN3和SHN4相同,均为80bp(图2)。此外,与水稻(Oryza sativaJaponica Group)、拟南芥等物种中较多WIN同源基因只含有1个内含子的结构不同,AfWIN1的基因含有2个内含子,类似于大豆中的SHN3和SHN4(图2),暗示AfWIN1功能上可能有变异。
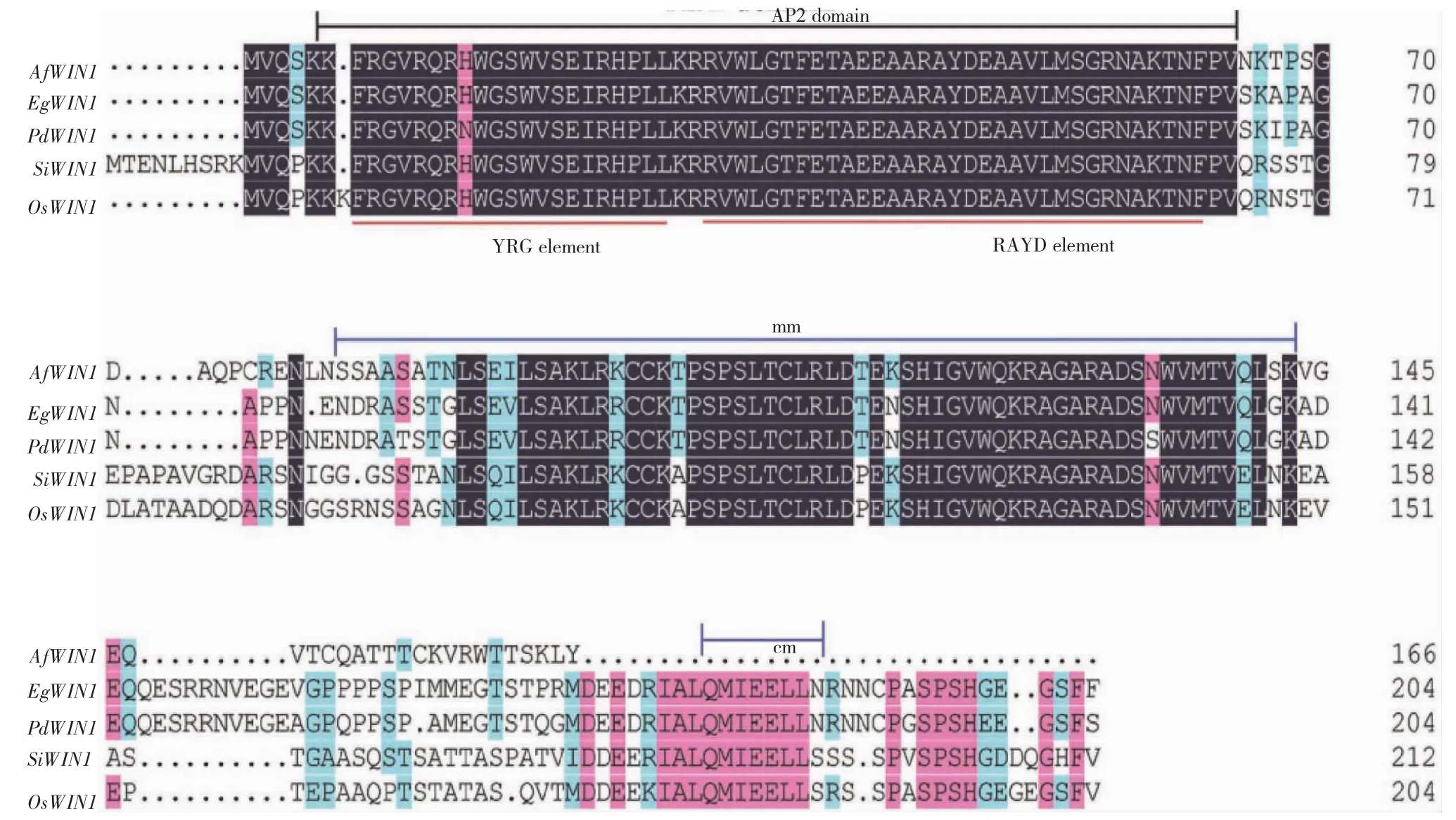
图1 AfWIN1的同源性比对Fig.1 Comparison of AfWIN1homology
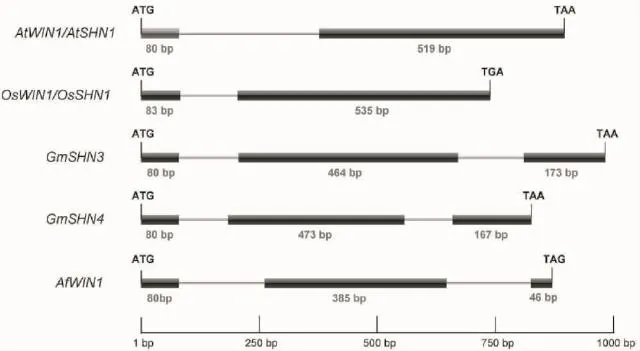
图2 AfWIN1基因序列的结构示意图Fig.2 The schematic diagram of AfWIN1gene sequence
2.2 AfWIN1属于ERF亚族的Va类
序列同源性比对结果表明,AfWIN1与水稻的WIN同源性最高,达60.98%,与小米(Setaria italica,Si)的WIN1同源性相对最低,为55.87%(图1),表明AfWIN1在进化上比较保守。此外,将水稻ERF全部15类中代表性的蛋白与AfWIN1构建进化树,AfWIN1聚类于水稻的Va类蛋白家族(图3)。
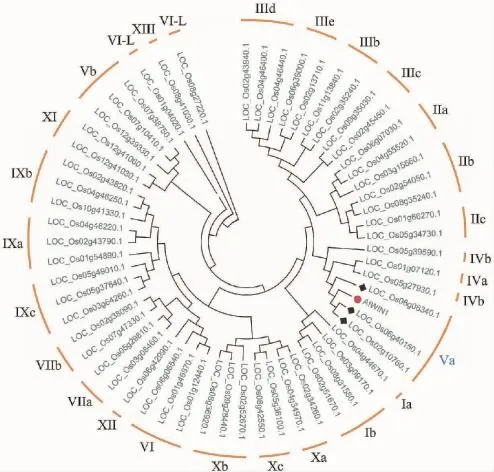
图3 AfWIN1的进化树Fig.3 The cladogram of AfWIN1
2.3AfWIN1的组织表达特异性
由图4可见,蜻蜓凤梨成株和幼株各组织中AfWIN1的转录本表达量存在差异。随着植株年龄的增长,外叶、心叶、茎和根中AfWIN1的转录本表达量均逐渐上升(图4A)。检测开花39d后的蜻蜓凤梨花器官表明,除总苞外,AfWIN1在其他花器官中的相对表达量均较低,在雄蕊和雌蕊中未检测到(图4B)。
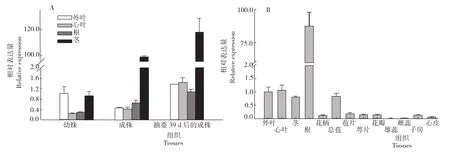
图4 AfWIN1在蜻蜓凤梨各组织中的相对表达量Fig.4 Relative expression of AfWIN1in different tissues of Aechemia fasciata
2.4外源乙烯处理后AfWIN1的响应
由图5可见,AfWIN1的启动子序列上具有很多激素或胁迫响应元件,但并未见直接响应乙烯的元件。由图6可见,乙烯利灌心后蜻蜓凤梨幼株和成株心叶中AfWIN1转录本表达量。幼株处理1h后,AfWIN1在心叶中的表达量显著上调,而在处理6h、24h后又恢复到初始水平;成株中,AfWIN1在乙烯利处理1h、6h一直上调,但24h恢复至6h时的水平。AfWIN1在蜻蜓凤梨幼株和成株心叶中对外源乙烯利处理响应模式的不同暗示AfWIN1受不同因子或(和)不同机制的调控。
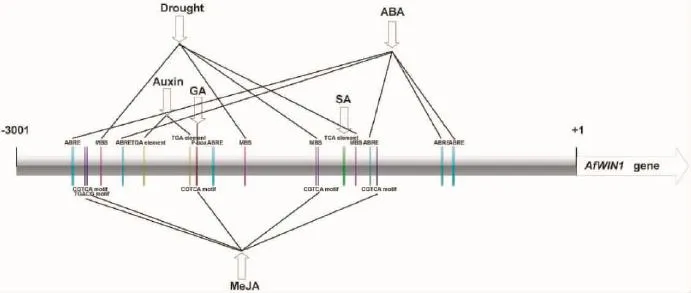
图5 AfWIN1启动子序列的顺式元件示意图Fig.5 The cis-elements schematic diagram of AfWIN1promoter sequence

图6 AfWIN1在外源乙烯利处理后幼株和成株心叶中的相对表达量Fig.6 Relative expression of AfWIN1in central leaves of juvenile and adult plants of Aechemia fasciatatreated with ethylene
3结论与讨论
目前,有关凤梨科植物生长发育调控分子机理的研究多集中在开花方面。沉默掉乙烯合成过程中关键酶ACC合成酶(1-amino-cyclopropane-1-carboxylate synthase)的编码基因ACACS2后,菠萝开花时间显著延迟[18]。Li等[19]通过对乙烯处理蜻蜓凤梨的比较转录组分析发现,AP2/EREBP家族的一些基因响应乙烯且可能调控开花。Lei等[20]则发现,蜻蜓凤梨AP2亚族的1个AfAP2-1基因在拟南芥中过表达后显著延迟开花。此外,将菠萝的1 个Flowering Locus T(FT)基因在拟南芥中过表达后也使得转基因株系开花时间提前[21]。在拟南芥中过表达菠萝的1个花器官决定同源基因PISTILLATA(PI)则使得转基因植株开花时间提前,叶片增大,花序增多,但未见明显的花器官变异[22]。随着菠萝基因组测序工作的完成,有关菠萝乃至凤梨科植物包括开花在内的生长发育调控分子机理的研究将越来越深入[23-24]。
有关WIN1同源基因功能的研究在多种物种中均有报道。拟南芥的SHN1/WIN1过表达后促进了蜡质的合成、改变了角质层的特性且赋予了植株更高的耐旱性[25-26]。与此类似,在苜蓿(Medicago sativa)中过表达1个WIN1的同源基因WXP1后也增加了叶片表皮的蜡质合成,且提高了转基因植株的耐旱性[27]。此外,在拟南芥中过表达大豆的GmSHN1和GmSHN9则同样调控蜡质和角质的合成,改变角质特性,且使得叶型产生变化[28]。本研究结果表明,AfWIN1在基因组结构上类似于GmSHN3和GmSHN4,都含2个内含子。Gm-SHN3和GmSHN4在大豆的花瓣和豆荚中有高表达[28],但AfWIN1则在根中表达量最高,而在所有检测花器官的总苞中表达量相对较高,表明Af-WIN1虽然在基因结构上类似于GmSHN3和Gm-SHN4,但可能功能有异。这一点从AfWIN1在幼株、成株和抽薹39d成株的外叶、心叶、茎和根中表达量差异也可看出。随着蜻蜓凤梨株龄的增长,AfWIN1转录本的相对表达量逐渐上调,暗示Af-WIN1可能参与蜻蜓凤梨营养生长的调控。
根据进化树分析结果,AfWIN1归属Va类,但序列比对后发现,AfWIN1含有1个典型的AP2结构域,同时也含有1个保守的中间基序(middle motif,mm),但缺少C端基序(C-terminal motif,cm)。已知C端基序是转录激活结构域的核心组分[29],因此,AfWIN1虽然预测定位于细胞核,但可能并不是1个转录激活因子,这也可能使其进化为有别于目前已经报道WIN1/SHN1同源蛋白的新功能,因此,未来通过在酵母中检测其是否具有自激活能力则显得很有必要。
过表达WIN1同源基因在很多物种中均提高了对干旱的耐受性[25,27,30]。本研究对AfWIN1 3001bp的启动子序列分析发现,除大量的光响应元件外,该启动子区含有多个干旱响应元件TAACTG,暗示其可能响应干旱胁迫。此外,一些WIN1同源基因也响应了植物激素如ABA以及冷胁迫的处理[27,29]。AfWIN1基因启动子区的确也含有多种激素,如生长素(Auxin)、赤霉素(gibberellin acid,GA)、ABA、水杨酸(salicylic acid,SA)以及JA的响应元件,但并未见有关响应冷胁迫的顺式元件,未来还需要更多的试验验证AfWIN1对各种激素和非生物胁迫的响应机理。此外,尽管AfWIN1启动子区并不含有乙烯响应元件,但本研究结果表明,AfWIN1对外源乙烯处理可迅速响应,但在幼株和成株中响应的幅度和快慢不尽相同。已知很多ERF基因参与了JA和ETH的交叉信号路径[3134],因此,ETH很可能通过其他交叉因子调控AfWIN1的表达。
本研究通过对AfWIN1的克隆以及相关表达特性的分析,初步验证AfWIN1可能参与蜻蜓凤梨营养生长的调控,未来可通过过表达和基因沉默技术进一步验证AfWIN1的基本功能,为通过基因工程手段调控凤梨科植物生长发育奠定理论基础。
[1]LUTHER H E.An alphabetical list of bromeliad binomials[M].Florida:The Bromeliad Society International,2010:4.
[2]VERSIEUX L M,BARBARA T,WANDERLEY M,et al.Molecular phylogenetics of the Brazilian giant bromeliads(Alcantarea,Bromeliaceae):implications for morphological evolution and biogeography[J].Molecular Phylogenetic Evolution,2012,64(1),177-189.
[3]何业华,胡中沂,马 均,等.凤梨类植物的种质资源与分类[J].经济林研究,2009,27(3):102-107.
[4]彭筱娜,易自力,蒋建雄,等.观赏凤梨组织培养中防止外植体褐化的初步研究[J].湖南农业科学,2007 (4):67-69.
[5]MIZOI J,SHINOZAK K,YAMAGUCHIi-SHINZAKI K.AP2/ERF family transcription factors in plant abiotic stress responses[J].Biochimica et Biophysica Acta,2012(2):86-96.
[6]JOFUKU K D,DEN BOER B G,VAN MONTAGU M,et al.Control of Arabidopsis flower and seed development by the homeotic gene APETALA2[J].The Plant Cell,1994,6(9):1211-1225.
[7]OHME-TAKAGI M,Shinshi H.Ethylene-inducible DNA binding proteins that interact with an ethyleneresponsive element[J].The Plant Cell,1995,7:173-182.
[8]WESSLER S R.Homing into the origin of the AP2 DNA binding domain[J].Trends in Plant Science,2005,10(2):54-56.
[9]LICAUSI F,OHME-TAKAGI M,PERATA P.APETALA2/Ethylene Responsive Factor(AP2/ERF)transcription factors:mediators of stress responses and developmental programs[J].The New Phytologist,2013,199(3):639-649.
[10]RIECHMANN J L,MEYEROWITZ E M.The AP2/EREBP family of plant transcription factors[J].Biological Chemistry,1998,379(6):633-646.
[11]SAKUMA Y,LIU Q,DUBOUZET J G,et al.DNA-binding specificity of the ERF/AP2domain of Arabidopsis DREBs,transcription factors involved in dehydration and cold-inducible gene expression[J].Biochemical and Biophysical Research Communications,2002,290(3):998-1009.
[12]MUHAMMAD R,HE G,YANG G,et al.AP2/ERFtranscription factor in rice:genome-wide canvas and syntenic relationships between monocots and eudicots [J].Evolutionary Bioinformatics,2012,8:321-355.
[13]MCGRATH K C.Repressor-and activator-type ethylene response factors functioning in jasmonate signaling and disease resistance identified via a genomewide screen of Arabidopsis transcription factor gene expression[J].Plant Physiology,2005,139(2):949-959.
[14]CHENG M C,LIAO P M,KUO W W,et al.The Arabidopsis ETHYLENE RESPONSE FACTOR1regulates abiotic stress-responsive gene expression by binding to different cis-acting elements in response to different stress signals[J].Plant Physiology,2013,162(3):1566-1582.
[15]NAKANO T,SUZUKI K,FUJIMURA T,et al.Genome-wide analysis of the ERF gene family in Arabidopsis and rice[J].Plant Physiology,2006,140(2):411-32.
[16]丛汉卿,信彩云,张银东,等.‘阿蒂擎天’凤梨谷胱甘肽-S-转移酶基因的克隆与乙烯诱导表达特性的初步分析[J].分子植物育种,2013,11(3):365-370.
[17]TAMURA K,STECHER G,PETERSON D,et al.MEGA6:Molecular evolutionary genetics analysis version 6.0[J].Molecular Biology and Evolution,2013,30(12):2725-2729.
[18]TRUSOV Y,BOTELLA J R.Silencing of the ACC synthase gene ACACS2causes delayed flowering in pineapple[Ananas comosus(L.)Merr.][J].Journal of Experimental Botany,2006,57(14):3953-3960.
[19]LI Z,WANG J,ZHANG X,et al.Transcriptome sequencing determined flowering pathway genes in Aechmea fasciata treated with ethylene[J].Journal of Plant Growth Regulation,2015.
[20]Lei M,Li Z Y,Wang J B,et al.AfAP2-1,an age-dependent gene of Aechmea fasciata,responds to exogenous ethylene treatment[J].International journal of molecular sciences,2016,17,(303).
[21]LV L L,DUAN J,XIE J,et al.Isolation and characterization of a FLOWERING LOCUS T homolog from pineapple(Ananas comosus(L.)Merr)[J].Gene,2012,505(2):368-373.
[22]LV L L,DUAN J,XIE J H,et al.Cloning and expression analysis of a PISTILLATAhomologous gene from pineapple(Ananas comosus L.Merr)[J].International Journal of Molecular Sciences,2012,13(1):1039-1053.
[23]MING R,VAN Buren R,WAI C M,et al.The pineapple genome and the evolution of CAM photosynthesis [J].Nature Genetics,2015,47(12):1435-1442.
[24]LIU C H,FAN C.De novo transcriptome assembly of floral buds of pineapple and identification of differentially expressed genes in response to ethephon induction[J].Frontiers in Plant Science,2016,7:203.
[25]AHARONI A,DIXIT S,JETTEER R,et al.The SHINE clade of AP2domain transcription factors activates wax biosynthesis,alters cuticle properties,and confers drought tolerance when overexpressed in Arabidopsis[J].The Plant Cell,2004,16(9):2463-2480.
[26]BROUN P,POINDEXTER P,OSBOME E,et al.WIN1,a transcriptional activator of epidermal wax accumulation in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(13):4706-4711.
[27]ZHANG J Y,BROECKLING C D,BLANCAFLOR E B,et al.Overexpression of WXP1,aputative Medicago truncatula AP2domain-containing transcription factor gene,increases cuticular wax accumulation and enhances drought tolerance in transgenic alfalfa (Medicago sativa)[J].The Plant Journal,2005,42 (5):689-707.
[28]XU Y,WU H,ZHAO M,et al.Overexpression of the transcription factors GmSHN1and GmSHN9differentially regulates wax and cutin biosynthesis,alters cuticle properties,and changes leaf phenotypes in Arabidopsis[J].International Journal of Molecular Sciences,2016,17(4):587.
[29]DJEMAL R,KHOUDI H.Isolation and molecular characterization of a novel WIN1/SHN1ethylene-responsive transcription factor TdSHN1from durum wheat(Triticum turgidum.L.subsp.durum)[J].Protoplasma,2015,252(6):1461-1473.
[30]YANG J,ISABEL ORDIZ M,JAWORSKI J G,et al.Induced accumulation of cuticular waxes enhances drought tolerance in Arabidopsis by changes in development of stomata[J].Plant Physiology and Biochemistry,2011,49(12):1448-1455.
[31]LORENZO O,PQUERAS R,SANCHEZ-SERRANO J J,et al.ETHYLENE RESPONSE FACTOR1integrates signals from ethylene and jasmonate pathways in plant defense[J].The Plant Cell,2003,15 (1):165-178.
[32]ZAREI A,KORBES A P,YOUNESSI P,et al.Two GCC boxes and AP2/ERF-domain transcription factor ORA59in jasmonate/ethylene-mediated activation of the PDF1.2promoter in Arabidopsis[J].Plant Molecular Biology,2011,75(4/5):321-331.
[33]JIN J H,ZHANG H X,TAN J Y,et al.A new ethylene-responsive factor CaPTI1gene of pepper(Capsicum annuumL.)involved in the regulation of defense response to phytophthora capsici[J].Frontiers in Plant Science,2015,6:12-17.
[34]ONATE-SANCHEZ L,SINGH K B.Identification of Arabidopsis ethylene-responsive element binding factors with distinct induction kinetics after pathogen infection[J].Plant Physiology,2002,128(4):1313-1322.
(责任编辑:刘忠丽)
生理生化·耕作栽培
Physiology and Biochemistry·Tillage and Cultivation
Cloning and Expression Characteristics of AfWIN1in Aechemia fasciata
LEI Ming,WANG Jiabin,CONG Hanqing,LI Zhiying,XU Li*
(Southern China Key Laboratory of Crop Gene Resources and Germplasm Innovation,Ministry of Agriculture/Institute of Tropical Crop Genetic Resources,Chinese Academy of Tropical Agricultural Sciences,Danzhou,Hainan571737,China)
The AfWIN1gene was firstly cloned from a transcription factor in APETALA2/Ethylene Response Element Binding Protein(AP2/EREBP)family by rapid amplification of cDNA ends(RACE)technology based on the data of transcriptome,secondly the subcellular localization was predicted by online software,thirdly the transcript expression was analyzed by real-time fluorescence quantification PCR (qRT-PCR)and finally the promoter sequence was isolated by the chromosome walking method to lay the foundation for regulating and controlling growth and development of Aechemia fasciata by using the genetic engineering method.Results:The length of AfWIN1cDNA is 995bp containing a 501bp open reading frame(ORF)with 166amino acid residues.AfWIN1is located in the alkaline hydrophilic protein of the nucleus.The transcript expression of AfWIN1rises gradually with increase of plant age but the expression in floral organs is very low.The 5′-upstream regulatory sequence of AfWIN1gene includes more cis-elements of hormone response.AfWIN1may be involved in the vegetative growth process but can not regulate and control development of its floral organs because AfWIN1has different ethylene response pattern in central leaf of juvenile and adult plants.
Aechemia fasciata;tropical ornamenting plants;AfWIN1;transcription factor;ethylene
S682.39
A
1001-3601(2016)11-0455-0017-07
2016-07-06;2016-11-01修回
国家自然基金面上项目(31372106);海南省自然科学基金面上项目(20163127)
雷 明(1982-),男,助理研究员,博士,从事凤梨科植物开花分子机理和光合逆境生理研究。E-mail:leiming@catas.cn
*通讯作者:徐 立(1975-),男,研究员,博士,从事热带作物生长发育分子机理研究。E-mail:xllzy@263.net

