人参茎愈伤组织的诱导和分化研究
邸雪峰, 吴松权, 朴 锦, 吕龙石
(延边大学农学院,吉林 延吉 133002)
人参茎愈伤组织的诱导和分化研究
邸雪峰,吴松权,朴锦,吕龙石*
(延边大学农学院,吉林 延吉 133002)
摘要:以4年生人参茎为外植体,探讨了最适的消毒方法;以MS培养基为基本培养基,用均匀设计的方法探讨了2,4-D和6-BA不同浓度组合对人参愈伤组织诱导率的影响;用2,4-D和6-BA不同浓度组合探讨了对人参茎愈伤组织分化成再生苗的影响。结果表明:人参茎部最好的消毒方法为自来水冲洗2 h,无菌操作台内70%酒精溶液浸泡30 s,再用0.1%升汞溶液浸泡 4 min;最适合人参茎外植体诱导愈伤组织的培养基为MS+2.57 mg/L 2,4-D+0 mg/L 6-BA,诱导率可达64.75%;人参茎愈伤组织分化成试管苗的最好培养基为MS+2.00 mg/L 2,4-D+0.05 mg/L 6-BA,分化率达22.22%。
关键词:人参;茎;消毒;愈伤组织;分化
人参(PanaxginsengC. A. Mey.)作为百草之王,又名神草、血参、人微[1]。人参系被子植物门双子叶植物纲离瓣花亚纲五加科,多年生草本植物,生长于深林,分布在东北三省和河北省北部深山中[2-3]。人参含有多种人参皂苷、氨基酸、多糖及人参酶,具有大补元气,补脾益肺,养阴清热,安神经,定魂魄等其他很多疗效[4-5]。
然而人参自然生长发育时期过于缓慢,对新品种培育和大规模生产造成了很大困难[6]。人们希望通过组织培养的途径使人参生产脱离限制性的自然环境条件,缩短生长时间,同时达到快速繁殖新品种的目的[7]。人参组织培养,自本世纪60年代初开展以来,已经有越来越多的研究者投身于这一研究领域[8]。早在1964年罗士韦就开始了人参愈伤组织的研究,并取得初步结果[9]。朱蔚华等1975年开始人参组织培养的系统研究[10],杜令阁等(1987)诱导出人参花粉单倍体植株并建立了体细胞无性系[11],雷秀娟(2013)诱导出人参花药愈伤组织并建立植株再生体系[12]。人参组织培养虽起步较早,但进展缓慢。人参愈伤组织诱导率较低,分化更加困难,尚未见从人参茎愈伤组织分化出人参再生苗的研究报道。
本文以人参茎为外植体,探讨了人参茎外植体的最好消毒方法;采用均匀设计探讨了不同生长调节剂(2,4-D和6-BA)浓度处理组合对人参茎愈伤组织诱导率的影响;以不同生长调节剂(2,4-D和6-BA)浓度处理组合探讨了人参茎愈伤组织的分化率,为人参组培快繁体系的建立打下基础。
1材料与方法
1.1材料
采用无病4年生人参茎,由延边大阳参业有限公司提供。
1.2方法
1.2.1人参茎外植体的消毒方法
取无病人参单株的茎,分成数段,先用自来水冲洗2 h,清除表面泥土,然后用滤纸吸干水分,放入干净的烧杯中移至无菌操作台。将人参茎外植体先用70%酒精溶液浸泡30 s,期间不停摇晃,无菌水冲洗2~3次,再用2%次氯酸钠溶液或0.1%升汞溶液浸泡后,无菌水冲洗3~4次。切去两端并分成1 cm左右的小段接种于MS+2,4-D 2.0 mg/L+BA 0.05 mg/L+蔗糖30 g/L+琼脂10 mg/L,pH值为5.8的培养基中。消毒液类型与处理时间如表1。每处理20个培养皿(ф=90 mm),每个培养皿接种1个人参茎外植体,培养室温度(25±2) ℃,暗室培养。从接种第2天开始统计污染、褐变和存活情况,1个月之后观察人参愈伤组织的生长情况,并计算出各个处理的污染率、褐变率和存活率。
1.2.22,4-D和6-BA不同浓度配比对人参茎愈伤组织诱导率的影响
以MS培养基为基本培养基,添加蔗糖30 g/L,琼脂粉10 g/L,pH值5.8,温度为(25±2) ℃,暗室培养。将经过最适消毒方法处理的人参茎外植体接种到附加不同浓度2,4-D和6-BA培养基中,2,4-D为1.0~3.5 mg/L,6-BA为0.05~0.30 mg/L,接种方法与数量同消毒处理。采用U12*(122)均匀设计表,进行平滑后的实施方案见表2。所得试验数据用SPSS 19.0统计软件进行统计分析。
1.2.32,4-D和6-BA不同浓度配比对人参茎愈伤组织分化率的影响
以MS培养基为基本培养基,添加蔗糖30 g/L,琼脂粉10 g/L,pH值5.8,添加不同浓度的2,4-D和6-BA构成10种不同组合的分化培养基,其代码为DF1~DF10(表3)。将长势较好的人参茎愈伤组织转接至分化培养基上,每处理10个培养皿,每个培养皿接种9个人参愈伤组织,培养室温度为(25±2) ℃,暗室培养,45 d继代培养1次,观察愈伤组织分化情况。参照雷秀娟的方法,将分化出的人参小苗底部切断转接至壮苗培养基MS+TDZ 3 mg/L+IBA 0.2 mg/L+GA 3 mg/L继代培养[12]。
2结果与分析
2.1不同消毒方法对人参茎外植体的消毒效果
分别用2%NaClO2溶液和0.1% HgCl2溶液以不同消毒时间处理人参茎外植体,所得褐变率、污染率及存活率的调查结果见表1。
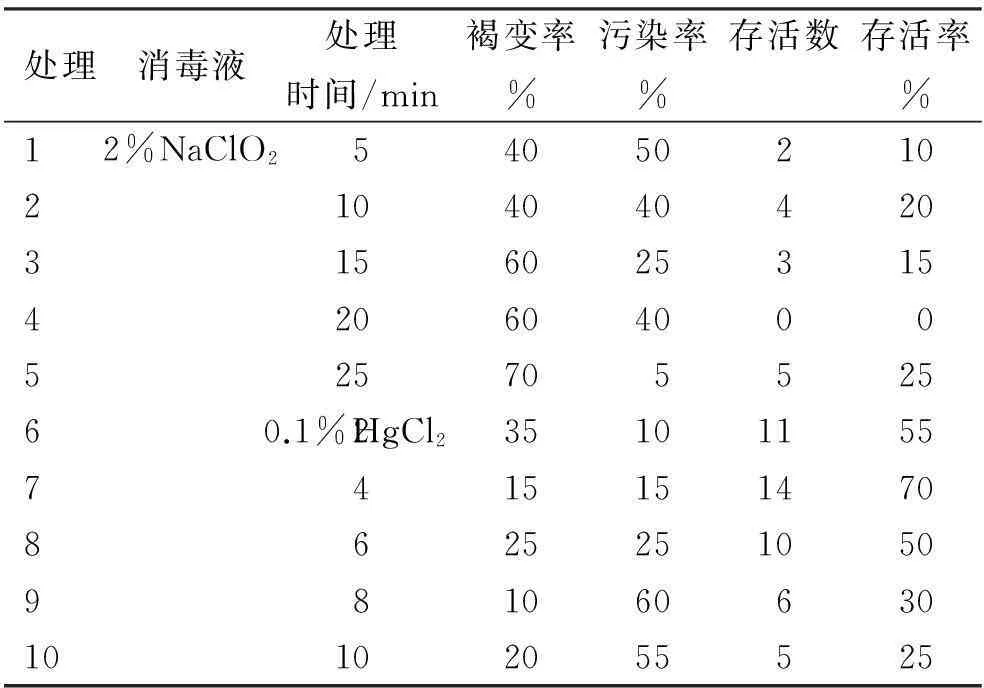
表1 人参茎外植体的消毒处理效果
由表1可知,0.1% HgCl2溶液消毒效果好于2%NaClO2溶液。人参茎外植体消毒效果最好的处理是7号处理(0.1% HgCl24 min),存活率达70%,其次为6号处理(0.1% HgCl22 min)和8号处理(0.1%HgCl26 min),存活率均超过50%。
2.22,4-D和6-BA不同浓度配比对人参茎愈伤组织诱导率的影响
在MS培养基中添加不同浓度2,4-D和6-BA对人参茎外植体愈伤组织诱导率影响的调查结果见表2。


表2 人参茎愈伤组织诱导率
2.32,4-D和6-BA不同浓度配比对人参茎愈伤组织分化率的影响
人参茎愈伤组织转接至分化培养基,经过3或4次继代培养后,愈伤组织上部逐渐衰老(图1-A);在部分衰老愈伤组织上长出不定根,并分化出白色芽点(图1-B);将其转移至光下培养,芽点不断膨大变绿,并分化出丛生芽,此时底部愈伤组织逐渐衰老死亡(图1-C);从丛生芽上分化出较多人参再生苗(图1-D);将其单个切取转接到壮苗培养基,经2次继代培养,在个别人参再生苗上出现花蕾(图1-E)并有开花现象(图1-F)。
在不同浓度2,4-D和6-BA的分化培养基上人参茎外植体愈伤组织分化成再生苗的调查结果如表3所示。
由表3可知,在10种分化培养基中,DF5、DF6和DF7培养基上成功分化出人参再生苗,DF6培养基的分化率最高,达到22.22%。

图1 人参茎愈伤组织及其分化过程
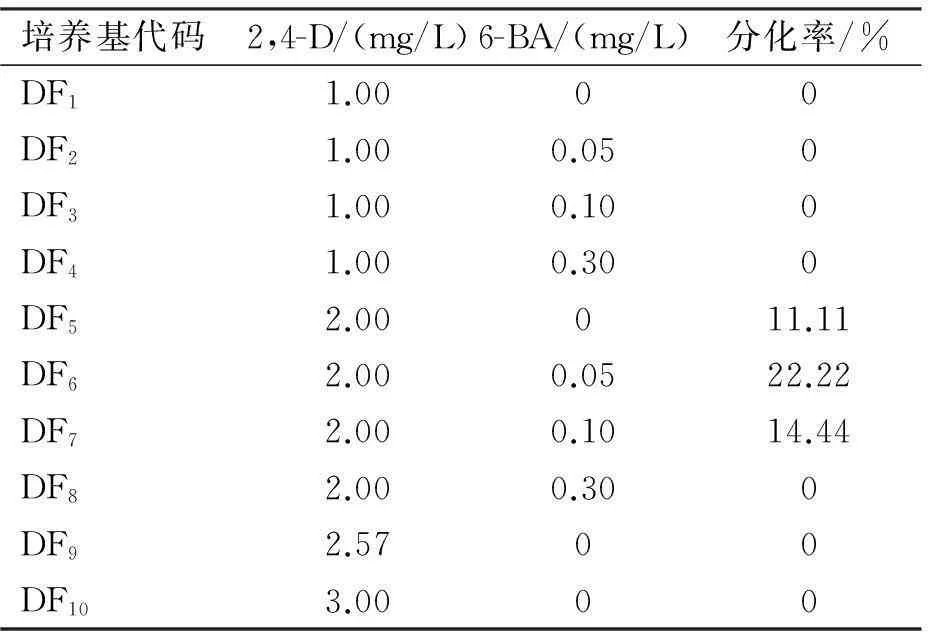
表3 人参愈伤组织分化率
3讨论与结论
消毒方法的研究结果表明:人参茎外植体最好的消毒方法为自来水冲洗2 h,无菌操作台内70%酒精溶液浸泡30 s,无菌水冲洗2~3次,再用0.1%升汞溶液浸泡4 min,无菌水冲洗3~4次。人参主根地下生长,环境复杂,不仅表皮带菌,各种菌物常常侵染至其内部形成内生菌。组织培养消毒剂多为表面消毒剂,若消毒时间过短,往往消毒不彻底;若消毒时间过长,常常杀死组培外植体。人参茎在地面生长,带菌较少,用表面消毒剂可较好的消除健康植株茎表面的菌物。

人参茎愈伤组织分化率的研究结果表明:在DF5、DF6和DF73种培养基上分化出人参再生苗,在DF6处理组合(2,4-D 2 mg/L,6-BA 0.05 mg/L)的分化率最高,达22.22%。人参愈伤组织分化困难一直是阻碍人参组织培养的难关,本文初步摸索出人参茎愈伤组织再分化的2,4-D和6-BA的不同浓度组合,但尚未能分化出人参再生苗的根部,对此还有待于进一步研究。
参考文献:
[1]彭亮亮,刘强,董宇,等.人参的组织培养中通过对Whit、MS、FOX培养基分别加入10%椰乳然后接种诱导发生的情况变化研究[J].人参研究,2012(4):43.
[2]朴春驿,赵丽琴,李春英.人参不同部位无机元素含量测定[J].黑龙江八一农垦大学学报,1998,10(1):68-69.
[][]
[3]安永辉,郭昶,孙振雷,等.人参的组织培养及快繁体系的建立[J].安徽农业科学,2008,36(27):11656-11657.
[4]左北梅,高文远,董艳艳,等. 药用植物人参的组织培养研究进展[J].中国现代中药,2012, 14(1):34.
[5]李鹏飞,刘春莹,郭俊莹,等.不同种类人参茎叶中皂苷成分的比较[J].安徽农业科学,2010,38(24):13077-13079.
[6]刘贤旺.人参组织培养研究的进展[J].江西中医学院学报,1993,5(2):51-54.
[7]史芳芳,汪泉,王小平.人参茎段组织培养研究[J].现代农业科技,2012(14):56.
[8]陆文梁,夏小娣.人参组织与细胞培养研究的进展[J].植物学通报,1991,8(1):14-21.
[9]罗士韦,黄文徽,曹国仪,等.人参组织培养[J].植物生理学通讯,1964(2):26.
[10]朱蔚华,张荫麟,李新兰,等.人参愈伤组织培养的初步研究[J].药学学报,1979,14(9):541-547.
[11]杜令阁,侯艳华,常维春,等.人参花粉植株的诱导及体细胞无性系的建立[J].中国科学(B辑),1987(1):35-41.
[12]雷秀娟.人参花药、杂种胚培养及基于皂苷含量的特性评价[D].长春:中国农业科学院特产研究所,2013.
Study on Panax ginseng stem callus induction and the differentiation
(.*)
(AgriculturalCollegeofYanbianUniversity,YanjiJilin133002,China)
Abstract:Using four years’ old ginseng stems as explants, the optimum disinfection method was studied, and MS medium as basic medium, the effects of 2,4-D and 6-BA concentration on ginseng callus rate with uniform design and the effect of ginseng callus induction into plantlets with different concentrations of 2,4-D in combination with 6-BA were examined. The results showed that the best disinfection method of ginseng stems was that tap water kept washing 2 h, a sterile solution of 70% alcohol soaked console 30s, and then 0.1% mercuric chloride solution soaked 4min. The most suitable ginseng stem explants callus induction medium was MS + 2,4-D 2.57mg/L + 6-BA 0 mg/L, the inducing rate was 64.75%. The best ginseng callus differentiation into tube seedlings medium was MS + 2,4-D 2.00mg/ L + 6-BA 0.05 mg/L, the differentiation rate was 22.22%.
Key words:Panax ginseng;stem;disinfection;callus;differentiation
中图分类号:S567.53
文献标识码:A
文章编号:1004-7999(2016)01-0031-04
DOI:10.13478/j.cnki.jasyu.2016.01.006
作者简介:邸雪峰(1990—),女,吉林洮南人,在读硕士,研究方向为中药材栽培与育种。 吕龙石为通信作者,
收稿日期:2016-01-15基金项目:吉林省教育厅重点项目(吉教科合字[2009]第1号;吉教科合字[2010]第1号)
E-mai:nxlls@ybu.edu.cn

