响应面优化微泡菌ALW1产褐藻胶裂解酶的发酵条件
李永幸,杨 帆,姜泽东,2,3,倪 辉,2,3,杨秋明,2,3,肖安风,2,3(.集美大学食品与生物工程学院,福建厦门3602;2.福建省食品微生物与酶工程重点实验室,福建厦门3602;3.厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建厦门3602)
响应面优化微泡菌ALW1产褐藻胶裂解酶的发酵条件
李永幸1,杨帆1,姜泽东1,2,3,倪辉1,2,3,杨秋明1,2,3,肖安风1,2,3
(1.集美大学食品与生物工程学院,福建厦门361021;
2.福建省食品微生物与酶工程重点实验室,福建厦门361021;
3.厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建厦门361021)
摘要:采用单因素和响应面法对产褐藻胶裂解酶菌种Microbulbifer sp. ALW1发酵产酶的培养条件进行优化。通过单因素实验,得到发酵条件如下:培养基初始pH 7.5,接种量5%,装液量50 mL,温度25℃,最大酶活力达到117.1 U/mL。在单因素实验的基础上,通过Box-Behnken设计和响应面分析,得到最佳的发酵培养条件:培养基初始pH 8.0,接种量6.5%,装液量50 mL,温度23℃,褐藻胶裂解酶活力达到130 U/mL,比基础培养条件下提高16.5%。
关键词:微泡菌ALW1;褐藻胶裂解酶;响应面分析;条件优化
褐藻胶是从巨藻、羊栖菜、海带等褐藻间质中提取的多糖聚合物,主要有由α-L-古洛糖醛酸(G)及β-D-甘露糖醛酸(M)聚合而成[1-2],因其良好的增稠、稳定及凝胶作用,被广泛应用于食品、医药、化工等领域[3]。研究表明褐藻胶降解生成的低分子量寡糖具有多种生理活性,如促进植物生长[4-5]、促进双歧杆菌生长[6]、抗氧化活性[7]等。
目前,褐藻胶寡糖的制备方法主要有物理法[8]、化学法[9]和酶解法[10]。物理法及化学法反应条件复杂,不易控制,并且所得产物中副产物多;相比之下酶解法反应条件较温和、容易操作、专一性强,因此酶解法逐渐取代物理化学法成为获取寡糖的首要选择。褐藻胶裂解酶来源广泛,可以从海洋细菌[11]、革兰氏阴性菌[12]和革兰氏阳性菌[13]等中分离出来。但是酶产量制约着酶法水解褐藻胶在工业化上的应用,因此获得高产量的褐藻胶裂解酶是实现酶法制备褐藻胶寡糖的前提与必要条件。
提高酶产量的方法包括高产菌株的选育、发酵工艺的优化、基因工程改造等。发酵培养基的成分及条件的优化是提高褐藻胶裂解酶产量、降低成本、缩短发酵时间的重要手段之一。1994年,Dyrset[14]对菌株Klebsiella pneumoniae进行高密度发酵生产褐藻胶裂解酶工艺研究,发现蔗糖促进菌株生长,海藻酸钠作为产酶诱导剂,确定碳源补加策略以提高酶产量。2009年,马悦欣等[15]采用单因素及正交试验设计相结合的方法,以褐藻胶作为唯一碳源对菌株Pseudoalteromonas sp. LJ1进行培养基成分及培养条件优化,在最佳条件下褐藻胶裂解酶活力提高66%。
本研究从海带中筛选出一株产褐藻胶裂解酶菌株ALW1,鉴定为微泡菌属(Microbulbifer sp.)。以往的研究报道中,产褐藻胶裂解酶菌种多是弧菌、假单胞菌、棒状杆菌等,而对微泡菌属(Microbulbifer sp.)产褐藻胶裂解酶的报道较少,该研究丰富了褐藻胶裂解酶资源。在前期的研究中,发现该菌株所产褐藻胶裂解酶为胞外酶,并且具有较好的热稳定性。为了微泡菌属产褐藻胶裂解酶的推广应用及工业化生产,采用单因素及响应面实验方法,通过摇瓶发酵方式对其产褐藻胶裂解酶发酵条件进行了研究,以提高其产酶量。
1 材料和方法
1.1菌种
微泡菌Microbulbifer sp. ALW1,为本实验室选育,经过中国工业微生物菌种管理保藏中心(CICC)鉴定为一株新菌,保藏编号为23821。
1.2主要试剂
K2HPO4、MgSO4·7H2O、FeSO4·7H2O、NaCl、无水Na2SO3、NaOH、酒石酸钾钠等试剂均为市售分析纯;海藻酸钠(CP)购于国药集团化学试剂有限公司。
1.3培养基
种子培养基成分:海藻酸钠5 g/L,蛋白胨5 g/L,酵母粉1 g/L,(NH4)2SO45 g/L,K2HPO42 g/L,NaCl 30 g/L,MgSO4·7H2O 1 g/L,FeSO4·7H2O 0.01 g/L,pH 7.5,121℃灭菌20 min。固体培养基为种子培养基中加入15 g/L琼脂粉。
发酵培养基成分:海藻酸钠1 g/L,NaCl 60 g/ L,MgSO4·7H2O 3 g/L,K2HPO46 g/L,FeSO4·7H2O 0.06 g/L,pH 7.5,121℃灭菌20 min。
1.4发酵条件
发酵条件:将活化后的种子培养基以5%的接种量接入发酵培养基,250 mL三角瓶中装液量为50 mL,温度25℃,转速180 r/min,发酵培养60 h。
1.5酶活力的测定
取250 μL离心后的(12 000 r/min,8 min)发酵上清液,添加500 μL 5 g/L海藻酸钠溶液(50 mmol/L pH为7.0的PBS缓冲液配制),40℃水浴30 min,再沸水浴5 min终止反应,加0.5 mL DNS,沸水显色5 min后冷却,最后加蒸馏水稀释到5 mL,混匀后测540 nm处的吸光值,根据标准曲线来计算反应液中还原糖的生成量。对照组的酶液先用沸水浴灭活5 min,其他步骤与反应组一致。
上述条件下1 min催化产生1 μg还原糖所需的酶量为一个酶活力单位(U)。
1.6生物量的检测
取1.0 mL发酵液,12 000 r/min离心8 min,去掉上清液后,用蒸馏水稀释适当倍数,并用蒸馏水作空白,在600 nm波长下测吸光值。
1.7单因素筛选及响应面试验
分别对培养基初始pH、装液量、接种量以及温度进行单因素变量实验,每组设置3个平行,测定酶活力。应用SPSS Statistics 17.0对单因素结果进行方差分析,选出对酶活力影响显著的因素进行Box-Behnken实验设计。
2 结果与分析
2.1培养条件的单因素试验
2.1.1初始pH对产酶的影响
李悦明等[16]对芽孢杆菌发酵产褐藻胶裂解酶进行研究,得出在培养基初始pH为7.0~8.5时,菌株能较好的产酶,在pH 7.5时产酶量最高。温顺华等[17]对Shewanella haliotis BP-1发酵产褐藻酸盐裂解酶进行研究,得出培养基初始pH为7.5~8.0时,菌株具有较高的产酶能力,最适产酶pH为8.0。
调节发酵培养基的初始pH,考察初始pH对Microbulbifer sp. ALW1生长以及产酶的影响。结果如图1所示:随着pH增加,Microbulbifer sp. ALW 1的生物量呈现略有上升的趋势。在pH 5~9之间,菌株均可以产酶,比报道的pH范围宽,但是产酶量受不同的培养基pH影响。随着培养基pH的升高,酶活力呈现先增大后减小的趋势,初始pH为7.5时,产酶量最高,达到111.6 U/mL。

图1 初始pH对微泡菌ALW 1生长以及产酶的影响
2.1.2装液量对产酶的影响
通常,在摇瓶培养过程中,装液量过大不利于供氧,从而影响菌体的生长以及产酶。傅晓妍等[18]对褐藻胶裂解酶产生菌Vibrio sp. QY102的发酵条件进行研究,得出在250 mL的三角瓶中装液量为25 mL时,酶产量最大,并且随着装液量增加酶产量降低。
按照不同的装液量培养Microbulbifer sp. ALW1,发酵结束后检测生物量及酶活力,结果如图2所示。由图2可以看出:生物量随着装液量的增加而无明显变化,当装液量小于50 mL时,随着装液量的增加,菌株的产酶量也随之增加;装液量为50 mL时,酶活力最高为118.9 U/mL;装液量在50~90 mL范围内,褐藻胶裂解酶活力基本保持不变;装液量继续增加,褐藻胶裂解酶活力开始下降。这说明过高的装液量使得供氧受到了限制,导致微生物的产酶受到了影响。

图2 装液量对微泡菌ALW 1生长以及产酶的影响
2.1.3接种量对产酶的影响
接种量多少对发酵过程中的延滞期长短以及对数生长期菌体的生长情况都有较大的影响。接种量过少会使菌体生长缓慢,培养时间增加;接种量过多则会使菌体大量繁殖,消耗大量营养,不利于产酶。李恒等[19]对菌株Halomonas sp. WF6产褐藻胶裂解酶的发酵条件进行研究,得出当接种量为2%时,产酶量最高。
接种量对Microbulbifer sp. ALW1生长和产酶的影响如图3所示:接种量小于5%时,生物量缓慢增加,酶产量则迅速增大;当接种量大于10%时,生物量增加速度加快,而酶产量迅速减小,说明接种量过大利于菌株生长而不利于产酶;接种量为5%时,酶活力达到最大为125.4 U/mL。
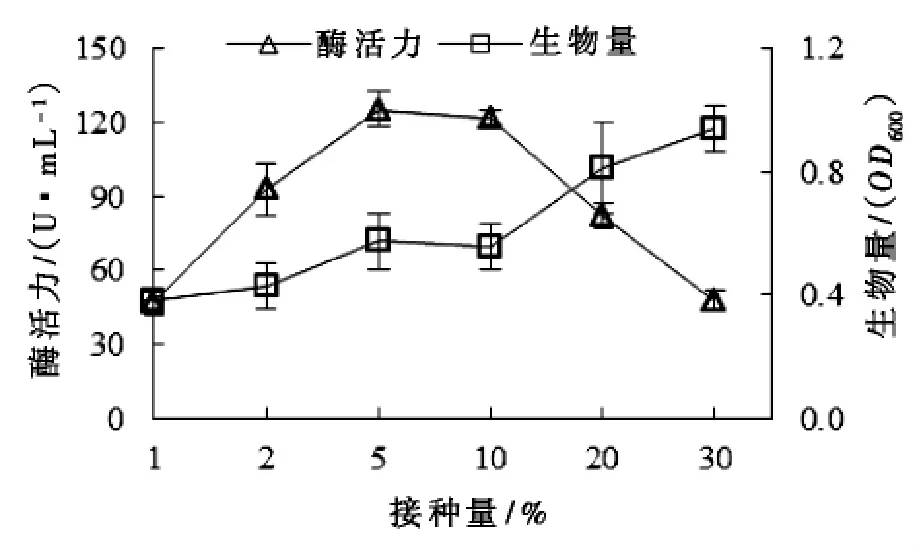
图3 接种量对微泡菌ALW 1生长以及产酶的影响
2.1.4温度对产酶的影响
发酵温度影响发酵液的理化性质及微生物的代谢调控机制,因此在发酵过程中需要维持适宜的温度才能保证菌体的正常生长代谢。李悦明等[16]对发酵产褐藻胶裂解酶菌株培养温度进行研究,得出该菌株在32℃时产酶量最大。Fu等[20]对菌株Vibrio sp. YKW-34产褐藻胶裂解酶的条件进行研究,得出该菌株在20~30℃能较好的生长,25℃为其最佳产酶温度。
实验研究了温度对Microbulbifer sp. ALW1生长及产酶的影响。结果如图4所示:温度在20~25℃范围,酶活力随着温度的升高而升高;温度大于25℃时,酶活力迅速下降,25℃为该菌株产褐藻胶裂解酶的最适温度,酶活力为117.1 U/ mL。ALW1在20~40℃范围内均能较好生长,说明温度对产酶的影响大于对菌株生长的影响,可能是因为菌株的生长与褐藻胶裂解酶的产生不关联,也可能是温度影响酶的稳定性。
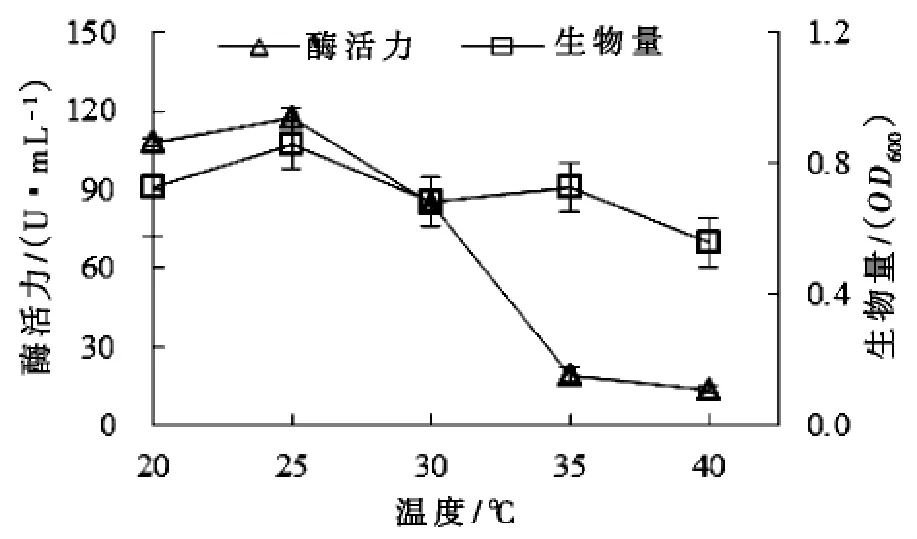
图4 温度对微泡菌ALW 1生长以及产酶的影响
2.2响应面分析法优化发酵条件
应用SPSS Statistics 17.0对单因素结果进行方差分析,方差分析所得各因素P值:温度(P= 0),装液量(P=0.343),接种量(P=0.022),pH(P= 0.026),其中装液量P值大于0.05,对酶活力影响不显著,故对酶活力影响显著因素为温度、接种量、pH。根据Box-Behnken实验设计原理,进行3因素3水平的试验设计,分析因素及设计见表1。
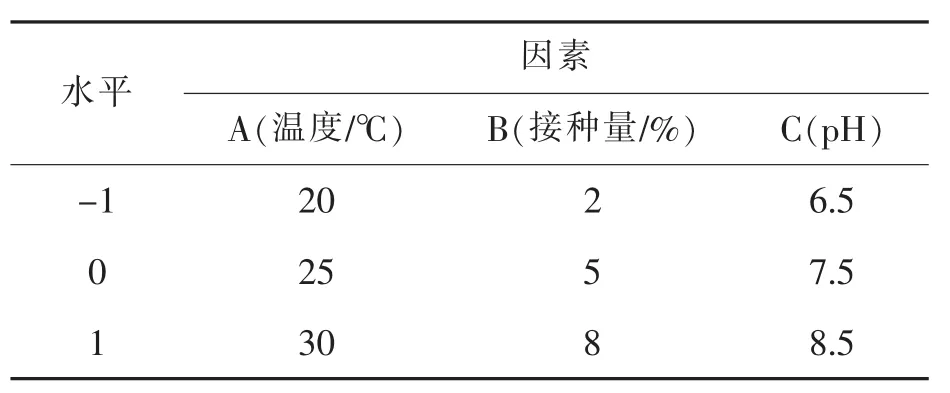
表1 响应面试验因素水平表
根据试验结果,利用Design Expert软件进行回归分析,经回归拟合后,得到回归方程:
Y =-1 284.44 +23.64A +80.95B +217.71C -0.66AB+0.24AC-2.48BC-0.46A2-3.51B2-12.86C2
对回归模型方差分析,结果见表2。当“Pro>F”值小于0.05表明该指标显著,由表3可以看出:整体模型P值略大于0.001,说明模型比较显著,失拟项为0.074 0,失拟项大于0.05失拟项不显著,说明回归方程拟合程度较好。校正决定系数R2=0.932 0进一步说明预测值与真实值相关性好。表中一次项B(P=0.000 2)、C(P=0.002 2)对结果有显著影响,A (P=0.191 7)则不显著;二次项中A2(P=0.057 0)对结果不显著,B2(P=0.001 1)、C2(P=0.040 5)都对结果有显著影响;交互项中AC(P=0.803 2)、AB(P= 0.080 2)、BC(P=0.159 8)均不显著。表明响应值与各项之间都有很大关系,各因子与响应值之间的关系不是简单的线性关系所能满足。
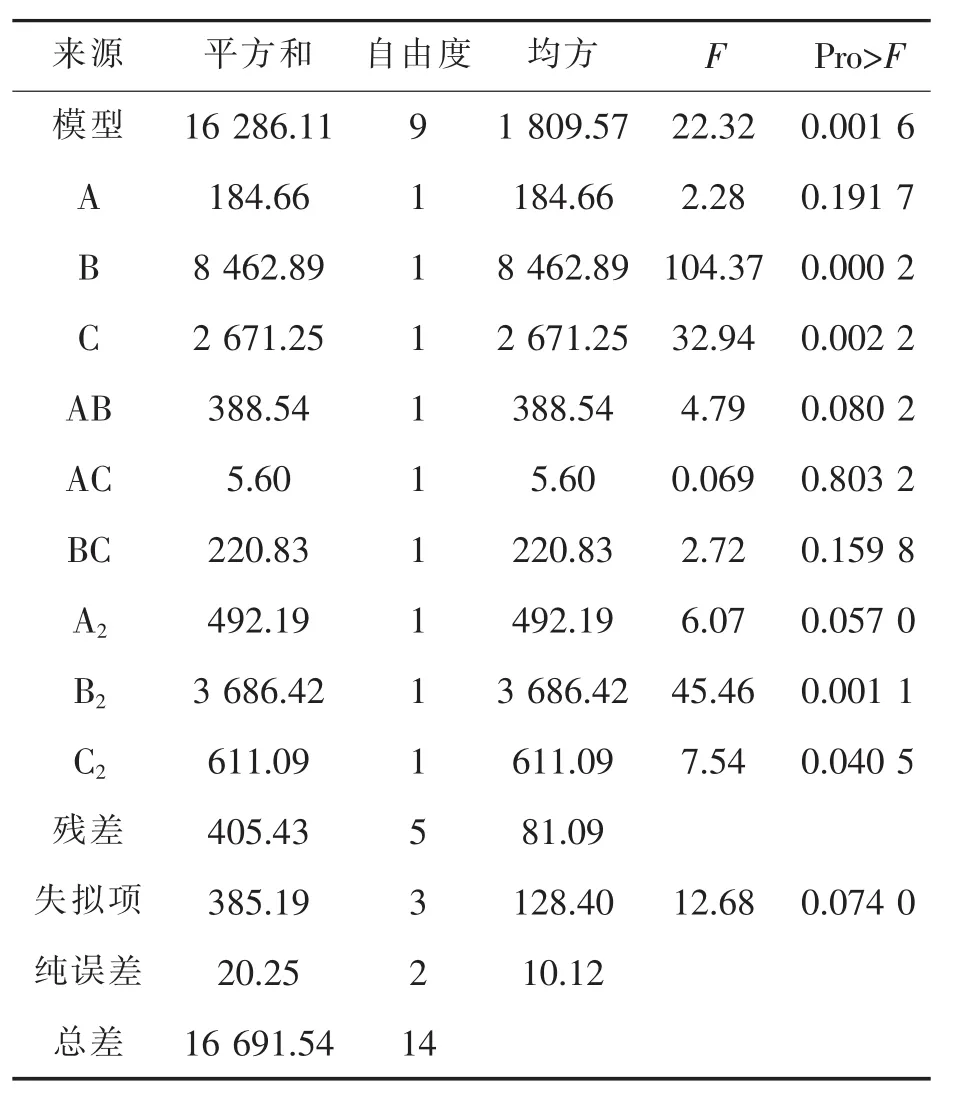
表2 回归模型的方差分析
各变量之间对响应值的影响可以通过三维响应面图和等高线图进行分析并解释,根据回归方程做出响应面回归分析图,如图5所示:图(a1)表示由温度和接种量为变量生成的响应面图,当温度一定时,酶活力随着接种量增加而增加,等高线的形状可以显示两因素的交互效应强弱,圆形表示两因素交互作用不显著,椭圆形表示两因素交互作用显著,处于同一曲线上的酶活力值相等;从图(a2)中可以看出温度与接种量两因素交互作用显著,它们呈现的等高线为椭圆形,响应面立体图开口向下,可以看出响应值增大到极值点后,各因素值继续增大,响应值则随之减小;图(b1)表示以温度与pH为变量生成的响应面图,从(b2)可知两者交互作用不明显,pH对结果的影响比温度显著,表现在响应面曲面的变化幅度更加显著;图(c1)表示发酵温度固定的情况下,以接种量和pH为变量生成的响应面图,等高线为椭圆形,但方差分析中两因素的P=0.1598,说明两因素存在一定的交互作用,接种量在6%~8%之间,pH在8~8.5之间酶活力可得到最大值。
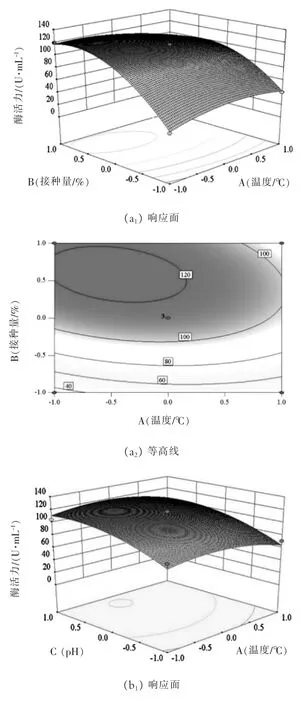

图5 温度、接种量、pH对褐藻胶裂解酶活力影响的响应面图及等高线图
2.3试验结果验证
根据回归模型,得出Box-Behnken实验最优组合为温度23.01℃,接种量6.54%,起始pH 8.04,在此条件下褐藻胶裂解酶活力为127.8 U/ mL。经过修正,选择温度23℃,接种量6.5%,起始pH 8.0,进行3次重复试验进行验证,得到褐藻胶裂解酶酶活力平均值为130 U/mL,与预测值127.8 U/mL接近,说明该模型与实验数据拟合较好。
将优化结果与方法中的初始发酵条件进行比较(图6),由图6可知:初始条件下酶活力为111.6 U/mL,优化后酶活力达到130 U/mL,较优化前提高16.5%,优化效果显著。
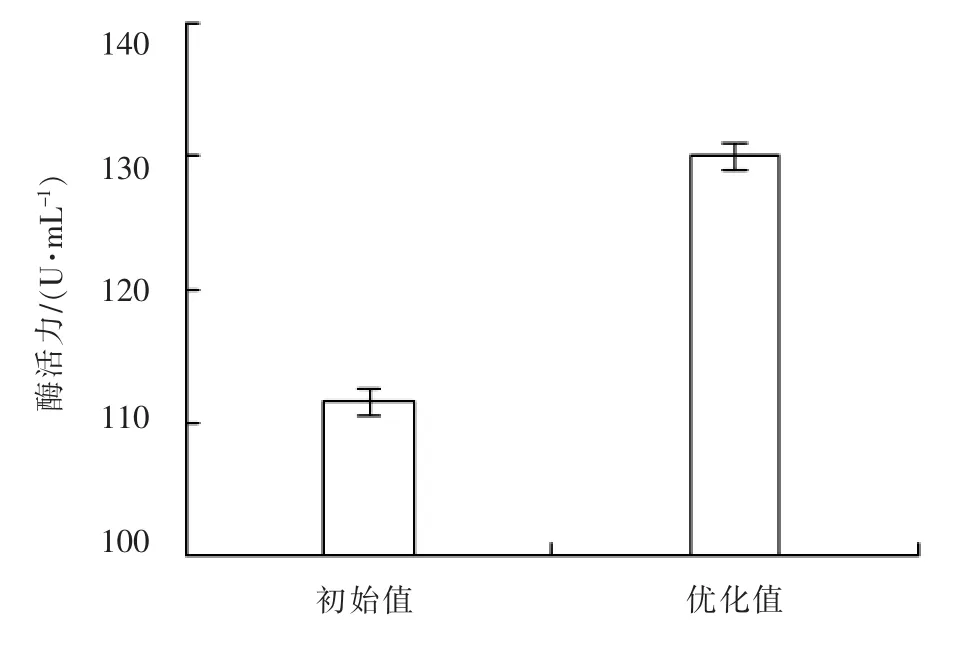
图6 初始条件和优化后的的酶活力
3 结 论
本实验通过单因素和Box-Behnken设计对发酵条件进行优化,建立了发酵条件影响微泡菌ALW1产酶的二次多项数学模型,并对该模型进行显著性检验,根据该模型确定了产褐藻胶裂解酶的最佳发酵条件:培养基初始pH 8.0,接种量6.5%,装液量50 mL,温度23℃,褐藻胶裂解酶活力达到130 U/mL,比初始的111.6 U/mL提高了16.5%。
参考文献:
[1]GACESA P. Alginates[J]. Carbohydrate polymers,1988,8(3):161-182.
[2]HAUG A,LARSEN B,SMIDSEROD O. Studies on the sequence of uronic acid residues in alginic acid[J]. Acta chemica scandinavica,1967,21(3):691-704.
[3]刘斌,王云长,张洪荣,等.海藻多糖褐藻胶生物活性及其应用研究新进展[J].中国海洋药物杂志,2004,23(6):36-41.
[4]TOMODA Y,UMEMURA K,ADACHI T. Promotion of barely root elongation under hypoxic conditions by alginate lyase -lysate[J]. Bioscience biotechnology and biochemistry,1994,58 (1):202-203.
[5]IWASAKI K,MATSUBARA Y. Purification of alginate oligosaccharides with root growth promoting activity toward lettuce[J]. Biosciencebiotechnologyandbiochemistry,2000,64(5):1067-1071.
[6]IWAMOTO M,KURACHI M,NAKASHIMA T,et al. Structureactivity relationship of alginate oligosaccharides in the induction of cytokine production from RAW264.7 cells[J]. FEBS letters,2005,579(20):4423-4429.
[7]周绪霞,徐,丁玉庭.酶解制备褐藻胶寡糖及其产物的抗氧化活性分析[J].食品与发酵工业,2014,40(2):116-120.
[8]付海英,姚思德,吴国忠.海藻酸钠电离辐射降解研究[J].辐射研究与辐射工艺学报,2003,21(3):169-173.
[9]窦勇,胡佩红.褐藻胶寡糖制备及抑菌活性研究[J].广东农业科学,2009(12):161-163.
[10]侯保兵,刘书来,张建友,等.褐藻胶裂解酶产生菌的发酵优化研究[J].水产科学,2009,28(11):667-670.
[11]TSENG C H,YAMAGUCHI K,KITAMIKADO M. Isolation and some properties of alginate lyase from a marine bacteriwm Vibrio sp. AL-128[J]. Nippon suisan gakkaishi,1992,58(3):533-538.
[12]ØSTGAARD K,KNUTSEN S H,DYRSET N,et al. Production and characterization of guluronate lyase from Klebsiella Pneumoniae for applications in seaweed biotechnology[J]. Enzyme and microbial technology,1993,15(9):756-763.
[13]NAKAGAWA A,OZAKI T,CHUBACHI K,et al. An effective method for isolating alginate lyase producing Bacillus sp. ATB-1015 strain and purification and characterization of the lyase[J]. Journal of applied microbiology,1998,84(3):328-335.
[14]DYRSET N,LYSTAD K Q,LEVINE D W. Development of a fermentation process for production of an alginate G -iyase from Klebsiella Pneumonia[J]. Applied microbiology and biotechnology,1994,41:523-530.
[15]马悦欣,纪涛,李慧琼,等.假交替单胞菌LJ1菌株产褐藻胶裂解酶的培养条件优化及酶学性质[J].微生物学报,2009,49(8):1086-1094.
[16]李悦明,韩建友,徐建春,等.利用芽孢杆菌发酵生产褐藻胶裂解酶的研究[J].中国酿造,2010(4):79-81.
[17]温顺华,李峰,黄庶冰,等.产褐藻酸盐裂解酶菌株Shewanella haliotis BP-1的产酶条件优化[J].中国酿造,2012,31(12):52-57.
[18]傅晓妍,李京宝,韩峰,等.褐藻胶裂解酶产生菌Vibrio sp. QY102的发酵条件优化[J].中国海洋大学学报,2007,37(3):432-436.
[19]李恒,朱思婷,刘旭梅,等.褐藻胶裂解酶产生菌的分离鉴定及产酶发酵优化[J].中国生物工程杂志,2014,34(9):94-101.
[20]FU X,LIN H,KIM S M. Optimization of culturing condition and medium composition for the production of alginate lyase by a marine Vibrio sp. YKW-34[J]. Journal of ocean university of China,2008,7(1),97-102.
(责任编辑:朱小惠)
Response surface optim ization of fermentation conditions for alginate lyase production by M icrobulbifer sp. ALW 1
LI Yongxing1,YANG Fan1,JIANG Zedong1,2,3,NI Hui1,2,3,YANG Qiuming1,2,3,XIAO Anfeng1,2,3
(1. College of Food and Biological Engineering,Jimei University,Xiamen 361021,China;
2. Fujian Provincial Key Laboratory of Food Microbiology and Enzyme Engineering,Xiamen 361021,China;3. Key Laboratory of Systemic Utilization and In-depth Processing of Economic Seaweed,Xiamen Southern Ocean Technology Center of China,Xiamen 361021,China)
Abstract:In this study,the optimization of fermentation conditions for alginate lyase production by Microbulbifer sp. ALW1 was carried out by single factor experiment and response surface analysis. The optimal fermentation conditions were obtained by single factor as follows:initial pH 7.5,inoculation volume 5%,liquid volume 50 mL,temperature 25℃. Box-Behnken design and response surface analysis were further used to optimize fermentation conditions on the basis of single factor test. The final optimum fermentation conditions as follows:initial pH 8.0,inoculum volum 6.5%,liquid volume 50 mL,temperature 23℃. The alginate lyase activity reached 130 U/ mL,which was 16.5%higher than that of the initial conditions.
Keywords:Microbulbifer sp. ALW1;alginate lyase;response surface analysis;conditions optimization
作者简介:李永幸(1988—),男,河南商丘人,硕士研究生,主要研究方向为微生物发酵与酶工程,E-mail:liyongxing03 @sina.com.通信作者:肖安风教授,E-mail:xxaaffeng@jmu.edu.cn.
基金项目:国家海洋公益性行业科研专项(201505033);福建省科技重大专项专题项目(闽科计[2015]66号);福建省高校产学合作项目(2016N5008)
收稿日期:2016-01-20
中图分类号:TQ92
文献标志码:A
文章编号:1674-2214(2016)02-0075-06