固态发酵生产活性干酵母的研究
楼志坚,戴利伟,张艳丽(.浙江星野集团有限责任公司,浙江杭州3000)(.浙江工业大学生物工程学院,浙江杭州3004)
固态发酵生产活性干酵母的研究
楼志坚1,戴利伟2,张艳丽2
(1.浙江星野集团有限责任公司,浙江杭州310010)
(2.浙江工业大学生物工程学院,浙江杭州310014)
摘要:以酿酒活性干酵母为对象,以麸皮、玉米粉、米糠为基本原料,经固态培养基选择优化,酵母细胞数高于4.47×109CFU/g。在此基础上加入一定量糖化酶、酸性蛋白酶,并对培养基进行优化,酵母细胞数高达6.0×109CFU/g。另外,在载体培养初步研究中,把玉米水解液加到多孔性材料中进行酵母培养,酵母细胞数高于5.0×108CFU/mL。
关键词:活性干酵母;固体培养;多孔性材料;糖化酶;酸性蛋白酶
活性干酵母主要应用于面包、酿酒、酒精、调味料、饲料等方面,国外在40年代就开始进行大规模的生产,尤以面包等发酵类食品为主食的国家,酵母的生产和研究极为重要[1]。早在1847年,奥地利有1.4×107磅的面包酵母用于面包制作[2]。一方面,随着社会的发展,酵母及酵母生产工艺的改进,酵母的需求量逐年递增,同时酵母也用于家庭手工艺生产与日常发酵食品的制作;另一方面,酵母发酵对工业生产产生的副产物(糖蜜及其他形式的糖类和淀粉类物质)的综合利用有重要意义[3]。
目前,国内以液体培养酵母为主,固体培养较少。固体发酵可节约大量生产用水,减少环境污染,同时固体发酵还减少了液体发酵中所必需的设备,如通风设备、搅拌设备等,能耗低,降低了生产成本。但固体发酵不易得到纯净的产物。国外报道了利用多孔性物质为载体培养酵母,为酵母提供一个较优的培养环境,生产效率较高,同时提取产物方便,设备投资相对较少[4]。本论文对如何提高固态发酵酵母的产量进行了研究,对培养条件作了初步的优化,并对固态培养和载体培养两种培养方式进行了比较。
1 材料与方法
1.1菌种
酿酒活性干酵母(4.09×1010CFU/g),产于宜昌食用酵母基地。
取一定量的活性干酵母,用30℃左右温水进行活化(使整个物料体系水分控制在40%左右),在搅拌状态下活化2 h左右。活化结束后,将一定配比的混合物料与菌液混合均匀,装入塑料袋,置于30℃培养箱中进行自然发酵。
1.2原料
麸皮(自然状态)、小麦(颗粒)、早籼米(颗粒)、玉米粉(粉碎过60目筛)、米糠粉(粉碎过60目筛),均来自杭州良圆粮食制品厂;玉米水解液、麦芽汁、大米水解液为实验室自制。
1.3酶制剂
糖化酶(50 000 U/g)、高温淀粉酶(20 000 U/ mL)、中温淀粉酶(6 000 U/g)均来自无锡酶制剂厂;酸性蛋白酶(3 000 U/g)为实验室自制。
1.4酵母计数方法
酵母计数采用血球计数板法(计数板规格:0.1 mm,1/400 mm2,XB-K-25)。称取10 g固态发酵培养基,加90 mL无菌生理盐水,充分混匀,1 000 r/min离心10 min,取上清稀释适当倍数,显微镜下进行计数。
1.5葡萄糖含量测定
兰-埃农法[5]。称取10 g固态发酵培养基,加90 mL无菌水,充分混匀,3 000 r/min离心10 min,取上清,稀释适当倍数后,滴加到一定量沸腾的裴林试液中,用亚甲基兰为指示剂,滴至刚好褪色。
1.6氨基氮测定
甲醛法测定[6]。
1.7二氧化碳排放量测定
氨吸收法[7]。
2 结果与讨论
2.1固态发酵培养基的优化
2.1.1不同原料对酵母生长的影响
酵母这类兼性微生物,在利用等量的能源物质过程中,有氧环境生长所得到的细胞产量比缺氧时高得多。由图1可看出:单用颗粒状小麦或早籼米进行酵母培养,因其黏性大,通气性不足,不能为酵母提供良好的有氧环境,因而酵母数较少。而麸皮材料结构疏松,通气性良好,再加入小麦、早籼米和玉米粉补充一定的碳源,在满足通气的前提下,同时弥补麸皮本身淀粉含量不足的缺陷,故而选择玉米粉与麸皮组合。

图1 不同原料对酵母生长的影响
2.1.2米糠添加量对酵母生长的影响
以米糠添加量进行比较实验,结果表明:适当比例的米糠与麸皮对提高酵母菌活菌数有一定的促进作用,米糠在麸皮中的比例以5%最佳。米糠中含有少量淀粉和磷酸盐物质,具有补充碳源和无机盐类的双重作用。由图2可知:米糠添加量对酵母菌活菌数的影响很明显,但米糠粉(过60目)添加量不宜过大,否则会降低体系的通气性,在一定程度上抑制酵母菌的增值。

图2 米糠在麸皮中的比例对酵母生长的影响
2.1.3固体发酵培养基优化试验
以酒精活性干酵母为生产菌,在三角瓶中进行固体发酵,以麸皮、玉米粉、米糠粉为试验因素,设计L9(33)正交试验对培养基进行优化。

表1 正交因素水平表

表2 正交试验结果
由表2的正交结果及极差分析可知:A,B,C三因素对酵母菌活菌数影响显著性大小依次为B(麸皮)>A(玉米粉)>C(米糠粉)。分析结果表明A1B1C2为最佳组合,即酒精活性干酵母培养基优化的最佳物料组合为:玉米粉3 g,麸皮4 g,米糠0.4 g。经正交试验验证,物料组成为3 g玉米粉、4 g麸皮、0.4 g米糠时,酵母活菌数可达3.7×109CFU/g。
2.1.5糖化酶添加量对酵母生长的影响
在上述优化的物料配比的基础上,将一定量的糖化酶液与活化好的酵母种子液一起拌入固定配比的物料中,进行发酵。由图3可知:随着加酶量的增加,酵母活菌数逐渐增加,当加酶量高于150 U/g时,酵母细胞数并无明显增长。结合经济效益,糖化酶添加量为150 U/g。
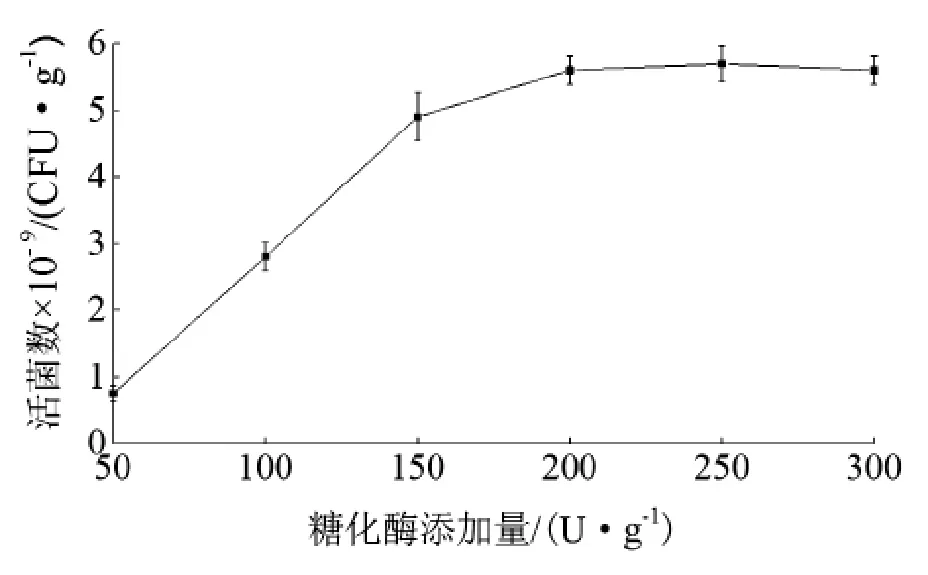
图3 糖化酶添加量对酵母生长的影响
2.1.6蛋白酶添加量对酵母生长的影响
在上述优化的物料配比的基础上,将一定量的蛋白酶液(每克原料中分别添加5,10,15,20,25,30,40 U/g的酸性蛋白酶)与活化好的酵母种子液一起拌入固定配比的物料中,进行发酵。由图4可知:加酶量在20 U/g以上时,酵母活菌数并没有多大变化,因此蛋白酶最佳添加量为20 U/g。

图4 蛋白酶添加量对酵母生长的影响
2.1.7酵母菌生长曲线测定
在上述实验的基础上,在因素的最佳指标下进行酵母细胞生长曲线的测定,即玉米粉3 g,麸皮4 g,米糠粉0.4 g,并添加150 U/g糖化酶和20 U/g蛋白酶。由图5可知:酵母在0~32 h为延滞期,氨基氮利用量滞后于分解量,因而氨基氮量在增加,32~39 h为对数生长期,氨基氮用量迅速增加,氨基氮含量迅速下降,50 h以后酵母进入衰退期。在整个变化过程中,水分蒸发量逐渐增加,进入衰退期后,基本保持不变。二氧化碳排放量在进入对数增长期时有较大增加,衰退期几乎保持不变。酸度在整个生长过程中保持pH 5.5不变。

图5 酵母菌生长曲线
2.2载体发酵初步研究
2.2.1载体颗粒大小对酵母生长的影响
取玉米粉200 g,加水100 mL,调pH至5.5左右,添加3 U/g的中温淀粉酶,1 000 U/g高温淀粉酶,80~85℃加热50 min,继续加热至100℃灭酶。调pH至4.5,添加150 U/g的糖化酶,60℃下放置20 h[8]。最终玉米水解液糖度为15.5,DE 值94.52。以玉米水解液为培养基,调整糖度为10度,植入0.5 g不同颗粒大小的多孔性PVC泡沫中,培养酵母菌。取一定量发酵结束的PVC泡沫浸泡到生理盐水中一定时间,进行血球板计数。结果如图6所示。由图6可知:PVC泡沫颗粒大小在2 mm左右时酵母的增值效果最佳。从最大表面积角度来说,球形是最佳的,在实际应用中,以不阻碍该多孔性物质运动为准。

图6 载体颗粒大小对酵母生长的影响
2.2.2玉米水解液添加量对酵母生长的影响
分别添加不同量的玉米水解液培养基,糖度为10度,植入0.5 g颗粒大小2 mm左右的多孔性PVC泡沫中,培养结果如图7所示。经分析,每克多孔性物质添加15 mL玉米水解液最佳。当液体过量,覆盖整个物体的表面,会阻碍氧气与菌体细胞的接触,导致营养供应不足,不利于菌体生长。
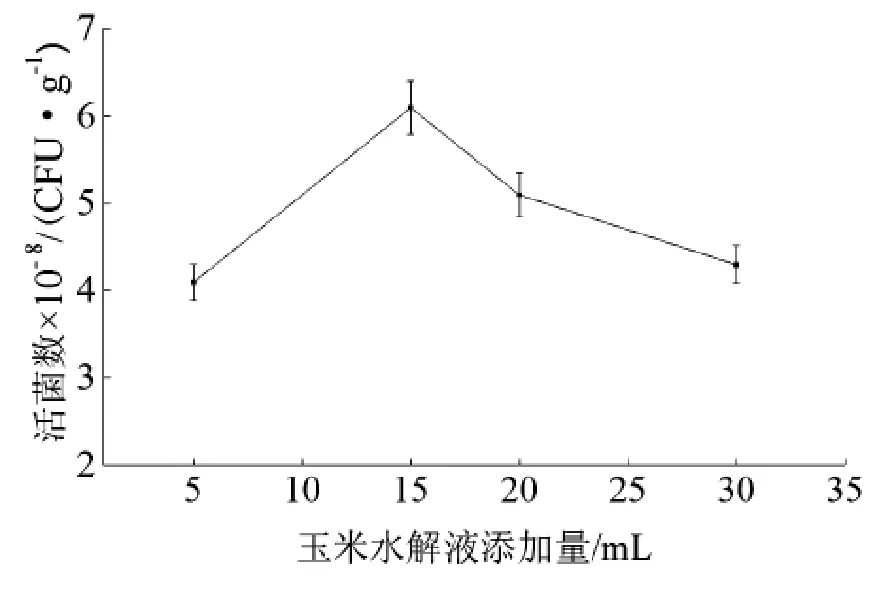
图7 玉米水解液添加量对酵母生长的影响
2.2.3玉米水解液糖度对酵母生长的影响
以15 mL不同糖度的玉米水解液为培养基,植入颗粒大小2 mm左右的多孔性PVC泡沫中,测定酵母细胞生长的情况,结果见图8。由图8可知:在低糖度的玉米水解液培养基中,由于养料不足,酵母细胞数较少。随着糖度的增加,酵母数迅速增加,糖度大于10度时,酵母活菌数基本保持不变,所以最佳浓度为10度。

图8 玉米水解液糖度对酵母生长的影响
2.2.4载体培养酵母菌生长曲线
以糖度为10度的玉米水解液为培养基,每克多孔性物质添加15 mL玉米水解液,PVC泡沫颗粒大小2 mm左右,测定酵母细胞生长曲线。由图9可知:酵母在0~24 h为延滞期,细胞数增长较慢,在20~32 h为对数生长期,细胞增殖很快,同时糖的利用量大,二氧化碳排放增加;在32~38 h为稳定期,糖量变化减慢,二氧化碳排放速度基本不变;38 h后进入衰退期,糖量几乎无消耗,二氧化碳排放量基本不变。在整个生长过程中,水分蒸发量先逐渐增加,后略微减少。
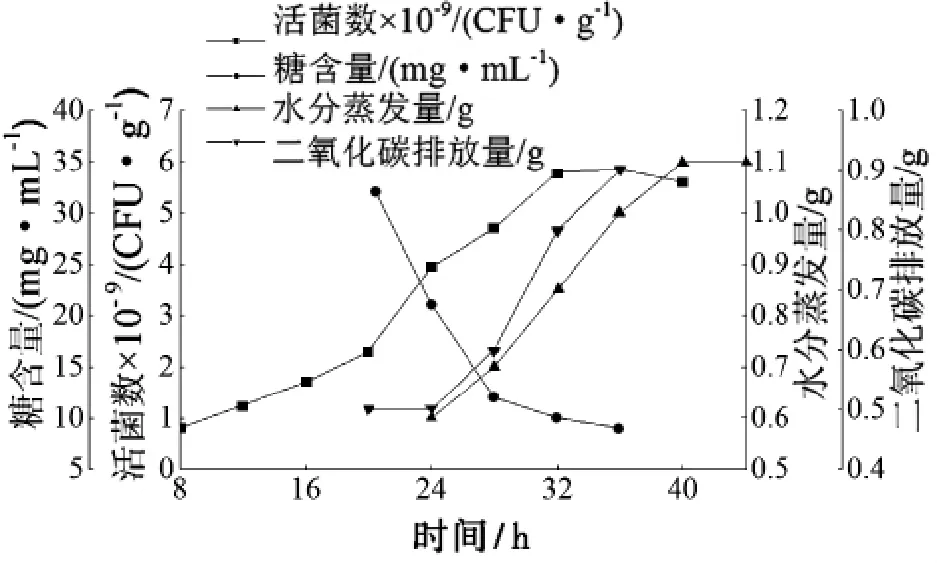
图9 载体培养酵母菌生长曲线
3 结 论
本研究通过培养条件的优化固态培养酿酒活性干酵母,活菌数高达4.47×109CFU/g。添加一定量的麸皮、玉米粉、米糠、糖化酶和酸性蛋白酶后,活菌数提高了34.2%,高达6.0×109CFU/g。把玉米水解液植入到多孔性材料中进行载体培养,酵母细胞数高于5.0×108CFU/mL,且后期酵母菌体的收集更方便,只需用缓冲液将菌体从PVC多孔性材料中冲洗下来。
参考文献:
[1]张辉,李海梅,程建军,等.鲁氏酵母和球拟酵母活性干酵母的制备研究[J].食品工业科技,2007,28(8):63-66.
[2]莫丽春,彭文,曾里,等.酿酒活性干酵母生理特性的研究[J].中国酿造,2012,31(2):117-120.
[3]赵志华,岳田利,王燕妮,等.酿酒活性干酵母(AADY)的研究[J].中国酿造,2006,25(11):1-4.
[4]OSHITA K,FUKUI N,YOMO H,et al. Method of producing active dry yeast:US20040018274[P]. 2004-1-29.
[5]胡永松,王忠彦.微生物与发酵工程[M].成都:四川大学出版社,1987:3.
[6]沈萍,范秀荣,李广武,等.微生物学实验[M].北京:高等教育出版社,1988:6.
[7]曾庆.氨法吸收二氧化碳的实验研究[D].北京:清华大学,2011. [8]于景芝.酵母生产与应用手册[M].北京:中国轻工业出版社,2005.
(责任编辑:朱小惠)
Study on the production of active dry yeast by solid fermentation
LOU Zhijian1,DAI Liwei2,ZHANG Yanli2
(College of Biotechnology and Bioengineering,Zhejiang University of Technology,Hangzhou 310014,China)
Abstract:The solid state fermentation medium of active dry Saccharomyces cerevisiae was optimized with bran,corn powder and rice bran as raw material. The number of yeast cells was higher than 4.47×109CFU/g. After further optimization of the culture medium with addition of certain amount of glucoamylase and acid protease,the number of yeast cells reached 6.0×109CFU/ g. Furthermore,the corn hydrolysate was added to the porous material during the carrier culture and the number of yeast cells was higher than 5.0×108CFU/mL.
Keywords:active dry yeast;solid fermentation;porous material;glucoamylase;acid proteinase
作者简介:楼志坚(1965—),男,浙江义乌人,工程师,主要从事生物化工、安全生产方面的研究,E-mail:2488415594@qq. com.
收稿日期:2015-10-14
中图分类号:TQ92
文献标志码:A
文章编号:1674-2214(2016)02-0098-05