L-瓜氨酸生产菌株的筛选及鉴定
吴石金,戴安迪(浙江工业大学生物工程学院,浙江杭州310014)
L-瓜氨酸生产菌株的筛选及鉴定
吴石金,戴安迪
(浙江工业大学生物工程学院,浙江杭州310014)
摘要:通过选择性培养基初筛(利用精氨酸双水解酶筛选培养基)和复筛(高效液相色谱法测定L-瓜氨酸质量浓度),从杭州市勾庄地区西瓜大棚的土壤中筛选获得45株产L-瓜氨酸菌株。其中一株细菌(菌株编号11)转化L-精氨酸生产L-瓜氨酸的能力最强,产生的L-瓜氨酸浓度最高,0.344 g湿菌,在60 mL转化体系中转化一天,可将20 g/L的底物L-精氨酸转化为9.31 g/L的L-瓜氨酸。对11号菌株分别进行形态学观察,生理生化试验及分子生物学鉴定,初步鉴定该菌株为粪肠球菌(Enterococcus faecalis)。
关键词:L-瓜氨酸;粪肠球菌;筛选鉴定
L-瓜氨酸(L-citrulline)是人体尿素循环中的一种代谢中间产物,有利尿作用,临床上常与L-精氨酸、L-鸟氨酸等共同用于治疗高氨血症[1]。近年来,众多国内外研究表明L-瓜氨酸还具有很多其他重要的生理功能,如清除有害的自由基、抗氧化、稳定血压、指示异体排斥效应[2-3],瓜氨酸还可松弛血管,增强男性性功能,以及治疗性功能障碍[4]。
目前,生产L-瓜氨酸的方法主要有生物发酵法、化学合成法、提取法和酶法。发酵法生产L-瓜氨酸的缺点是产率低[5];化学法生产的产品中含有L-瓜氨酸的旋光对映体D-瓜氨酸[6];提取法的生产工艺相对困难,产品很难纯化,因此成本比较高;酶法的优点是生产条件温和,产品中无D型旋光对映体产生[11]。酶法生产L-瓜氨酸是一种效率高、成本低的生产方法,将在瓜氨酸生产中起到重要作用[7-9]。已有报道利用铜绿假单胞菌[10]、恶臭假单胞菌[11]、乳酸乳球菌[12]等提取精氨酸脱亚胺酶,转化生产L-瓜氨酸,但瓜氨酸产量低,工艺也尚不成熟。转化能较强的菌株将在未来瓜氨酸生产中扮演重要角色。
1 材料与方法
1.1材料与试剂
1.1.1实验材料
土壤样品:杭州市勾庄地区西瓜大棚土壤表层5~10 cm的沃土以及大棚旁边沟渠中的水样适量。西瓜根系纤弱,耐干不耐湿,所以培育的土壤多为旱地,瓜氨酸具有一定的耐旱作用,能产生瓜氨酸菌株能在旱地较好的生存,故选取西瓜大棚土壤作为取样来源。
1.1.2主要试剂
L-瓜氨酸标准品购于Sigma试剂公司;L-精氨酸购于上海蓝季生物公司;乙腈(色谱纯,美国天地有限公司);2,4-二硝基氟苯购于豪普斯生物试剂公司;其余试剂均为分析纯。
1.1.3培养基与试剂
牛肉膏蛋白胨培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH 7.4,115℃灭菌30 min。
筛选培养基:蛋白胨1 g/L,NaCl 5 g/L,KH2PO40.3 g/L,L-精氨酸10 g/L,酚红0.01 g/L,pH 6.7,固体培养基另加琼脂20 g/L,115℃灭菌30 min。
种子培养基:蛋白胨10 g/L,牛肉膏5 g/L,NaCl 3 g/L,KH2PO42 g/L,pH 7.2,115℃灭菌30 min。
发酵基本培养基:蛋白胨10 g/L,酵母膏5 g/ L,NaCl 10 g/L,L-精氨酸2 g/L,pH 7.2,115℃灭菌30 min。
转化液成分:pH 6.0的底物精氨酸质量浓度为20 g/L,0.4 mol/L的NaAc-HAc缓冲液,115℃灭菌30 min。
衍生剂试剂:Na2CO3-NaHCO3缓冲液的配制,准确称取Na2CO3和NaHCO3,制成0.5 mol/L Na2CO3和0.5 mol/L NaHCO3溶液,用Na2CO3调NaHCO3的pH值为9.0,即制得Na2CO3-NaHCO3缓冲液。
2,4-二硝基氟苯乙腈液的配制:准确量取2,4-二硝基氟苯,制得体积分数为1.5%的2,4-二硝基氟苯乙腈溶液。
K2HPO4-KH2PO4缓冲液的配制:准确称取K2HPO4和KH2PO4,制成0.1 mol/L的K2HPO4和KH2PO4溶液,互调pH值至7.0,即制得K2HPO4-KH2PO4缓冲液。
流动相A的配制:含1%N,N-二甲基甲酰胺(体积分数)的0.05 mol/L NaAc和HAc缓冲溶液。分别准确配制0.05 mol/L的NaAc和HAc溶液,用HAc调NaAc溶液的pH值至6.4,然后加入溶液体积1%的N,N-二甲基甲酰胺,用0.45 μm水相膜过滤。流动相B的配制:V(乙腈):V(水)=3:1,用0.45 μm有机膜过滤。
1.2仪器与设备
双层全温恒温培养摇床;D-3752型台式高速冷冻离心机,德国ThermoFisher;SPX-250B-Z型生化培养箱,上海博迅医疗设备厂;YXQ-LS-S型全自动立式电热压力蒸汽灭菌锅,上海博迅医疗设备厂;GE-100型DNA水平电泳仪;Mastercycler型聚合酶反应仪,德国Eppendorf;Gel Dac XR+型凝胶成像系统,美国BIO-RAD;光学显微镜,日本尼康;分光光度计,美普达仪器公司;恒温水浴锅,万华实验仪器厂;Agilent 1260高效液相色谱仪,美国安捷伦公司。
1.3实验方法
1.3.1样品的处理
将从菌源地采样得来的样品分别溶于无菌生理盐水中,置于30℃摇床1 h混匀。
1.3.2初筛[13-14]
取上述土壤悬浊液溶于无菌水中,梯度稀释,取10-4、10-5、10-63种稀释度,取0.2 mL涂布于固体筛选平板上,倒置放入30℃恒温培养箱,充分培养。若菌落能产生精氨酸脱亚胺酶,脱去精氨酸的亚氨基,同时生成瓜氨酸和氨,氨成碱性,会使培养基中添加的酚红指示剂变成红色,形成红色的变色圈。
每日定时观察上述平板上菌株的生长情况,若发现周围有红色变色圈菌落,立即挑取菌落在LB固体培养基上进行划线纯化,经过菌落形态特征观察和镜检,初步认定为纯种,各自用甘油冻存保藏,并编号。将上述保藏菌株接于液体筛选培养基中,30℃培养。培养基转变为红色者为阳性,以不加精氨酸的液体筛选培养基作为对照。保留所有阳性菌株,编号保藏。
1.3.3复筛[15]
通过初筛得到的菌株分别接种到液体种子培养中,37℃,180 r/min培养12 h获得均匀的种子,然后以2%(体积分数)的接种量分别接到100 mL发酵培养基中,30℃,180 r/min培养24 h。将培养好的菌液6 000 r/min离心10 min,用灭菌生理盐水洗涤菌体1~2次,转入0.4 mol/L醋酸缓冲液中(底物精氨酸质量浓度为20 g/L,pH 6),反复吹打均匀,装液量60 mL,置于37℃,180 r/min摇床中进行转化。高效液相色谱法测定转化液中瓜氨酸质量浓度。
瓜氨酸衍生化方法:转化液10 000 r/min离心5 min,取1 mL放入10 mL的棕色容量瓶中(衍生物见光易分解),加入配制好的Na2CO3-NaHCO3缓冲液1 mL,再加入1 mL的2,4-二硝基氟苯乙腈溶液后摇匀,60℃水浴加热1 h后,用K2HPO4-KH2PO4缓冲液定容。衍生化后的样品10 000 r/min离心5 min,取0.6 mL入棕色液相瓶中待用。
高效液相色谱法检测条件设置:使用Agilent XDB-C18色谱柱(250 mm×4.6 mm)。流动相A为含1%(体积分数)N,N-二甲基甲酰胺的0.05 mol/ L NaAc和HAc缓冲溶液,流动相B为乙腈-水,进样量5 μL。实验采用梯度洗脱,流动相A和B的体积比为:初始A与B的体积比为3:1,10 min 后A与B的体积比为2:3,13 min时A与B的体积比增至1:19,17 min时A与B的体积比还原为3:1,20 min洗脱结束。流速1.0 mL/min,进样量5μL,二极管阵列(DAD)检测器,检测波长360 nm。
瓜氨酸标准曲线的绘制:精确称取瓜氨酸标准品(购自Sigma公司)10 mg,用去离子水溶解并定容至5 mL,质量浓度为2 g/L。衍生化定容,按照上述液相检测方法,分别进样2、4、6、8、10 μL,平行进样5次,记录瓜氨酸的峰面积。以瓜氨酸的进样量为横坐标,对应的峰面积为纵坐标,绘制标准曲线。
1.3.4菌株鉴定[16-17]
1)细菌形态学特征及生化鉴定
将菌株接种到牛肉膏蛋白胨平板和液体培养物中,培养24 h后分别作革兰染色,光学显微镜及电子显微镜观察其形态,并对11号菌株进行生化鉴定。
2)分子生物学鉴定
采用16S rDNA序列分析法对菌株进行鉴定。用OMEGA公司的基因组提取试剂盒(E.Z.N. A.TM Bacterial DNA Kit)快速提取菌株基因组DNA。以基因组DNA为模板,以通用引物F27和R1492为引物进行16S rDNA序列扩增。
通用引物序列具体如下所示:
F27:5′-GAGTTTGATCCTGGCTCAG-3′
R1492:5′-AGAAAGGAGGTGATCCAGCC-3′
PCR扩增反应体系:96℃预变性5 min,95℃变性45 s,58℃退火45 s,72℃延伸90 s,30个循环。72℃延伸10 min。PCR产物交由GENEWIZ公司测序,进行16S rDNA基因序列比对。
2 结果与分析
2.1瓜氨酸HPLC检测图谱及标准曲线
分别进样衍生剂和瓜氨酸衍生后产物,由液相图谱图1(a)可知衍生剂的出峰时间大约为5.768 min,由图1(b)可知瓜氨酸衍生物的出峰时间内大概为5.159 min左右。
以瓜氨酸浓度为横坐标,峰面积为纵坐标,绘制标准曲线,回归系数R2=0.997,线性关系良好。图1(c)为瓜氨酸标准曲线。
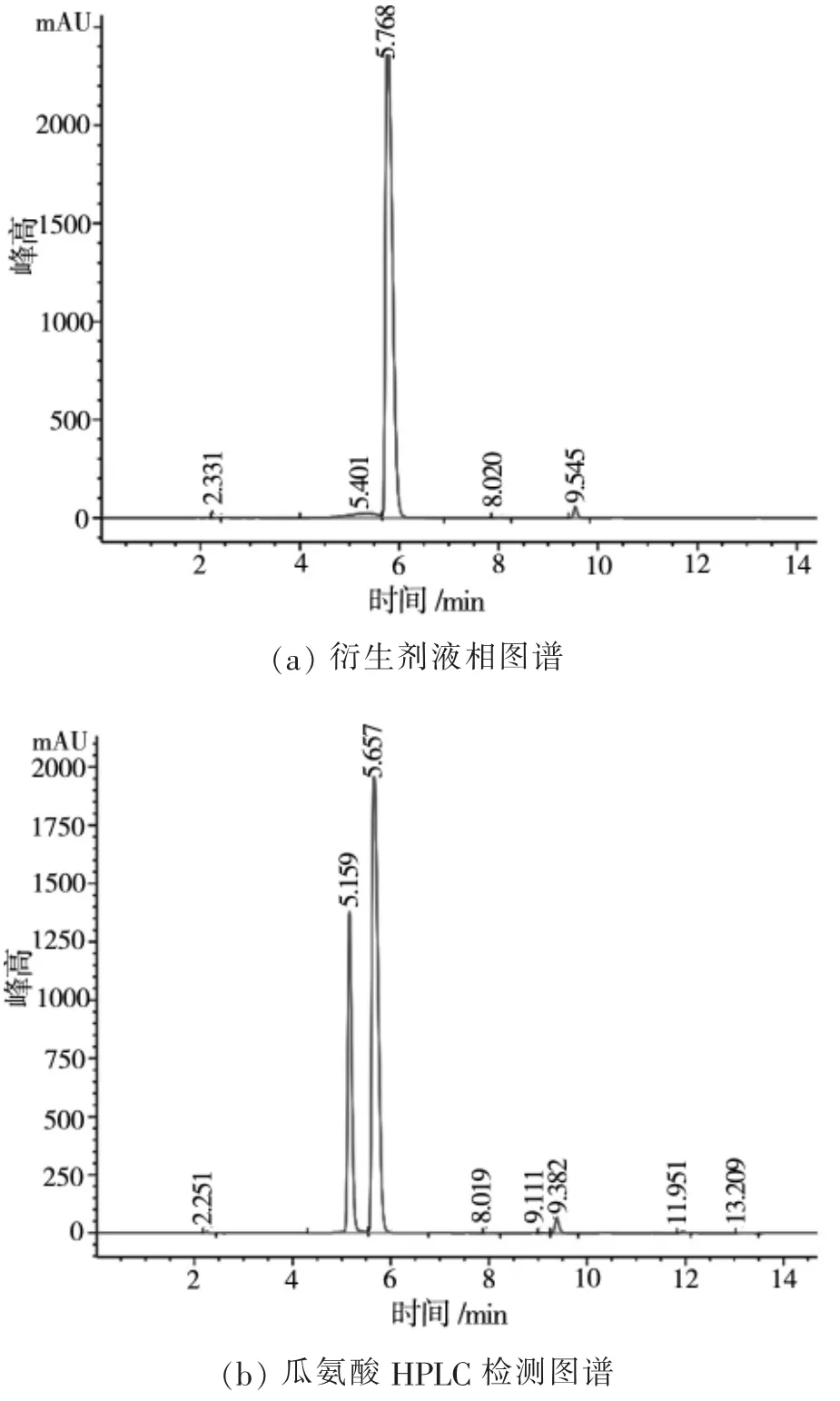
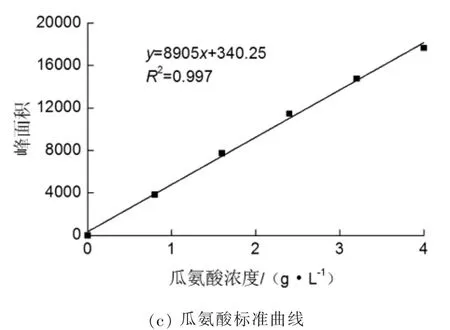
图1 瓜氨酸HPLC检测图谱及瓜氨酸标准曲线
2.2初筛
将土壤样品溶于无菌水梯度稀释后涂布于固体筛选培养基上,倒置于30℃培养箱中充分培养,挑选出菌落周围产生红色变色圈的菌株,划线纯化,经过菌落形态特征观察和镜检,初步认定为纯种的菌株有168株。将上述菌株接于液体筛选培养基中,30℃培养。培养基转变为红色者为阳性,以不加精氨酸的液体筛选培养基作为对照,排除本身代谢产物呈碱性的菌株,共有45株呈阳性,为初筛对象。
2.3复筛
将初筛出来的45株接入50 mL种子液中,活化后按照1.3.3中的方法进行复筛,转化液离心取上清,衍生化后HPLC测定瓜氨酸质量浓度,结果见表1。
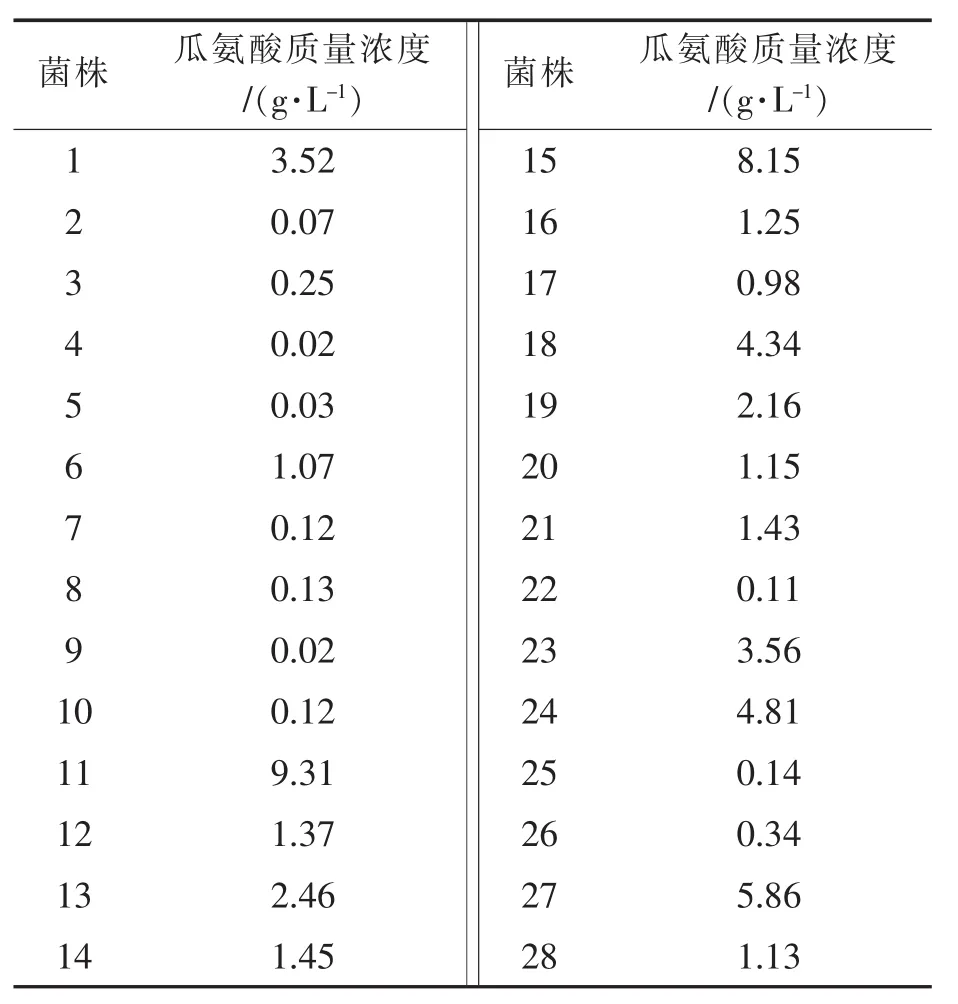
表1 不同菌株瓜氨酸质量浓度检测结果比较
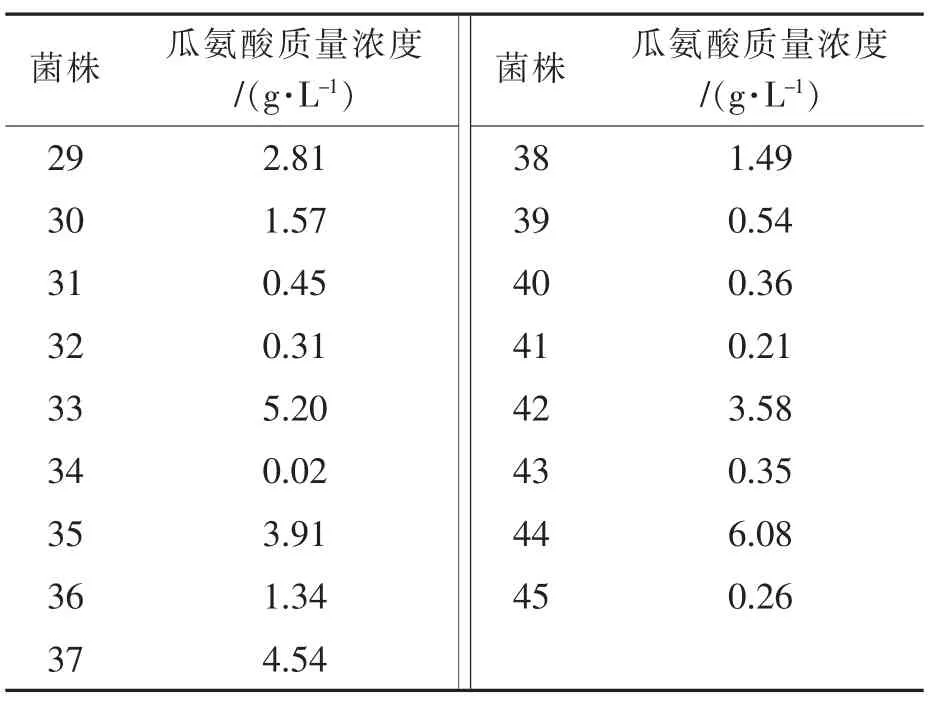
菌株 瓜氨酸质量浓度/(g·L-1) 菌株 瓜氨酸质量浓度/(g·L-1)29 2.81 38 1.49 30 1.57 39 0.54 31 0.45 40 0.36 32 0.31 41 0.21 33 5.20 42 3.58 34 0.02 43 0.35 35 3.91 44 6.08 36 1.34 45 0.26 37 4.54
由表1可知,经HPLC检测,11号菌株转化液中瓜氨酸质量浓度最大,远高于其他菌株。因此选择11号菌作为目的菌进行后续实验。11号菌转化液HPLC检测图谱见图2(5.190 min为瓜氨酸衍生物出峰,5.717 min为精氨酸衍生物出峰,5.891 min为剩余衍生剂出峰)。
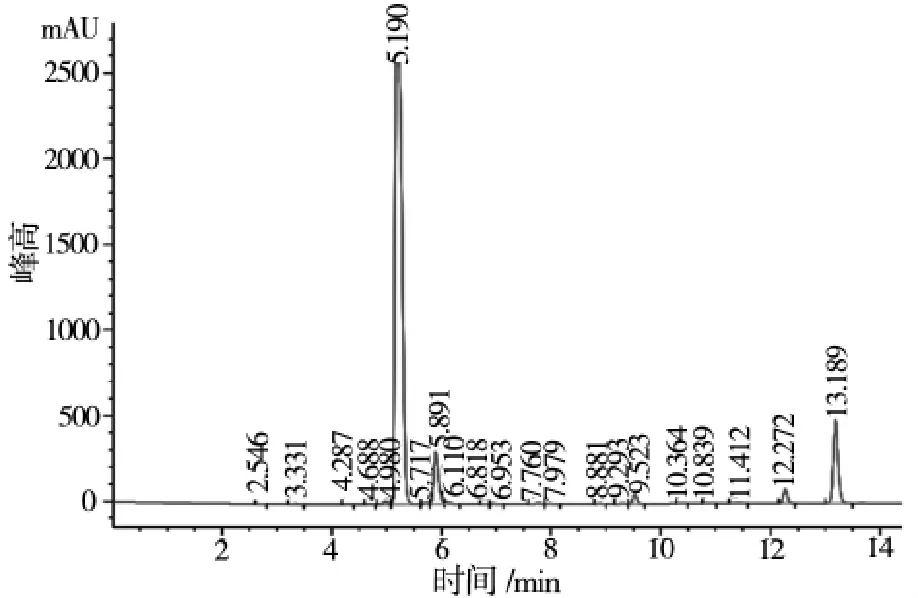
图2 11号菌转化液HPLC检测图谱
2.4菌株鉴定
2.4.1形态及生化鉴定
菌体在牛肉膏蛋白胨固体培养基中形态:菌落呈圆形,边缘整齐,凸起,菌落呈白色半透明见图3(a)。革兰氏染色后菌体球状呈阳性见图3 (b),阴性杆菌为实验室保藏的气单胞菌。透射电镜(负染)下见图3(c),菌体呈球状,未见鞭毛。根据16S rDNA的比对结果确定菌株所在的属,配合《常见细菌系统鉴定手册》研究菌株的生化特征,菌株生化特征见表2。
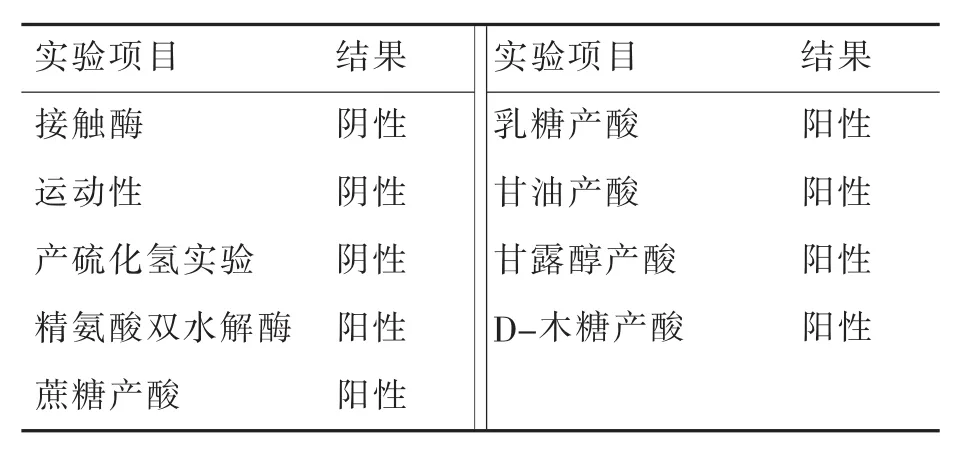
表2 菌株11生理生化试验
2.4.2分子生物学鉴定
16S rDNA区域序列同源性分析是一种常用的细菌分子鉴定方法。菌株的16S rDNA片段扩增后测序得到一个长为1 447 bp的序列,16S rDNA以及Marker的琼脂糖电泳见图4(泳道M 为Marker,泳道1为PCR产物)。将所得有效序列在NCBI中进行BLAST同源序列搜索,根据搜索结果,选取相似性较高的菌种的相关序列进行分析。利用MEGA5软件中的Neighbor-Joining法对结果进行比对分析,以漫游菌属(Vagococcus Collins NCBI登录号为NR_118902.1)为外群,构建系统发育树,Bootstrap values为100(图5)。分析结果表明,菌株11与粪肠球菌遗传距离最近,同源性高达99%,因此初步鉴定11为粪肠球菌(Enterococcus faecalis)。
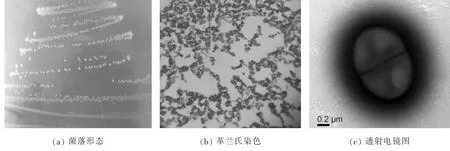
图3 菌株11形态观察
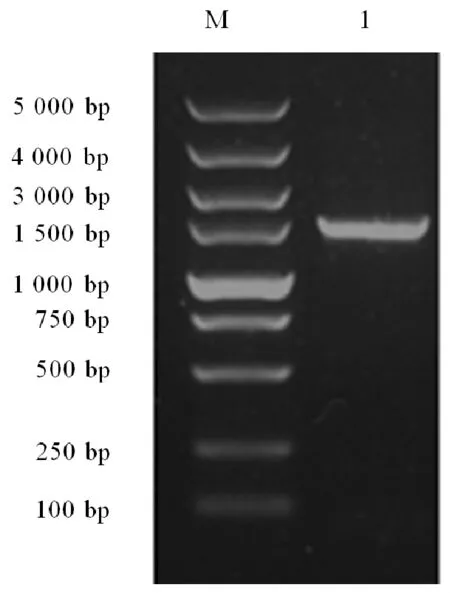
图4 菌株11 16S rDNA PCR产物电泳凝胶成像图
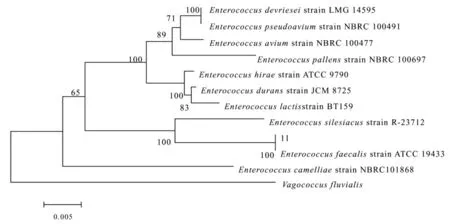
图5 菌株11系统发育树
3 讨 论
瓜氨酸是一种非蛋白质氨基酸,有着非常广泛的应用前景。11号菌株在较为简单的培养基和发酵工艺条件下就具有较强的精氨酸生产能力,为酶法生产瓜氨酸工业化的研究夯实基础。通过对11号菌株的形态学观察、生化试验及分子生物学鉴定,认定该菌株为粪肠球菌(Enterococcus faecalis)。初步研究表明,菌株11可将20 g/L的精氨酸转化为9.31 g/L的瓜氨酸,转化率为46.28%。国内对于粪肠球菌酶法生产瓜氨酸的报道较多,如王莹等[18]研究了粪肠球菌SK23.001产瓜氨酸的发酵条件,优化后以蔗糖为碳源,大豆蛋白胨和NH4Cl为氮源,接种为3%,装液量为50 mL/250 mL,起始pH 6.0,温度37℃,100 g/L精氨酸转化反应6 h,瓜氨酸产量可达83.06 g/L。李成付等[19]对复合诱变后的粪肠球菌NJ402进行了精氨酸脱亚胺酶酶学性质研究,经SephadexG-75凝胶柱层析纯化后,其比酶活为8.151 U/mg。张鹏等[20]用海藻酸钠对粪链球菌Streptococcus faecalis CGMCC1866进行固定化,每升反应液能产生瓜氨酸112~165 g/L。本文筛得的11号菌株并未表现出如此之高的瓜氨酸产量,可能是由于碳氮源等发酵条件,底物浓度等转化条件不适宜,导致菌体生长缓慢,瓜氨酸产量偏低。若后续能对其进行复合诱变,酶定向改造,探索其发酵、转化等因素的最优条件,提高瓜氨酸产量,可能在酶法生产瓜氨酸领域有更广阔的应用前景。
参考文献:
[1]张克旭.氨基酸发酵工艺学[M].北京:中国轻工业出版社,1992.
[2]曾小峰,艾脉兴,甘晓丹,等.抗环瓜氨酸肽抗体检测在类风湿关节炎中的意义[J].中华风湿病学杂志,2002,15(5):281-285
[3]郑春福,林建银. L-精氨酸和L-瓜氨酸在体外活化巨噬细胞抗弓形虫感染中的作用[J].中国寄生虫病学杂志,1998,16 (5):326-330.
[4]王晶,赵晶.一氧化氮的生物学效应[J].中国基层医药,2003,10(12):1316-1318.
[5]SHINJI O,MASAO S,SHIMPACHI K,et al. Method of producing citrulline by bacterial fermentation:US 3282794[P]. 1966-11-1.
[6]PLIMMER R H A. The analysis of proteins. I. The estimation of arginine by decomposition with alkali[J]. Biochemical journal,1916,10(1):115-119.
[7]曹瑜,李加友,焦庆才.酶法转化制备L-瓜氨酸[J].精细化工,2005,22(10):759-761.
[8]李加友,曹瑜,钱绍松,等.精氨酸脱亚胺酶发酵条件研究[J].化学反应工程与工艺,2006,22(1):43-47.
[9]KOZO Y,TADASHI S,TESUY T.用臭味加蛋胞菌杆菌固定化菌体连续生产L-瓜氨酸[J].工业微生物,1979(9):66-72.
[10]OUDJAMA Y,TRICOT C,STALON V,et al. Overexpression,purification,crystallizationandpreliminary X-raycrystallographic analysis of Pseudomonas aeruginosa L-arginine deiminase[J]. Biological crystallography,2002,58(12):2150-2152.
[11]张媛媛,刘晓蓉,周爱芳.恶臭假单胞菌产精氨酸脱亚胺酶发酵条件及特性的研究[J].中国酿造,2011,232(7):54-56.
[12]KIM J E,JEONG D W,LEE H J. Expression,purification,and characterization of arginine deiminase from Lactococcus lactis ssp. lactis ATCC 7962 in Escherichia coli BL21[J]. Protein expression and purification,2007,53(1):9-15.
[13]李加友.高产精氨酸脱亚胺酶菌株的筛选鉴定和发酵特性研究[J].食品科技,2010,35(5):11-18.
[14]方佳茂.一株产L-瓜氨酸微生物菌株的鉴定[J].发酵科技通讯,2010,39(2):16-19.
[15]牟,袁其朋,翁南梅,等.高效液相色谱分析L-瓜氨酸的研究[J].北京化工大学学报,2004,31(3):110-113.
[16]东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[17]黎满香,林荣高,薛立群,等.湖南猪源粪肠球菌的分离鉴定及16S rDNA系统进化分析[J].中国兽医学报,2011,31(9):1290-1294.
[18]王莹,张涛,江波,等.粪肠球菌SK23.001产瓜氨酸发酵条件的优化研究[J].食品工业科技,2012,24(33):233-241.
[19]李成付,李凯,李加友,等.粪肠球菌精氨酸脱亚胺酶酶学性质研究[J].微生物学通报,2008,35(6):846-850.
[20]张鹏,张淑荣,刘春巧,等.固定化细胞连续生产L-瓜氨酸的方法:CN1948464A[P]. 2006-11-24.
(责任编辑:朱小惠)
Screening and identification of L-citrulline producing strains
WU Shijin,DAI Andi
(College of Biotechnology and Bioengineering,Zhejiang University of Technology,Hangzhou 310014,China)
Abstract:Forty-five L-citrulline producing strains were preliminarily screened from Hangzhou watermelon greenhouse soil using arginine dihydrolase selective medium and their productivities were determined by HPLC. The strain of NO.11 had the highest ability to convert L-arginine to L-citrulline. 20 g/L L-arginine was converted into 9.31 g/L L-citrulline in 60 mL reaction mixture in one day with 0.344 g wet cells. The strain was identified as Enterococcus faecalis by morphology observation,physiological and biochemical characterization and molecular biological identification. Keywords:L-citrulline;Enterococcus faecalis;screening
作者简介:吴石金(1971—),男,江西赣州人,教授,博士,研究方向为生物化学与应用分子生物学,E-mail:wujan28@zjut. edu.cn.
基金项目:浙江省自然科学基金资助项目(GB14021050070)
收稿日期:2015-12-04
中图分类号:Q93
文献标志码:A
文章编号:1674-2214(2016)02-0088-06