蛋白质组学技术及其在工业微生物研究中的应用
王亚军,王超儿,朱 津,罗 希(1.浙江省生物有机合成技术研究重点实验室,浙江杭州310014;2.浙江工业大学生物工程学院,浙江杭州310014)
蛋白质组学技术及其在工业微生物研究中的应用
王亚军1,2,王超儿1,2,朱津1,2,罗希1,2
(1.浙江省生物有机合成技术研究重点实验室,浙江杭州310014;2.浙江工业大学生物工程学院,浙江杭州310014)
摘要:随着后基因组时代的到来,蛋白质组学的研究受到越来越多的关注,双向凝胶电泳和生物质谱技术是蛋白质组学研究的两大工具。微生物被广泛应用于食品、化工、医药等领域,随着这些领域的快速发展,利用蛋白质组学技术解析微生物代谢途径及调控机制越来越受到重视,从而为进一步的菌种改良提供理论依据。主要综述了蛋白质组学相关技术及其在工业微生物代谢途径与调控机制研究中的应用进展。
关键词:蛋白质组学;双向电泳;质谱;微生物育种
蛋白质组学是基于蛋白质分离、质谱鉴定的一门新兴学科,是从细胞、组织或生物体整体角度来研究蛋白质组成及变化,从蛋白质水平解析代谢过程及其调控机制。蛋白质组学研究不仅弥补了传统方法对单个蛋白质研究的局限性,而且其研究结果是对基因组学、转录组学的补充和验证,它比基因组学和转录组学更能够代表生物体真实的生命活动规律。早期蛋白质组学应用于微生物代谢途径及其调控机制的研究大多集中于病源性微生物的致病机理和耐药机理的解析。随着工业微生物的应用和发展,尤其在食品、化工、医药等领域的应用不断拓展,利用蛋白质组学技术研究其代谢机制,寻找促进细胞增殖、产物合成和副产物阻遏的关键蛋白质,为进一步的菌种代谢工程育种提供理论依据具有重要意义,因此蛋白质组学在工业微生物研究中的应用也越来越广泛。
1 蛋白质组学关键技术
1.1基于凝胶分离的蛋白质组学技术
基于凝胶分离的蛋白质组学技术是指利用双向凝胶电泳(2-DE,two-dimensional polyacrylamide gel electrophoresis)分离蛋白质样品,对分离后单一的蛋白质进行质谱鉴定的技术。同时,我们也能直接从2-DE图像上得到蛋白质的等电点(p I)和分子量(Mw),利用PDQuest、ImageMaster 2D platinum、Decyder 2D等图像分析软件进行蛋白质表达量分析,某些样品甚至能通过2-DE图像数据库进行蛋白质点的初步鉴定,对2-DE图谱中某些蛋白质点还可进行免疫测试、氨基酸分析等(图1)。
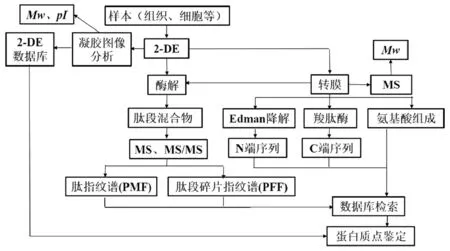
图1 基于2-DE的蛋白质组学研究示意图
1.1.1 2-DE简介
2-DE综合了等电聚焦(Isoelectric focusing,IEF)和聚丙烯酰胺凝胶电泳(SDS-PAGE)技术,复杂的蛋白质样品首先在第一维(IEF)基于p I的差异实现分离,然后在第二向(SDS-PAGE)根据Mw大小不同分离。理论上,由此得到的2-DE图像中每一个点都代表一种蛋白质。
经过40年的发展,2-DE体系已形成了一系列标准化的操作,包括样品前处理、商品化的固相pH胶条(IPG胶条)进行IEF分离、两步平衡、SDS-PAGE分离及染色。其中样品前处理是2-DE能否成功的关键,前处理可实现除杂、脱盐,以避免核酸、多糖及盐离子干扰IEF[1],常用方法有TCA-丙酮沉淀法[2]、苯酚抽提-甲醇沉淀法[3],也可选用样品制备试剂盒,如GE Healthcare的2D Clean-up试剂盒,然而不同生物样本所适用的前处理方法不尽相同,往往需要进行一定探索。凝胶染色是定量分析的前提,可选用考马斯亮蓝染色、银染、荧光染色。其中考马斯亮蓝染色(Neuhoff法)因其与质谱兼容且直观可见而被广泛应用;银染虽然灵敏度更高,能达到1 ng以下,但因与质谱兼容性差而应用较少[4];荧光染色,如SYPRO Ruby(Invitrogen)、Deep Purple(GE Healthcare)染色,灵敏度与银染相当,与质谱兼容性较好[5-6],是较好的制备凝胶染色方法。
1.1.2 2-DE新技术——2D-DIGE
蛋白质组学研究通常关注生物样本在不同条件下的蛋白质表达差异,称为差异蛋白质组学。双向差异凝胶电泳(2D-DIGE,two-dimensional difference gel electrophoresis)是差异蛋白质组学研究的重要技术,它是在2-DE基础上发展而来,以荧光染料(Cy2、Cy3、Cy5三种染料)标记蛋白质样品,在对应波长下扫描可得到三个独立的2-DE图像。
荧光标记是除放射性自显影以外灵敏度最高的蛋白质显影技术,且2D-DIGE能在同一块胶内实现两组不同荧光标记(Cy3或Cy5标记)的样品和一组内标(内标一般是指几种样品等比例混合的样品,用Cy2标记)的分离[7]。引入内标能大大减少系统误差,另外,利用DeCyder 2-D(GE Healthcare)软件进行数据分析也能减少不同凝胶之间的差异,提高差异蛋白质分析的准确性[8]。
尽管2D-DIGE技术灵敏度高,系统误差小,然而荧光染料标记后的蛋白质因与染料结合而使分子量增加,无法用于质谱鉴定,为此蛋白样品必须重新进行凝胶分离,染色后挑取所需蛋白点。因此,利用2D-DIGE进行差异蛋白质组学研究分为2D-DIGE分析和制备型凝胶取点两部分,具体如图2所示。
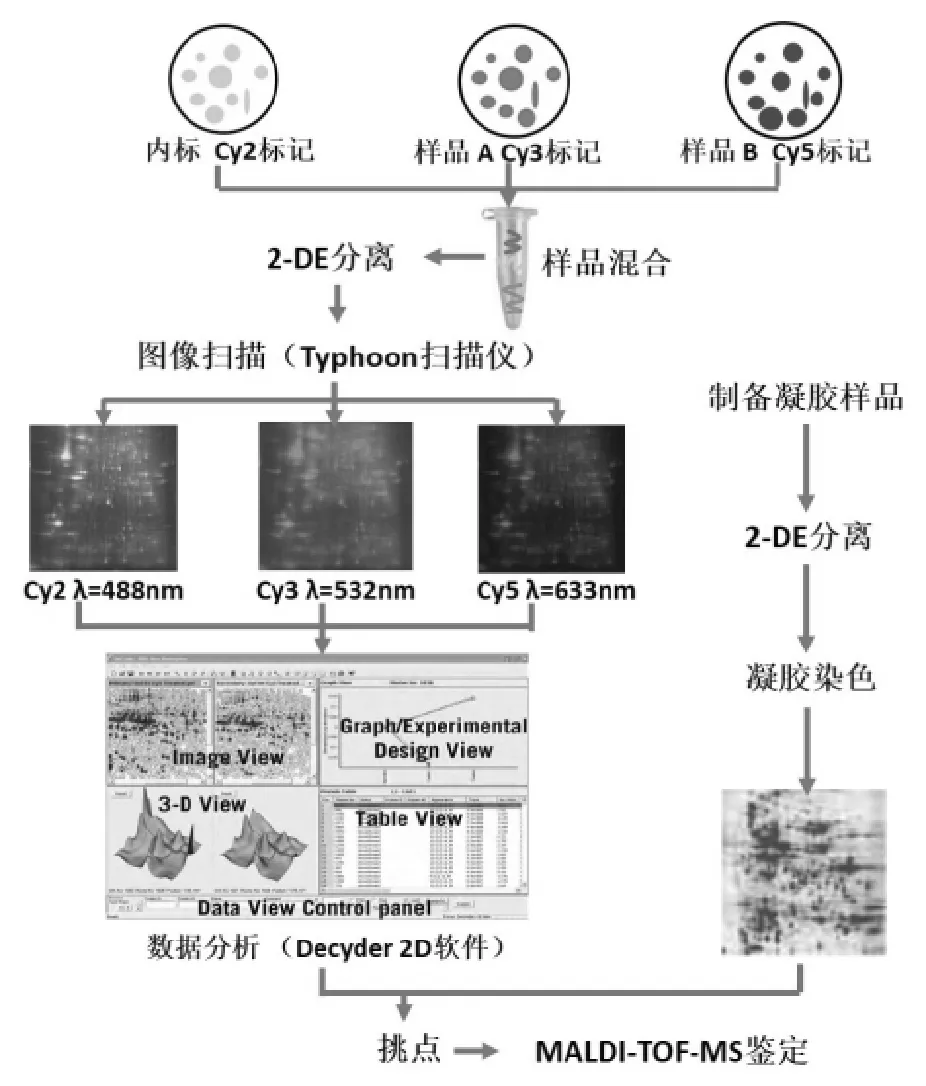
图2 利用2D-DIGE进行差异蛋白质组研究流程
1.2基于多维液相色谱分离的蛋白质组学技术
1.2.1多维液相色谱分离简介
多维液相色谱与质谱结合(LC-MS)能实现生物样品高效、自动化的分离和鉴定。蛋白质样品酶解后直接进行液相色谱分离,包括正相色谱(NP)、反相色谱(RP)、尺寸排阻色谱(SEC)、离子交换色谱(IEX)等,最常用的是RP和IEX。RP与质谱兼容,常作为液相色谱分离的最后一维。多维液相色谱分离有两种形式:一种是将不同分离模式的色谱柱以串联的方式合并在同一根色谱柱里,例如同一根色谱柱前半部分填充阳离子交换色谱填料,后半部分填充反相液相色谱填料,该方法被称为多维蛋白质鉴定技术(multi-dimensional protein identification technology,MudPIT),MudPIT能够对少量样品进行快速分析,已成功应用于蛋白质组学中大规模蛋白质的分离鉴定;另一种则是用接口将不同的色谱柱串联起来,例如Davis等利用3个六通阀将进样、离子交换色谱、预柱、反相色谱和质谱系统连接,能够更灵活地应用于各种蛋白质样品的分离鉴定[9]。
1.2.2 LC-MS系统的定量方法
2-DE系统中通过电泳图谱中蛋白质点的灰度值或荧光强度来进行相对定量,LC-MS系统中则有两类方式进行相对定量,分别称为无标记定量和有标记定量,后者更为常用。有标记定量是指样品经稳定同位素标记后进行质谱鉴定和定量分析。其工作原理是同一肽段在不同标记状态下形成有固定质量差的同位素峰,根据这些同位素峰对肽段进行相对定量。根据标记对象差异,有标记定量又可分为母离子标记和子离子标记。母离子标记主要分为代谢标记、酶促标记和化学标记三种:1)代谢标记,包括基于元素标记的15N和13C标记和基于氨基酸标记的细胞培养稳定同位素标记法(stable isotope labeling by amino acids in cell culture,SILAC)[10],它们都需要将细胞培养于富含稳定同位素或稳定同位素标记的必需氨基酸的培养基中;2)酶促标记[11],是指在酶(通常是胰蛋白酶)的催化作用下于肽段末端引入1个或2个18O原子,使2组样品产生分子量差异;3)化学标记,以同位素亲和标签(isotope-coded affinity tags,ICAT)[12]为代表,试剂包括三部分,其中活性基团与肽段的巯基特异性结合,报告基团包含8个氕(H)或氘(D),形成不同质荷比的两个峰用于相对定量,末端的生物素则用于肽段的亲和纯化。子离子标记是通过化学反应(通常是与游离氨基反应)给肽段添加质量标签,在质谱进行二级碎裂时将质量标签碎裂成不同质量的报告离子,根据不同报告离子的丰度对肽段进行相对定量,常用的标记有相对和绝对定量的同位素标记(isobaric tag for relative and absolute quantitation,iTRAQ)[13],串联质量标签技术(tandem mass tag,TMT)[14],分别能实现4/8重及2/6/10重标记。
2 蛋白质组学技术在工业微生物研究中的应用
微生物应用于食品、化工、医药等领域已有相当悠久的历史。许多微生物的代谢产物都是重要的化学品或药物,包括氨基酸、有机酸等初级代谢产物以及抗生素等次级代谢产物,然而传统的微生物菌种改良以期提高这些代谢产物的产量都是通过大量的随机改造和筛选,工程浩大又耗时。如今,菌种改良多采取基因工程手段,而蛋白质组学、转录组学等方式能对菌种的代谢途径及代谢调控机制进行解析,寻找菌种改良的靶点,为代谢工程改造提供线索。
2.1初级代谢相关蛋白质组学
微生物的初级代谢不仅为菌体生长提供能量和必要的营养物质,而且为次级代谢产物的生成提供前体物质,许多微生物的初级代谢产物,尤其是氨基酸,还是重要的食品、化工、医药原料,对其代谢途径进行解析有利于进一步的菌种改良。
Lu等对Corynebacterium glutamicum ATCC13032野生型和鸟氨酸产量提高20倍的突变株ΔargFΔproBΔkgd进行差异蛋白分析,解析了突变株L-鸟氨酸高产的机制,认为谷氨酸上游代谢途径相关酶系的过表达提高了内源性谷氨酸的利用率从而提高了鸟氨酸的产量,并发现鸟氨酸合成酶系ArgCJBD并不是鸟氨酸合成的限制性酶,因此,Lu等建议基于这些机制继续进行菌种改造以进一步提高L-鸟氨酸产量[15]。Fränzel等通过L-赖氨酸高产突变株C. glutamicum DM1730和低产野生株ATCC 13032的细胞质蛋白质及细胞膜蛋白质的分析,对突变株L-赖氨酸高产的原因进行了解析,认为天冬氨酸激酶LysC的表达上调使代谢流指向赖氨酸合成,葡萄糖-6-磷酸脱氢酶Zwf及磷酸烯醇式丙酮酸羧激酶Pck下调分别阻断了戊糖磷酸途径以及草酰乙酸向磷酸烯醇式丙酮酸的转化,使代谢流指向TCA循环,高丝氨酸脱氢酶Hom下调阻断了赖氨酸合成途径的分支,即苏氨酸的合成[16]。
2.2次级代谢及特殊功能蛋白质组学
微生物产生多种次级代谢产物,这些物质常具有重要的生物活性,如各种抗生素。然而这些活性物质在野生型菌株中产量极低,为了满足医药工业需求,需要对野生型菌株进行改造,因而对代谢机理的解析具有重要意义。王玉霞通过对产抗生素(麦拓莱霉素,AGPM)野生型藤黄灰链霉菌Streptomyces luteogriseus 103和不产抗生素的突变株cnn1进行蛋白质组鉴定,发现突变型聚酮途径相关酶系不完整,推测麦拓莱霉素通过聚酮途径合成,而β-酮酯酰合酶的抑制试验也验证了这一推测[17]。Maréchal等对放线菌紫素(ACT)低产野生型菌株S.lividans TK24和高产突变株ppk的差异蛋白质进行了质谱鉴定,发现突变型脂降解代谢相关酶上调,并且薄层层析(TLC)也表明突变型脂降解代谢旺盛,因此提出脂降解代谢有利于ACT合成[18]。balhimycin是一种类似万古霉素的糖肽类抗生素,Gallo等分别对野生型拟无枝酸菌Amycolatopsis balhimycinachan和不产balhimycin突变型在不同时期和不同条件下的蛋白质组进行比较和分析,发现balhimycin的合成始终与balhimycin合成、碳代谢、细胞能量代谢以及氧化还原平衡相关酶的上调密切相关,这些关键酶的发现为balhimycin的发酵条件改进和菌种改造提供了线索[19-21]。
随着石油资源的大量消耗,利用微生物发酵生产有机溶剂(如丙酮、丁醇等)具有很好的前景,然而目前为止由于单位产量低,该项技术始终没有推向工业化生产。研究者们一直致力于代谢机理的研究以期为发酵菌种改造、提高单位产量提供指导。丙酮丁醇发酵过程分为产酸期和产溶剂期两个阶段,产酸期菌体利用糖类产生乙酸、丁酸等有机酸,而后这些有机酸又重新被利用产生丙酮、丁醇和乙醇,称为总溶剂(ABE)。菌体从产酸期向产溶剂期的转变过程备受关注。研究发现丙酮丁醇梭菌Clostridium acetobutyicum产酸期和产溶剂期的蛋白质表达差异较大,其中产溶剂期表达量较高的乙酰乙酸脱羧酶被认为直接与溶剂产生相关[22-23]。对产溶剂期表达量较高的蛋白质进行进一步研究,发现大多数的蛋白质存在磷酸化现象,认为蛋白质的磷酸化能调节菌体从产酸期到产溶剂期的转变,同时参与有机溶剂的生成[24-25]。
2.3环境应答及代谢调节相关蛋白质组学
微生物的代谢往往受外界环境的改变而作出相应的调节以适应其生长,代谢调节机制的研究能为菌种的代谢工程改造提供基础。GlnR是天蓝色链霉菌S. coelicolor中重要的氮代谢调节因子,已有的研究认为GlnR有13个氮代谢相关的靶标基因。Tiffert等对氮源限制条件下S. coelicolor M145(野生型)和ΔglnR突变型进行细胞质蛋白质组分析,发现差异蛋白涉及到包括氨基酸代谢、核苷酸代谢、碳代谢、蛋白质合成等七大类,认为GlnR不仅参与氮代谢调节,而且在整个微生物代谢中发挥重要作用。同时,该研究还发现了许多新的GlnR的靶标基因,如GlnR能抑制甲硫氨酸、色氨酸等氨基酸的合成,促进乙酰辅酶A的形成[26]。α-酮戊二酸脱氢酶复合体(ODHC)是TCA循环中的关键酶,其酶活调节与氨基酸合成密切相关。研究表明OdhI的翻译后调节对ODHC的调节起重要作用,未磷酸化的OdhI能明显抑制ODHC活性,而C. glutamicum野生型与ΔpknG(丝氨酸/苏氨酸激酶)突变型差异蛋白分析则发现突变型中磷酸化的OdhI明显减少,说明PknG能使OdhI磷酸化对其进行翻译后调节[27]。丙酮丁醇发酵过程中丁醇的积累对产溶剂梭菌造成毒害,严重阻碍了细胞内ABE的继续产生,利用蛋白质组学技术研究丁醇耐受机制有利于进一步进行菌种改良以提高丁醇耐受性从而提高ABE产量。Hou等[28]对产溶剂梭菌C. acetobutyicum ATCC824丁醇胁迫下的蛋白质组进行研究,发现丁醇胁迫条件下几类主要的热激蛋白表达上调,另外拜氏梭菌Clostridium beijerinckii NCIMB8052的研究[29]发现添加Ca2+后能提高热激蛋白GrpE、Dnak等的表达。
2.4转运途径相关蛋白质组学
转运系统是微生物代谢重要的组成部分,细胞外的碳、氮源及前体物质一般需要通过细胞膜上的转运蛋白转运才能进入细胞内部,被菌体所代谢利用,许多发酵产物也需要通过转运蛋白分泌到细胞外。通过蛋白质组学技术对细胞外的分泌蛋白和膜蛋白进行提取、鉴定,能对微生物的转运途径进行系统的研究。许多微生物在不同发酵培养基中生成不同的产物,蛋白质组学研究表明这可能是由于转运蛋白的差异表达造成的,例如Actinoplanes sp. SE50/110在麦芽糖培养下主要产物为阿卡波糖(阿卡维基-麦芽糖),在葡萄糖培养下则为阿卡波糖的结构类似物杂质组分D(阿卡维基-葡萄糖),Wendler等[30]对两组培养条件下的蛋白质组进行分析,发现糖转运途径相关蛋白表达差异导致不同糖化合物作用下菌体趋向于合成含相应糖单位的组分,本课题组在Actinoplanes sp. ZJB-08352种的研究也得出了同样的结论(未发表数据)。
3 展望
蛋白质组学经过了40年的发展,形成了以2DE-MS和LC-MS为主要技术手段的研究方法,基本能满足蛋白质组学研究。然而这两种技术却各有利弊,例如2DE在低丰度蛋白质、疏水蛋白质、大分子量蛋白质研究中的局限,而LC-MS对质谱平台及数据库检索匹配的算法要求很高,且容易出现假阳性的结果。目前为止,蛋白质组学技术仍没有形成基因组学这样自动化、标准化操作的体系,研究者仍然致力于寻找高效、稳定的蛋白质组学新技术。随着微生物应用于工业生产的脚步不断加快,传统的菌种改良手段已无法满足现代工业微生物的发展,通过蛋白质组学技术对工业微生物代谢途径及其调控机制的解析能够为基因工程、代谢工程改造等菌种改良手段提供线索和靶点,而且,蛋白质组学的研究不只局限于直接参与细胞代谢的蛋白,还可以分析代谢调节和转运途径相关的蛋白质,为系统研究微生物的代谢调控提供依据。
参考文献:
[1]GORG A,WEISS W,DUNN M J. Current two-dimensional electrophoresis technology for proteomics[J]. Proteomics,2004,4 (12):3665-85.
[2]MÉCHIN V,DAMERVAL C,ZIVY M. Total protein extraction with TCA-acetone[J]. Methods in molecular biology,2007,355:1-8.
[3]FAUROBERT M,PELPOIR E,CHAÍB J. Phenol extraction of proteins for proteomic studies of recalcitrant plant tissues[J]. Methods in molecular biology,2007,355:9-14.
[4]RICHERT S,LUCHE S,CHEVALLET M,et al. About the mechanism of interference of silver staining with peptide mass spectrometry[J]. Proteomics,2004,4(4):909-916.
[5]NOCK C M,BALL M S,WHITE I R,et al. Mass spectrometric compatibility of Deep Purple and SYPRO Ruby total protein stains for high-throughput proteomics using large-format twodimensional gel electrophoresis[J]. Rapid communications in mass spectrometry,2008,22(6):881-886.
[6]TANNU N S,SANCHEZ-BRAMBILA G,KIRBY P,et al. Effect of staining reagent on peptide mass fingerprinting from in-gel trypsin digestions:A comparison of SyproRubyTMand DeepPurpleTM[J]. Electrophoresis,2006,27(15):3136-3143.
[7]MAROUGA R,DAVID S,HAWKINS E. The development of the DIGE system:2D fluorescence difference gel analysis technology [J]. Analytical and bioanalytical chemistry,2005,382(3):669-678.
[8]GADE D,RTE O,THIERMANN J,et al. Evaluation of two-dimensional difference gel electrophoresis for protein profiling[J]. Journal of molecular microbiology and biotechnology,2003,5(4):240-251.
[9]DAVIS M T,BEIERLE J,BURES E T,et al. Automated LCLC-MS-MS platform using binary ion-exchange and gradient reversed-phase chromatography for improved proteomic analyses [J]. Journal of chromatography B:Biomedical sciences and applications,2001,752(2):281-291.
[10]ONG S E,BLAGOEV B,KRATCHMAROVA I,et al. Stable isotope labeling by amino acids in cell culture,SILAC,as a simple and accurate approach to expression proteomics[J]. Molecular and cellular proteomics,2002,1(5):376-386.
[11]LIU Ze,CAO Jing,HE Yifeng,et al. Tandem 18O stable isotope labeling for quantification of N-glycoproteome[J]. Journal of proteome research,2009,9(1):227-236.
[12]GYGI S P,RIST B,GERBER S A,et al. Quantitative analysis of complex protein mixtures using isotope-coded affinity tags [J]. Nature biotechnology,1999,17(10):994-999.
[13]WIESE S,REIDEGELD K A,MEYER H E,et al. Protein labeling by iTRAQ:a new tool for quantitative mass spectrometry in proteome research[J]. Proteomics,2007,7(3):340-350.
[14]THOMPSON A,SCH?FER J,KUHN K,et al. Tandem mass tags:a novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS[J]. Analytical chemistry,2003,75(8):1895-1904.
[15]LU Dongmei,LIU Jianzhong,MAO Zongwan. Engineering of Corynebacterium glutamicum to enhance L-ornithine production by gene knockout and comparative proteomic analysis[J]. Chinese journal of chemical engineering,2012,20(4):731-739. [16]FRÄNZEL B,POETSCH A,TRÖTSCHEL C,et al. Quantitative proteomic overview on the Corynebacterium glutamicum llysine producing strain DM1730[J]. Journal of proteomics,2010,73(12):2336-2353.
[17]王玉霞.“shotgun”蛋白质组学策略解决若干生物工程问题研究[D].天津:天津大学,2006.
[18]LE MARÉCHAL P,DECOTTIGNIES P,MARCHAND C H,et al. Comparative proteomic analysis of the wild-type and the ppk mutant of Streptomyces lividans revealed the importance of storage lipids for antibiotic biosynthesis[J]. Applied and environmental microbiology,2013,79(19):5907-5917.
[19]GALLO G,ALDUINA R,RENZONE G,et al. Differential proteomic analysis highlights metabolic strategies associated with balhimycin production in Amycolatopsis balhimycina chemostat cultivations[J]. Microbial cell factories,2010,9(1):71-81.
[20]GALLO G,RENZONE G,ALDUINA R,et al. Differential proteomic analysis reveals novel links between primary metabolism and antibiotic production in Amycolatopsis balhimycina[J]. Proteomics,2010,10(7):1336-1358.
[21]GALLO G,ALDUINA R,RENZONE G,et al. From microbial proteomics to synthetic biology:Amycolatopsis balhimycina case[J]. Chemical engineering transaction,2012,27(12):217-222.
[22]SCHAFFER S,ISCI N,ZICKNER B,et al. Changes in protein synthesis and identification of proteins specifically induced during solventogenesis in Clostridium acetobutylicum[J]. Electrophoresis,2002,23(1):110-121.
[23]SIVAGNANAM K,RAGHAVAN V G,SHAH M,et al. Shotgun proteomic monitoring of Clostridium acetobutylicum during stationary phase of butanol fermentation using xylose and comparison with the exponential phase[J]. Journal of industrial microbiology and biotechnology,2012,39(6):949-955.
[24]BAI Xue,JI Zhihong. Phosphoproteomic investigation of a solvent producing bacterium Clostridium acetobutylicum[J]. Applied microbiology and biotechnology,2012,95(1):201-211.
[25]白雪,赵晶晶,王倩,等.丙酮丁醇梭菌磷酸化蛋白质组分析[J].生物工程学报,2010,26(10):1357-1362.
[26]TIFFERT Y,FRANZ-WACHTEL M,FLADERER C,et al. Proteomic analysis of the GlnR-mediated response to nitrogen limitation in Streptomyces coelicolor M145[J]. Applied microbiology and biotechnology,2011,89(4):1149-1159.
[27]BOTT M. Offering surprises:TCA cycle regulation in Corynebacterium glutamicum[J]. Trends in microbiology,2007,15(9):417-425.
[28]HOU S,JONES S W,CHOE L H,et al. Workflow for quantitative proteomic analysis of Clostridium acetobutylicum ATCC 824 using iTRAQ tags[J]. Methods,2013,61(3):269-276.
[29]HAN B,UJOR V,LAI L B,et al. Use of proteomic analysis to elucidate the role of calcium in acetone-butanol-ethanol fermentation by Clostridium beijerinckii NCIMB 8052[J]. Applied and environmental microbiology,2013,79(1):282-293.
[30]WENDLER S,OTTO A,ORTSEIFEN V,et al. Comparative proteome analysis of Actinoplanes sp. SE50/110 grown with maltose or glucose shows minor differences for acarbose biosynthesis proteins but major differences for saccharide transporters[J]. Journal of proteomics,2016,131:140-148.
(责任编辑:朱小惠)
Proteom ic technologies and their app lications in the research of industrial m icrobiology
WANG Yajun1,2,WANG Chaoer1,2,ZHU Jin1,2,LUO Xi1,2
(1. Key Laboratory of Bioorganic Synthesis of Zhejiang Province,Hangzhou 310014,China;
2. College of Biotechnology and Bioengineering,Zhejiang University of Technology,Hangzhou 310014,China)
Abstract:Proteomics,based on two-dimensional electrophoresis and mass spectrum,is becoming the spotlight of life science in the post -genome era. With the fast development of industrial microbiology in food,pharmaceutical and chemical industry,proteomics technologies began to play a vital role in the research of metabolic pathways and its regulation,which provided theoretical foundation for microbial breeding. The principle,advantages and disadvantages of the widely used technologies in proteome research were reviewed,along with their applications in the metabolic engineering research of industrial microorganisms.
Keywords:proteomics;two-dimensional electrophoresis;mass spectrum;microbial breeding
作者简介:王亚军(1975—),男,江苏东台人,教授,博士,研究方向为生物化工,E-mail:wangyj@zjut.edu.cn.通信作者:王亚军教授,E-mail:wangyj@zjut.edu.cn.
基金项目:国家自然科学基金(21476209)
收稿日期:2016-03-16
中图分类号:Q93
文献标志码:A
文章编号:1674-2214(2016)02-0123-06