铁皮石斛3种酸性多糖的分离纯化及体外抗氧化活性
陈松林,吴志刚,姜 武,陶正明
(1.温州医科大学药学院,浙江温州 325035;2.浙江省农业科学院亚热带作物研究所,浙江温州 325005)
铁皮石斛3种酸性多糖的分离纯化及体外抗氧化活性
陈松林1,2,吴志刚1,姜 武2,陶正明1,2
(1.温州医科大学药学院,浙江温州 325035;2.浙江省农业科学院亚热带作物研究所,浙江温州 325005)
摘 要:为研究铁皮石斛酸性多糖的构成及抗氧化活性,采用水提法提取铁皮石斛粗多糖(DOCP),利用阴离子交换剂纤维素柱(DEAE-52)和丙烯葡聚糖凝胶柱(SephacrylS-200)分离纯化,凝胶色谱、液相色谱、紫外光谱及红外光谱测定理化性质。结果表明,分离纯化获得DOAP1-d,DOAP2-c和DOAP3-b 3种铁皮石斛酸性多糖,分子量分别为530,13.8及130.2 ku。其中DOAP1-d和DOAP2-c由葡萄糖、甘露糖、半乳糖和阿拉伯糖构成,而DOAP3-b另包含鼠李糖和半乳糖醛酸两种单糖。红外分析显示,DOAP1-d含有a-呋喃型糖苷,DOAP2-c和DOAP3-b则含有a-吡喃型糖苷。体外活性试验表明,3种酸性多糖在ABTS、清除羟基自由基和DPPH自由基清除方面均比中性多糖表现出更强的活性。
关键词:铁皮石斛;酸性多糖;理化性质;抗氧化活性
文献著录格式:陈松林,吴志刚,姜武,等.铁皮石斛3种酸性多糖的分离纯化及体外抗氧化活性[J].浙江农业科学,2016,57(6): 838-844.
铁皮石斛(Dendrobium officinaleKimuraet Migo.)为兰科石斛属(Dendrobium)多年附生草本植物,具有润肺止咳、滋阴养胃和清热明目以及抗肿瘤之多种功效[1],俗称铁皮兰,黑节草,是中国传统名贵中药材。多年药理学研究表明,多糖为铁皮石斛的主要药效成分,可增强机体免疫力、抗氧化、降血糖、抗肿瘤以及抗白内障等[2]。
在铁皮石斛多糖研究中,有学者分离得到3种多糖(黑节草多糖),测得分子量分别为1 000,500和120 ku,并确定它们为一类O-乙酰葡萄甘露聚糖[3]。此外,也有研究者分离出DT2,DT3单一组分多糖,分子量分别为740和130 ku,主要由单糖Glc,Gal,Xyl,Ara和Man构成,摩尔比分别为5.9∶1.0∶1.0∶0.8∶0.5和7.9∶1.3∶1.0∶0.5∶0.7[4]。Xia等[5]也从铁皮石斛中分离出2个单一组分多糖(DOP-1和DOP-2),对其结构的分析表明,DOP-1 和DOP-2的分子量分别为533.7和159.5 ku,且都含有相同单糖组成(Man,Glc,Gal,Ara)。
然而,上述多糖仅是铁皮石斛多糖的中性组分,对其酸性组分的研究甚少。本研究首次对铁皮石斛的酸性多糖部分进行分离纯化,测定其理化性质,并比较中性多糖和酸性多糖的体外抗氧化活性差异,以期为石斛多糖的药理药效及铁皮石斛药材质量控制提供依据。
1 材料与方法
1.1 试验材料
以2年生铁皮石斛新鲜茎条为材料,于2014 年4月12日采收于浙江省温州市乐清市。
1.2 铁皮石斛预处理及水溶性多糖提取
参考文献[6-7]的方法,将新鲜茎条烘干、磨碎成粉末,先后用60~90℃馏程的石油醚和80%乙醇加热回流脱脂脱色2 h,各重复5次。80℃恒温下,用20倍(体积比)的去离子水浸提2 h,离心,取上清液,重复3次。浓缩上清液,80%乙醇醇沉、离心、溶解,重复3次,收集多糖固体,60℃干燥;Sevag法除蛋白,浓缩,醇沉收集多糖。用分子截留量为3 500 u的半透膜于去离子水中4℃透析48 h,收集多糖溶液,浓缩,醇沉收集多糖,60℃干燥,得多糖粉末。 [8]的方法,利用25 mm×500 mm 的DEAE-Cellulose-52交换剂柱(Whatman公司)分离中性多糖和酸性多糖。称取0.5 g多糖粉末溶于10 mL的去离子水中,利用0,0.05,0.10,0.20,0.30,0.50,1.00 mol·L-1的NaCl溶液梯度洗脱,流速为1 mL·min-1,试管收集洗脱液,2 mL每管,苯酚-硫酸法显色,UV-2550型紫外分光光度计(SHIMADZU公司)在490 nm处监测洗脱液吸光值,绘制洗脱曲线。根据曲线收集酸性组分多糖(NaCl溶液洗脱下的多糖组分),浓缩,透析滤过盐分,醇沉、离心、干燥。 [11]的方法,在10 mL试管中加入5 mL7 mmol·L-1ABTS溶液(Aladdin公司)和88 μL140 mmol·L-1过硫酸钾溶液,摇匀混合,避光静置过夜,在500 mL烧杯中按1∶50的体积比加250 mL蒸馏水制成工作液。 [12]的方法。样品组: 10 mL试管中加入2.5 mL0.004%的DPPH溶液(溶于95%乙醇)与0.5 mL不同浓度(0.2,0.4,0.6,1.0,2.0,3.0,4.0和5.0 mg·mL-1)的多糖溶液,每个处理设3个重复;对照组用95%乙醇代替DPPH溶液;空白组用蒸馏水代替多糖溶液。以上3组置于28℃水浴30 min,离心,取上清液。用0.5 mL蒸馏水和2.5 mL95%的乙醇调零,于515 nm处测定吸光值。按照上述方法,抗坏血酸(VC)作阳性对照。用以下公式计算多糖对DPPH的清除率: [13]的方法。样品组: 10 mL试管中加入1 mL6 mmol·L-1FeSO4、0.4 mL12 mmol·L-1水杨酸、0.2 mL不同浓度的多糖溶液(0.2,0.4,0.6,1.0,2.0,3.0,4.0和5.0 mg·mL-1)、1 mL6 mmol·L-1H2O2和0.4 mL蒸馏水,设3个平行样;空白组用蒸馏水代替多糖溶液,对照组用蒸馏水代替水杨酸;以上3组试管于水浴锅37℃恒温水浴1 h,取出冷却,于510 nm处测定吸光值。按照上述方法,以抗坏血酸(VC)作阳性对照。用以下公式计算多糖对·OH的清除率:
1.3 铁皮石斛酸性多糖的分离、纯化
酸性组分多糖经25 mm×400 mm的Sephacryl S-200柱(Pharmacia公司)纯化。取0.1 g多糖样品溶于5 mL去离子水中,0.1 mol·L-1NaCl溶液洗脱,洗脱流速1 mL·min-1,试管收集洗脱液,2 mL每管,苯酚-硫酸法显色,紫外分光光度计在490 nm处监测洗脱液吸光值,绘制洗脱曲线。根据洗脱曲线收集主峰多糖,反复上样,直至洗脱曲线为单一对称峰,收集该峰多糖,浓缩、醇沉、离心、干燥。
1.4 多糖纯度鉴定与分子量测定
利用比旋光度法和SephadexG-100(15 mm× 600 mm)柱(Pharmacia公司)凝胶层析测定多糖的均一性[9]。称取适量标准多糖(分子量分别为10,40,70,100和500 ku),配制5 mg·mL-1的溶液,于SephadexG-100柱中上样洗脱,上样0.1 mL,去离子水洗脱,流速0.5 mL·min-1。收集洗脱液,每管2 mL,苯酚-硫酸法显色,紫外分光光度计490 nm处监测洗脱液吸光值,待出现最大吸光值时,则该洗脱体积为标准多糖的洗脱体积。以标准多糖分子量的对数值为横坐标,洗脱体积为纵坐标绘制标准曲线,得标准曲线V=-16.408logM +111.921(R2=0.999 3)。按上述条件,测出样品洗脱体积,根据标准曲线计算其分子量。
1.5 多糖的单糖组成分析
参照《中国药典》(2010版)及参考文献[10]的方法。称取10 mg样品多糖置50 mL小烧杯中,加入10 mL去离子水溶解。分别吸取1 mL溶液于3只10 mL具塞试管中,加入3.0 mol·L-1HCl溶液0.5 mL,封口,110℃烘箱中水解1 h,冷却,用3.0 mol·L-1NaOH溶液调中性,吸取400 μL于干净的10 mL具塞试管中,加0.5 mol·L-1的PMP甲醇溶液和0.3 mol·L-1的NaOH溶液各400 μL,混匀,70℃水浴100 min。后加0.3 mol· L-1HCl溶液500 μL,混匀,三氯甲烷洗涤3次,每次2 mL,离心,取上清液,进HPLC,10 μL进样。
色谱条件。Agilent1200系统(Agilent公司),ZORBAXSB-18柱(4.6 mm×250 mm),柱温为25℃,流速为1 mL·min-1,250 nm检测。流动相由乙腈与0.02 mol·L-1乙酸铵溶液以20∶80体积比构成。
1.6 光谱分析
称取多糖样品配成5 mg·mL-1的溶液,以蒸馏水为空白对照,于190~500 nm波长区域扫描。称取10 mg多糖样品,与KBr研磨混合,压成透明薄片,红外光谱仪扫描分析,KBr空白片作参比,扫描范围4 000~400 cm-1。
1.7 ABTS法测定总抗氧化能力
样品组:在10 mL试管中加入200 μL不同浓度(0.2,0.4,0.6,1.0,2.0,3.0,4.0,5.0 mg·mL-1)的多糖溶液和3 mL的ABTS溶液,每个浓度设3个重复;空白组用蒸馏水代替多糖溶液;对照组用蒸馏水代替ABTS溶液;以上3组在室温避光放置1 h,于734 nm处测定其吸光值。按照上述方法,抗坏血酸(VC)作阳性对照。按以下公式计算多糖对ABTS自由基的清除率:
ABTS清除率/%=[A空白-(A样品-A对照)]/A空白×100。
1.8 DPPH自由基清除能力的测定
DPPH清除率/%=[A空白-(A样品-A对照)]/A空白×100。
1.9 羟基自由基(·OH)清除能力的测定
·OH清除率/%=[A空白-(A样品-A对照)]/A空白×100。
2 结果与分析
2.1 酸性多糖的分离纯化
粗多糖经DEAE-Cellulose-52柱分离,共得到7组分的多糖(图1),前4个峰为主峰,收集前4组分多糖。其中去离子水洗脱部分为中性多糖,后3组分为酸性多糖。酸性多糖(DOAP1,DOAP2,DOAP3)在SephacrylS-200柱中上样洗脱纯化,发现3组洗脱图中都存在一个主峰,分别是DOAP1-d,DOAP2-c,DOAP3-b;收集主峰多糖,反复上样洗脱,直至洗脱曲线中有且只有一个单一对称峰(图2);收集,得DOAP1-d,DOAP2-c,DOAP3-b多糖粉末800(白色),432(白色),257 mg(淡黄色),分别占粗多糖的2.7%,1.4%和0.8%。
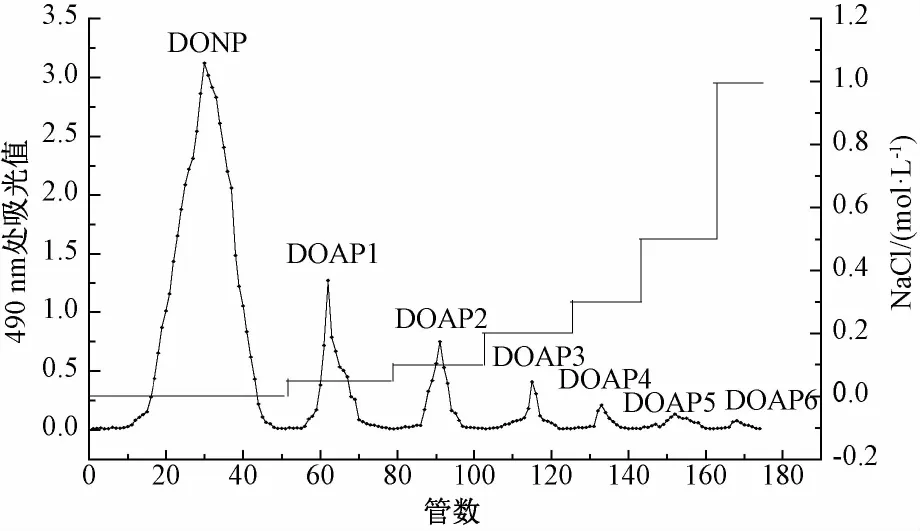
图1 粗多糖在DEAE-纤维素柱上的洗脱曲线
2.2 3种酸性多糖的纯度鉴定与多糖分子量的测定
3种酸性多糖的比旋光度,DOAP1-d为[a]D20=11.2°(C=0.03,H2O),DOAP2-c为[a]D20=90.0°(C=0.03,H2O),DOAP3-d为[a]D20=79.3°(C=0.03,H2O),其中,[a]代表比旋光度,D为D钠光测定,20指20℃测定,C为浓度(g·100mL-1)。SephadexG-100柱上样洗脱显示,3种多糖洗脱曲线均为单一对称峰型,可以认定其为均一组分(图3)。
DOAP1-d,DOAP2-c,DOAP3-b 3种酸性多糖洗脱体积分别为18,44和28 mL,根据标准曲线(V=-16.480logM+111.921)计算其分子量分别为530,13.8和130.2 ku。
2.3 单糖组成分析
DOAP1-d和DOAP2-c共水解得到4种单糖,分别是葡萄糖、甘露糖、半乳糖和阿拉伯糖(图4);DOAP3-b则水解多得到2种单糖,分别是半乳糖醛酸、鼠李糖(表1)。
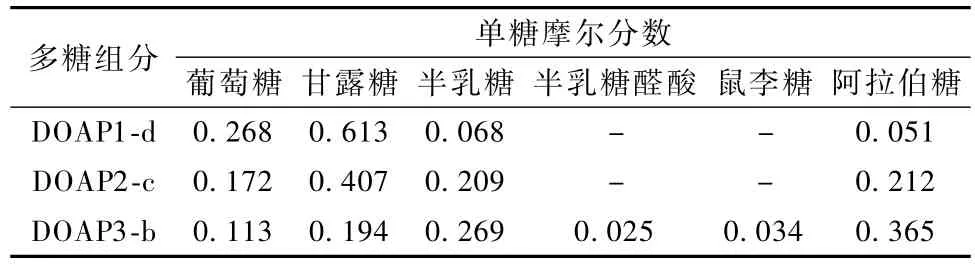
表1 酸性多糖的单糖组成及摩尔分数
2.4 多糖的光谱分析
多糖溶液在波长在190~500 nm进行紫外扫描发现,在240~290 nm均无吸收峰,表明均不存在蛋白质和核酸分子。
红外光谱检测结果如图5所示: 3种多糖的红外光谱较相似。在3 600~3 200 cm-1的峰(DOAP1-d: 3 401.871 cm-1,DOAP2-c: 3 399.943 cm-1,DOAP3-b: 3 399.943 cm-1)是由—O—H的伸缩振动和变角振动引起。2 950~2 800 cm-1的峰(DOAP1-d: 2 925.532 cm-1,DOAP2-c: 2 929.389 cm-1,2 890.819 cm-1,DOAP3-b: 2 929.389和2 890.819 cm-1)是—C—H键伸缩振动引起的特征峰。1 650~1 600 cm-1出现的峰(DOAP1-d: 1 648.866 cm-1,DOAP2-c: 1 641.152 cm-1,DOAP3-b: 1 641.152 cm-1)是羰基的伸缩振动峰。另外,在1 735 cm-1附近的峰(DOAP1-d: 1 733.720 cm-1,DOAP2-c: 1 733.720 cm-1,DOAP3-b: 1 733.720 cm-1)和1 248 cm-1附近的峰(DOAP1-d: 1 249.667 cm-1,DOAP2-c: 1 249.667 cm-1,DOAP3-b: 1 253.524 cm-1)分别是糖醛酸基团和磷酸基团的特征吸收峰,表明这3种多糖为酸性多糖[14]。而1 200~1 000 cm-1所产生的峰是由糖环的C-O-C伸缩振动所引起,DOAP1-d出现了2个强吸收峰(1 066.460和1 031.747 cm-1),表明DOAP1-d多糖存在呋喃糖苷,DOAP2-c产生了3个峰(1 149.385,1 062.603 和1 029.818 cm-1),DOAP3-b也出现3个吸收峰(1 151.384,1 087.673和1 027.890 cm-1)说明DOAP2-c和DOAP3-b存在吡喃糖环[15]。

图2 酸性多糖在SephacrylS-200色谱柱上的洗脱曲线

图3 酸性多糖在SephadexG-100色谱柱上的洗脱曲线
在870 cm-1附近出现的吸收峰(DOAP1-d: 877.466 cm-1,DOAP2-c: 879.395 cm-1,DOAP3-b: 879.395 cm-1)表明这3种多糖具有a-型糖苷键[16];同时,在810 cm-1(DOAP1-d: 808.040 cm-1,DOAP2-c: 809.969 cm-1,DOAP3-b: 809.969 cm-1)附近出现的吸收峰表明,糖基中存在甘露糖,而在890 cm-1处无吸收峰也表明这3种多糖不存在β构型的糖基键结构[17],与上述结果吻合。
2.5 3种酸性多糖体外抗氧化活性
ABTS法测定结果如图6中A所示。3种酸性多糖与中性多糖的总抗氧化能力随着多糖浓度增加明显增强,当增加到一定程度,其增强程度慢慢减弱。比较发现,3种酸性多糖的总抗氧化能力非常接近,均高于中性多糖,略低于VC,以DOAP2-c活性最强。在浓度为5 mg·mL-1时,各组分多糖清除率由高到低分别是99.0%,82.6%,76.3%,70.8%和32.6%。
DPPH自由基清除能力结果如图6中B所示。各组分多糖的清除率同样随着多糖浓度的增加而增强,且增强程度逐渐减弱。中性多糖的清除率依旧最低。在浓度为5 mg·mL-1时,清除率由高到低分别是98.1%,77.1%,67.6%,53.7%和45.8%。
羟基自由基(·OH)清除能力结果如图6中C所示。活性最强为VC,最弱的为中性多糖,DOAP2-c活性最强。值得注意的是,低浓度(0.2和0.4 mg· mL-1)时,DOAP1-d的清除率甚至高于VC,达到了55.9%和61.0%。在浓度为5 mg·mL-1时,DOAP2-c的清除率为97.3%,与VC的99.0%接近。
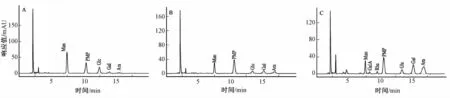
图4 酸性多糖水解衍生物的HPLC色谱

图5 酸性多糖的红外光谱
3 讨论
本试验通过阴离子交换剂纤维素柱和丙烯葡聚糖凝胶柱分离纯化得到铁皮石斛3种主要酸性多糖DOAP1-d,DOAP2-c和DOAP3-b。通过凝胶色谱、液相色谱、紫外光谱和红外光谱分析发现,这3种酸性多糖的分子量大小、单糖构成、比旋光度均不同于以往所分离的石斛多糖。
ABTS总抗氧化、清除DPPH自由基、清除羟基自由基等试验发现,3种酸性多糖抗氧化活性大大强于中性多糖,在高浓度时,其活性甚至接近于VC活性。大量研究显示,多糖的生物活性与其组成结构存在紧密联系,其中包括分子量、单糖组成、官能团以及构型。本试验中,中性多糖与酸性多糖的巨大活性差异可能与酸性多糖所特有的糖醛酸与磷酸基团有关。对比3种酸性多糖的活性与分子量的关系发现,分子量最低的DOAP2-c在ABTS总抗氧化活性试验和清除羟基自由基试验中活性最强,分子量介于DOAP1-d和DOAP2-c之间的DOAP3-b的DPPH清除自由基活性最强,表明抗氧化活性与分子量存在密切关系,且分子量越小活性相对越强。另外DOAP1-d具有的呋喃糖环、DOAP2-c和DOAP3-b具有的吡喃糖环也可能是影响多糖活性的因素。
目前,多糖含量和甘露糖与葡萄糖的比值是评价铁皮石斛品质的重要指标,虽然该指标测定方便快捷,但是根据上述结果分析,酸性多糖相比中性多糖具更强的活性,是铁皮石斛抗氧化的主要物质基础。因此,我们认为可以考虑将酸性多糖的含量作为一个评价指标。本研究分离纯化得到的3种酸性多糖的理化性质与体外抗氧化活性的相互关系,将为铁皮石斛多糖药理药效研究和药材质量控制提供一定依据。

图6 不同组分多糖的总抗氧化能力(A)、对DPPH自由基的清除能力(B)和对羟基自由基(·OH)的清除能力(C)
[1] 聂少平,蔡海兰.铁皮石斛活性成分及其功能进展[J].食品科学,2012,33(23): 356-361.
[2] 吕圭源,颜美秋,陈素红.铁皮石斛功效相关药理作用研究进展[J].中国中药杂志,2013,38(4): 489-493.
[3] 王世林,郑光植,何静波,等.黑节草多糖的研究[J].云南植物研究,1988,10(4): 389-395.
[4] 杨虹,王顺春,王峥涛,等.铁皮石斛多糖研究[J].中国药学杂志,2004,39(4): 254-256.
[5] XIALJ,LIUXF,GUOH Y,etal.Partialcharacterization and immunomodulatoryactivityofpolysaccharidesfromthestem ofDendrobiumofficinale(Tiepishihu)in vitro[J].Journalof FunctionalFoods,2012,4(1): 294-301.
[6] SEVAG M G.A new physicalde-proteination method for representation ofbiologicallyeffectivesubstances-isolation of carbohydrates in chicken-protein and pneumococci[J].BiochemischeZeitschrift,1934,273: 419-429.
[7] 陈晓梅,王春兰,王爱荣,等.铁皮石斛原球茎多糖的研究[J].中国药学杂志,2011,46(20): 1552-1556.
[8] WANGJH,LUO JP,ZHA X Q,etal.Comparison of antitumoractivitiesofdifferentpolysaccharidefractionsfromthe stemsofDendrobiumnobileLindl[J].CarbohydratePolymers,2010,79(1): 114-118.
[9] 封聚强,赵骏.中药多糖的分子量及结构研究进展[J].时珍国医国药,2008,19(3): 624-625.
[10] 杨兴斌,赵燕,周四元,等.柱前衍生化高效液相色谱法分析当归多糖的单糖组成[J].分析化学,2005,33(9): 1287-1290.
[11] ROBERTR,NICOLLET P,ANNA P,etal.Antioxidant activityapplyingan improved ABTS radicalcation decolorization assay[J].FreeRadicalBiologyand Medicine,1999,26 (10): 1231-1237.
[12] WANGX M,SUN R G,ZHANG J,etal.Structureand antioxidantactivity ofpolysaccharide POJ-U1a extracted by ultrasound fromOphiopogin japonicas[J].Fitoterapia,2012,83(8): 1576-1584.
[13] WANGJ,ZHANG Q B,ZHANG Z S,etal.Antioxidant activity ofsulfated polysaccharide fractions extracted from Laminaria japonica[J].InternationalJournalofBiological Macromolecules,2008,42(2): 127-132.
[14] LIUYH,WANGFS.Structuralcharacterization ofan activepolysaccharidefrom Phellinusribis[J].CarbohydratePolymers,2007,70(4): 386-392.
[15] ZHAOGH,KANJQ,LIZX,etal.Structuralfeaturesand immunologicalactivity ofa polysaccharide from Dioscorea opposita Thunb roots[J].CarbohydratePolymers,2005,61 (2): 125-131.
[16] BARKERS A,BOURNEEJ,STACEY M,etal.Infra-red spectraofcarbohydrates.PartI.Some derivatives ofD-glucopyranose[J].JournaloftheChemicalSociety,1954,1: 171-176.
[17] COIMBRAM A,GONCLYES F,BARROS AS,etal.Fourier transform infrared spectroscopyand chemometricanalysisof whitewinepolysaccharideextracts[J].JournalofAgricultural &Food Chemistry,2002,50(12): 3405-3411.
(责任编辑:侯春晓)
中图分类号:S567.239
文献标志码:A
文章编号:0528-9017(2016)06-0838-06
DOI:10.16178/j.issn.0528-9017.20160613
收稿日期:2015-03-17
基金项目:浙江省农业科学院地方科技合作项目(WZ20130006);浙江省温州市科技计划项目(N20100016)
作者简介:陈松林(1991—),男,硕士研究生,研究方向为天然化合物分离及纯化,E-mail: 694452053@qq.com。
通信作者:陶正明(1970—),男,副研究员,从事中药栽培技术、品种选育与药材质量研究,E-mail: 312633768@qq.com。

