聚离子液体及其在天然产物分离中的应用
鲁洋洋,王文俊,李伯耿(浙江大学化学工程联合国家重点实验室,浙江 杭州 310027)
聚离子液体及其在天然产物分离中的应用
鲁洋洋,王文俊,李伯耿
(浙江大学化学工程联合国家重点实验室,浙江 杭州 310027)
摘要:天然产物资源丰富,其高效利用离不开先进的分离技术。兼具离子液体高选择性及聚合物安全、易回收等特性的聚离子液体为天然产物的分离提供了新途径。在介绍聚阳离子型、聚阴离子型和聚两性型离子液体制备技术的基础上,综述了使用聚离子液体的固相萃取、固相微萃取、分子印迹固相萃取、液液萃取及毛细管电泳技术在黄酮类、生物碱类、酚类、蛋白质类等天然产物分离中的研究进展,分析了聚离子液体分离作用机理及其具有良好的分离效率、稳定性和回收再利用性能的原因,特别强调了刺激响应聚离子液体在天然产物分离中的优势,并从聚离子液体设计和定制出发对聚离子液体在分离领域所存在的挑战和潜在的应用进行了展望。
关键词:聚离子液体;天然产物;分离;萃取;刺激响应萃取剂;回收
2015-08-04收到初稿,2015-11-28收到修改稿。
联系人:王文俊。第一作者:鲁洋洋(1990—),男,博士研究生。
Received date: 2015-08-04.
引 言
天然产物是指自然界生物体中具有生物或药理活性的有效成分或代谢产物,根据结构可分为生物碱类、萜类与挥发油类、黄酮类、醌类、苯丙素类、甾体及其苷类、糖类及其苷类等[1],这些化合物的相对分子质量通常为几百到几千,可溶于有机溶剂且有一定极性。许多天然产物具有预防疾病、提高机体免疫力的功效,在医药、保健品、食品等领域得到广泛应用。据有关报道[2],1983~1994年美国食品添加剂中天然产物所占的比例由36%增至54%,获批的520种新药中39%是天然产物或其衍生物。
随着人们对天然产物需求的不断增加,其分离技术也引起人们越来越多的关注,但存在以下困难:①生物体体系复杂,通常包括大分子、小分子、生命物质和非生命物质,特定天然产物常与其同系物共存,结构与性质相似性大大增加了同系物分离的难度;②天然产物在生物体中通常含量低,难富集;③对分离条件如温度、pH、氧气、水分等敏感,增大了分离工艺难度[3]。
常规的天然产物分离方法有溶剂法、蒸馏法、升华法、压榨法、吸附法、盐析法、沉淀法、分馏法、透析法等,存在成本高、效率低、对环境不友好等缺点。随着天然产物工业的不断发展,传统的单一分离技术已不能满足要求,结合化工领域新材料与新工艺的开发,衍生出了超临界、离子液体(IL)、超声波、微波、酶、仿生、固相微萃取等新分离技术,其中,IL因其独特的化学物理性质而备受关注。
离子液体(IL)是指100℃下全部由离子组成的一类液体,它具有蒸气压几乎为零、极性大、不可燃、热稳定、化学稳定等优点。由于IL由阴阳离子组成,因此化学修饰阴阳离子可赋予IL不同的物理化学性质。1998年,Rogers等[4]首先报道了用IL萃取方法从水中分离苯类衍生物。IL萃取方法已被广泛用于石化有机化合物[5-7]、污水中金属离子[8-10]、稀土元素[11-12]等分离。在天然产物研究[13-15]中发现IL可溶解许多常规溶剂无法溶解的天然产物,显示了IL对天然产物分离的特殊能力。IL与分离技术相结合可从生物体中分离天然产物[16-17],如利用微波辅助萃取技术提取番石榴和菝葜中的多酚类物质[18]、结合液相色谱法用于柑橘中章鱼胺的分离[19]、利用固相萃取法从麸皮中分离多糖[20]、结合液液萃取技术从生育酚同系物中分离α-生育酚[21]以及从生物体液中提取蛋白质[22]、利用毛细管电色谱法提取雪莲中的香豆素和山奈酚[23]、结合高速逆流色谱分离知母中的芒果苷和新芒果苷[24]等。虽然IL提升了天然产物的分离技术,但IL价格较传统溶剂高,较高的黏度不利于回收;较难将萃取相中IL与所获产物进行分离,需用有机溶剂[21]或超临界CO2[25]进行反萃;负载的IL在操作过程易发生流失,每次萃取后都需重新负载;同时,IL还存在一定的生物毒性[26-27]。
解决IL所存在问题的一种有效途径是将其制备成聚离子液体(PIL),使得IL特性被保留的同时,减少IL本身不易回收、不易固载及毒性的问题。2008年Anderson课题组[28]将聚乙烯基咪唑双[(三氟甲基)磺酰基]酰亚胺盐PIL负载在纤维上,用于固相微萃取,成功地从酒类中分离脂肪酸甲酯和酯类物质。该工作开创性地将PIL应用于天然产物分离,并在固相微萃取技术中展现了PIL的良好的化学和热稳定性、稳定的分离效率及较长的使用寿命等优点。其后,研究人员将PIL作为分离介质,与萃取、毛细管电泳等技术相结合,用于黄酮类、生物碱类、酚类、蛋白质类等天然产物的分离。
本文从介绍聚离子液体(PIL)制备出发,评述使用PIL的萃取和毛细管电泳分离天然产物的技术,分析了该技术存在的挑战,并展望了其应用前景。
1 聚离子液体的分类
聚离子液体(PIL)根据聚合基团可以分为乙烯基类、苯乙烯类、甲基丙烯酸类、甲基丙烯酰胺类和乙烯基醚类。根据PIL上所带离子基团的不同,又可分为聚阳离子型、聚阴离子型和聚两性型离子液体[29],结构如图1所示。聚阳离子型离子液体主要有:咪唑类、季铵类、吡啶类、吡咯烷类、胍盐类、哌啶类;聚阴离子型离子液体主要包括:磺酸类、碳酸类、磷酸类和氨基类;而聚两性型离子液体则很少,有带咪唑阳离子、氨基或磺酸根阴离子的两性PIL。此外,根据离子基团在聚合物链中所处的位置,又可分为侧链型和主链型。侧链型PIL的离子基团位于聚合物侧链,是最常见的类型;而主链型则特指咪唑环或吡啶环通过缩聚而成的PIL,其离子基团位于聚合物主链[30]。
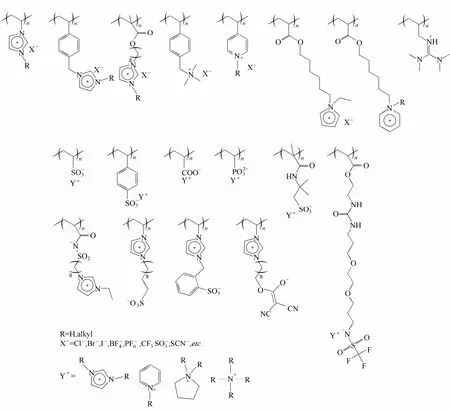
图1 常见的聚离子液体[29]Fig.1 Typical structures of poly(ionic liquid)s[29]
2 聚离子液体的制备
聚离子液体PIL的制备可分为直接法和间接法两种,合成路径如图2所示。直接法中先合成带有可聚合基团的IL单体,再进行聚合反应。该法确保了所得到的PIL每个单元都含有离子基团;但由于IL分子之间的相互排斥作用,影响了单体的聚合速率,使合成的聚合物相对分子质量偏低。间接法则是先合成聚合物前体,再经化学修饰将离子基团引入聚合物前体中,该法聚合反应速率较快、聚合物相对分子质量较高,但存在后修饰过程中因静电排斥的影响无法实现聚合物链上所有单体单元的完全离子交换、引入离子基团的问题。
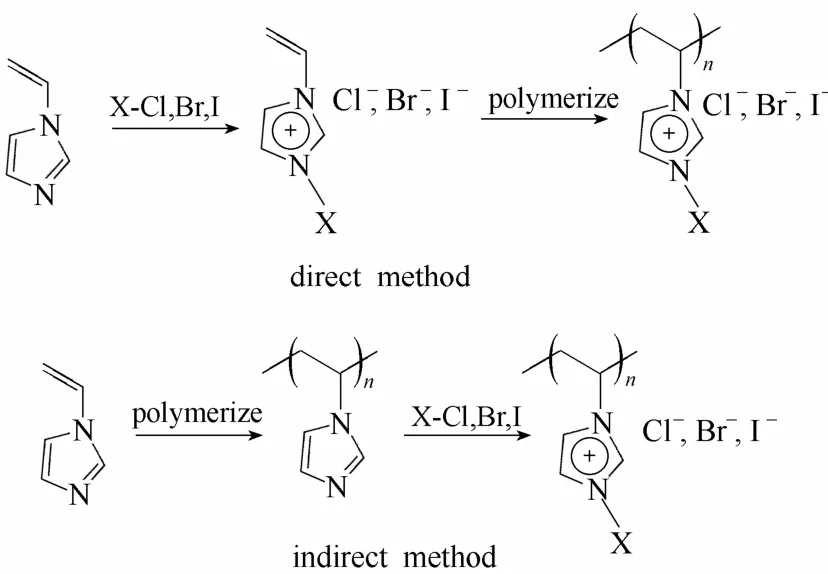
图2 聚离子液体制备方法[29]Fig.2 Synthetic routes for poly(ionic liquid)s[29]
2.1聚阳离子型离子液体的合成
聚阳离子型离子液体是种类最多、研究最广的一类PIL,主要有季铵类、咪唑类、吡啶类及吡咯类。
Mecerreyes课题组[31]通过传统自由基聚合直接制备了咪唑类聚合物,再利用阴离子交换得到阴离子分别为的PIL,发现阴离子对PIL在不同溶剂中的溶解性起到关键作用。该课题组进一步研究了不同阴离子对吡啶类PIL热稳定性的影响[32],发现PIL热稳定性规律为:C
Tang等[33]使用间接法,首先用可逆加成-断裂链转移聚合合成一系列窄分布的聚对氯甲基苯乙烯,将其与1-丁基咪唑进行质子化反应得到PIL,质子化程度近乎完全,再经离子交换得到阴离子为的PIL。该PIL的CO2吸附容量、吸附/解附速率均明显优于相应的IL[34-36]。
Sato等[37]通过本体聚合直接制备了重均分子量达百万的季铵类PIL,用该PIL与锂盐复合的电池,其放电和电池循环性能皆优于常规的锂电池。
2.2聚阴离子型离子液体的合成
聚阴离子型离子液体种类相对较少,目前报道的有含磺酸根、磷酸根和碳酸根类PIL。Ohno课题组[38]分别用乙烯基磺酸、乙烯基羧酸、乙烯基磷酸及对苯乙烯基磺酸与1-甲基咪唑反应制备阴离子型IL单体,再通过传统自由基聚合合成阴离子型PIL;研究表明该阴离子型PIL有高达10−4S·cm−1的电导率,这是因为其阳离子咪唑能发生较有效的运动所致。Vidal等[39]合成了带三氟甲磺酰胺基的聚阴离子型离子液体,其电导率为6.5×10−4S·cm−1,与相应的IL单体相近。
Ricks-Laskoski等[40]将2-丙烯酰胺-2-甲基-1-丙磺酸与三[2-(2-甲氧乙氧基)乙基]胺反应得到IL,再进行传统自由基聚合,获得含磺酸基的液态聚阴离子型离子液体,并通过在阳离子基团中引入氧乙烯基,有效提高了材料的液流性,可通过调整电压改变PIL液滴的润湿性,从而改变液滴与疏水材料的接触角和形状,拓展了PIL在变焦透镜领域的应用。
2.3聚两性型离子液体
1991年Pujol-Fortin等[41]通过叔氮化合物与乙烯酮或丙烯酮的亲核反应合成了两性型单体,再经传统自由基聚合制备聚两性型离子液体。由于该类PIL的阴阳离子同时存在于聚合物链中,影响其导电性。
3 聚离子液体在天然产物分离中的应用
聚离子液体(PIL)一方面继承了IL的强极性、易与目标天然产物形成氢键、静电、疏水基团亲和、阴离子交换作用等特点,另一方面克服了IL在分离过程中易损耗、存在生物毒性的问题,因此是一种极具潜力的新型分离材料。下面,将通过与不同分离技术的结合,综述PIL在天然产物分离中的研究进展。
3.1固相萃取技术
固相萃取技术是结合了液固萃取和液相色谱技术发展而来,利用固相分离介质对分离物的吸附作用强于液相溶剂的特点,将分离物浓缩在固相分离介质表面从而达到分离,其中分离介质的选择对固相分离效率至关重要。以PIL为分离介质,其大分子结构克服了IL作为分离介质时所存在的水溶解性而造成流失的问题,其良好的化学稳定性可延长其作为分离介质的使用寿命。使用该技术可用于黄酮类和生物碱类化合物及蛋白质的分离[42-45]。
黄酮类天然产物是植物中具有杀菌、抗氧化、抗炎症等功效的一类重要的次生代谢产物[46],可通过蔬菜、红酒、茶或者某些中药材摄入该类化合物[47]。用于黄酮类天然产物分离的PIL主要是咪唑类阳离子型聚合物,由于黄酮类化合物存在芳香环和酚羟基,PIL中咪唑环能与芳香环形成π-π作用,同时咪唑环上氮原子还能与酚羟基形成氢键作用,从而实现分离。Row课题组[42]在二氧化硅表面聚合得到负载乙烯基咪唑型PIL吸附剂,二氧化硅上PIL负载量达17.3%(质量分数);将其与IL水溶液混合作为萃取剂,通过三相萃取(吸附剂+溶剂+原料),从日本扁柏中提取了杨梅酮和阿曼陀黄素,后经甲醇脱附,两者的分离效率分别为76.4%和90.3%,阿曼陀黄素较高的分离效率是因其结构中相较杨梅酮多了两个芳香环和一个酚羟基;与传统分离介质甲醇相比,PIL分离产物中杂质明显减少,表明PIL较甲醇对黄酮类化合物有更好的选择性;研究还发现随着PIL中咪唑环上烷基链数增加,分离效率先增后减,8个碳烷基链的分离效率最高,这是由于IL咪唑阳离子的疏水性随着烷基链而增强,从而增进PIL与黄酮类化合物的疏水亲和相互作用;但当烷基链大于8个碳,分离体系黏度增加明显,从而降低了分离效率。
除了黄酮类天然产物,PIL还被用于从植物中分离生物碱,常用的也是咪唑类阳离子型聚合物。PIL与生物碱化合物间存在以下几种相互作用:生物碱中芳香环与咪唑基的π-π作用、生物碱中含孤对电子的氧或者氮原子与咪唑基中氮原子的氢键作用以及生物碱的亲油部分与咪唑基中烷基链的疏水亲和作用[48]。Row课题组[43]通过间接法合成了苯乙烯基咪唑侧链带烷基氨基的负载型PIL,将此吸附剂用于分离苦参中具有良好抗病毒、抗病原体作用的苦参碱和氧化苦参碱,两者萃取率分别为2.32和13.69 mg·g−1。与商品化的C18柱及氨基吸附剂相比,该PIL具有最佳的分离选择性,重复使用3次未改变其分离效率。该吸附剂还被用于分离和测定鸡蛋和牛奶中的生物碱含量。
同一课题组[44]还将相同技术用于绿茶提取咖啡因与茶碱。他们利用间接法由甲基丙烯酸缩水甘油酯和二甲基丙烯酸乙二醇酯共聚先制备聚合物微球,再与1-甲基咪唑反应引入离子基团。由于咖啡因与茶碱结构上唯一的区别是咖啡因化合物的氮原子上存在一个甲基[49],其削弱了咖啡因与PIL的氢键作用,从而能使用PIL对两者进行选择性分离。用该PIL粒子从绿茶中分离咖啡因和茶碱,萃取率分别为0.025和0.58 mg·ml−1。
PIL作为固相萃取的吸附剂,还被应用于生物大分子如蛋白质的分离。研究表明,碳纳米管负载IL对复合糖、多肽、蛋白质等生物大分子具有选择性吸附能力[50-52]。使用PIL,能在原有IL与蛋白质之间的作用基础上,提供更强的疏水结构亲和相互作用。Wang等[45]通过直接合成法进行1-乙烯基-3-丁基咪唑氯盐、丙烯酰胺与N,N'-亚甲基双丙烯酰胺的共聚,得到交联型大孔PIL,该PIL对溶菌酶有很强的吸附能力,吸附容量可达755.1 mg·g−1。PIL中阴离子种类对蛋白质吸附影响很大,当阴离子为氯离子时,PIL对牛血红蛋白的吸附容量为13.7 mg·g−1;而当使用十二烷基磺酸为阴离子时,其吸附容量提高了近32倍,达447.7 mg·g−1,这可能是因为十二烷基磺酸阴离子削弱了IL分子间氢键相互作用,从而增强了蛋白质与IL的作用[53]。
3.2固相微萃取技术
固相微萃取是通过在石英纤维表面涂敷分离介质实现对目标产物的萃取,包括直接萃取、顶空萃取、膜保护萃取等3种模式。与固相萃取相比,该技术具有操作简单、成本低等优势。使用IL作为分离介质,存在流失问题,会污染目标产物,并增加操作成本;而PIL则能较稳定地附着在纤维表面,更适合于用作固相微萃取的分离介质[54]。
Anderson课题组[28]首先将PIL用于天然物质的固相微萃取分离,通过乙烯基咪唑分别与1-氯己烷、1-溴十二烷及1-溴十六烷反应合成不同烷基链长的IL单体,经自由基聚合,所得产物进行离子交换,得到了阴离子为二(氟甲基磺酰)酰亚胺盐的PIL,将负载该PIL的石英纤维用于分离红酒和白酒中的脂肪酸甲酯化合物,经超过150次的循环萃取,分离效率仅下降了14%~18%,稳定性明显优于商业化的聚二甲基硅氧化负载纤维。该课题组又分别通过1-乙烯基-3-己基咪唑氯盐与1,12-二(3-乙烯基咪唑)十二烷溴盐的紫外光和热聚合合成交联PIL,负载该PIL的纤维用于顶空固相微萃取与气相色谱联用萃取分析奶酪中2种游离脂肪酸、2种醛、2种酮和10种酚类化合物[55],通过PIL与这些化合物的π-π作用和疏水亲和相互作用实现选择性分离。该PIL对丁香油酚和2,6-二甲氧基苯酚的分配系数分别为91和18,分离效率优于目前市场上分离效果最好的CAR-PDMS纤维。与之相似,Zhang 等[56]在纤维上直接聚合负载PIL,利用直接浸没固相微萃取和气相色谱联用分离分析了蔬菜中拟除虫菊酯的含量,可检测出黄瓜和卷心菜中低至0.49和0.21 μg·kg−1的拟除虫菊酯残留,亦可用于水中拟除虫菊酯的分离检测,该PIL负载纤维的萃取能力比商业化的聚二甲基硅氧烷纤维高出20%。
Jiang等[57]合成了一种特殊的双受限PIL,首先通过1-乙烯基-3-辛基咪唑溴盐和4-乙烯基苯磺酸钠反应合成了阴阳离子都带有聚合基团的IL,后经自由基聚合合成PIL,再将PIL通过化学修饰负载于不锈钢丝上。研究发现该阴阳离子同时受限在聚合物骨架上的PIL对高浓度盐的耐受能力极强,稳定性远高于常规聚阳离子型离子液体,克服了离子液体作为萃取介质在酸性条件下不稳定、易分解的问题。该PIL用于直接浸没和顶空固相微萃取分析市售矿泉水中邻苯二甲酸酯等杂质含量,可有效萃取低浓度杂质并保持很好的分离稳定性。
3.3分子印迹固相萃取技术
分子印迹技术是通过分子印迹聚合物对特定目标化合物及与其结构相似化合物进行特异性识别和选择性吸附[58],将其与固相萃取相结合形成了分子印迹固相萃取技术。由于PIL较常规分子印迹聚合物更易与目标产物形成π-π作用、疏水基团亲和作用以及氢键和静电相互作用,因此其对天然产物有更强的分离能力。Tian等[59]利用间接合成法经乳液聚合合成了具有较大比表面积的多孔聚苯乙烯微球,再以9,10-菲醌(结构与丹参总酮类似)为模板剂,通过多孔聚苯乙烯微球与几种不同的咪唑化合物反应得到分子印迹PIL。与无IL的分子印迹聚苯乙烯微球和市售C18柱相比,分子印迹PIL的吸附容量高2~3个数量级,每克丹参中可提取出高达0.35 mg隐丹参酮、0.33 mg 丹参酮I和0.27 mg 丹参酮IIA;当咪唑的烷基链上引入羧酸根,其吸附能力及选择性最佳,这是由于羧酸根可与丹参总酮的羰基形成氢键作用,同时丹参总酮在酸性条件下更稳定;该分子印迹PIL经5次重复使用,其分离效率仅下降2.76%,表明其重复使用吸附效率非常稳定。该课题组[60]用相似的方法以酚酸为模板剂合成了分子印迹PIL,其粒径约600 nm、比表面积50.7~72.4 m2·g−1、孔径分布5.02~4.56 nm。将其用于海蓬子中的原儿茶酸、阿魏酸和咖啡酸分离,分离效率可分别达到90.1%、95.5%和96.6%,4次循环使用后分离效率仅下降7%。他们还将分子印迹PIL分离日本扁柏中的栎素、杨梅酮和阿曼陀黄素,分离效率分别达88.1%、93.6%和95.1%[61]。
Wang课题组[62]在前期利用PIL吸附分离蛋白质的基础上,在1-乙烯基-4-丁基咪唑氯盐聚合物中引入模板剂溶菌酶和单壁碳纳米管,制备了具有对溶菌酶特异性吸附的负载型分子印迹PIL,分子印迹PIL在单壁碳纳米管上的负载量达97.1%。对负载的分子印迹PIL与无分子印迹PIL进行对比,发现分子印迹PIL对溶菌酶的吸附量提高了54%;该分子印迹PIL可在复杂蛋白质混合体系中选择性吸附溶菌酶,溶菌酶对牛血清蛋白、肌红蛋白、牛血红蛋白和细胞色素c的选择性系数分别为7.17、2.12、1.76和1.57;该负载型分子印迹PIL还可对蛋清中溶菌酶实现选择性分离。
3.4液液萃取技术
液液萃取是天然产物分离的常用手段之一,将其用于天然产物特别是同系物分离的关键是高效萃取剂的选择。具有延缓衰老、治疗和预防疾病功能的维生素E(又称生育酚)是一种有代表性的天然同系物,可从植物油脱臭馏出物中提取,它主要含α-、β-、γ-和δ-生育酚,其中α-生育酚具有很高的生理活性,但分离α-生育酚存在挑战。Ren课题组[21]使用IL与常规溶剂混合作为萃取剂,利用IL卤素阴离子和不同生育酚同系物中酚羟基之间不同的氢键作用,实现了生育酚同系物的分离,但分离中仍离不开使用大量有机溶剂对萃取相中生育酚进行反萃的分离操作,增加了能耗和溶剂消耗。
近些年来,对pH、温度、气体、光等激发条件敏感的刺激响应材料被用作分离材料[63-69],特别是CO2刺激响应材料,因其绿色、价廉、易得且适合大规模操作而备受人们关注。本课题组[63-67]一直致力于CO2刺激响应分离材料的研究,开发了CO2/N2可逆凝聚(分离)与再分散的胶乳和乳液。2014年本课题组首次开发了用于生育酚同系物分离的CO2刺激相应的聚合物萃取剂聚乙烯亚胺(PEI),实现了α-生育酚高效分离;通CO2时PEI上的氨基与CO2相互结合,在脱出生育酚的同时从溶剂中沉淀出PEI,从而实现萃取剂的快速回收和重复利用,同时不需要反萃操作从萃取相中分离生育酚,避免了大量有机溶剂的使用[69]。
本课题组[70]通过可逆加成-断裂链转移聚合合成了1-乙烯基-3-丁基咪唑溴盐IL与N-异丙基丙烯酰胺的PIL,并通过离子交换引入丙氨酸阴离子。将此PIL与乙腈混合作为萃取剂,用于生育酚同系物的分离,发现该聚氨基酸型PIL因其氨基酸阴离子与生育酚酚羟基的氢键作用远强于卤素阴离子而具有出色的分离效率,δ-生育酚和β-/γ-生育酚的两相分配系数分别为7.86和3.63,δ-生育酚和β-/γ-生育酚对α-生育酚的选择性分别达13.0和6.0;由于该PIL在乙腈中存在温度刺激响应,具有UCST,使得PIL可通过改变温度得到快速回收和再利用以及萃取相中生育酚的再分离,避免了使用大量溶剂的反萃操作。
3.5毛细管电泳技术
毛细管电泳是近年来发展迅速的一种分离分析方法,具有效率高、样品消耗量少等优点,被广泛应用于生物分子分离,但由于毛细管的电渗流方向和阴离子化合物的电泳迁移方向相反,因此该技术对阴离子化合物的分离效果不理想,需用背景电解质以改变电渗流。使用PIL作为毛细管电泳背景电解质或毛细管涂膜[71],能比小分子IL产生更强的反转电渗流,从而提高了带电化合物的分离效率。
Jiang课题组[72]合成了乙烯基咪唑类的聚阳离子型离子液体,将其作为毛细管电泳的背景电解质用于4种碱性蛋白质的分离。通常毛细管电泳中石英毛细管内壁上的硅羟基被电离成SiO−而使其表面带负电,当使用一定浓度的背景电解质PIL时,咪唑基团与毛细管壁上离子化硅烷醇形成静电作用,使得毛细管壁面呈正电,不仅产生稳定的反向电渗流促进具有不同等电点的蛋白质分离,而且可以有效削弱壁上碱性蛋白质的吸附;增加背景电解质PIL浓度,毛细管内壁面更强的正电可进一步减少壁面对蛋白质的吸附,提高蛋白质的分离效率;但当PIL质量分数高于0.3%时,高浓度的PIL增大了毛细管径向温差,增强焦耳热效应,从而降低柱效及蛋白质分离效率。该方法还被用于外用药物中水杨酸和苯甲酸的分离分析[73]。
除了将PIL作为毛细管电泳的背景电解质,Jiang课题组[74-75]还将聚1-乙烯基4-丁基咪唑溴盐PIL直接物理负载于石英毛细管上,由于PIL对酸、碱、有机溶剂稳定,从而减少了背景电解质pH对毛细管电渗流的影响,同时还削弱了溶质在石英管壁面吸附,加快了分离速度;将该负载PIL的石英毛细管用于碱性蛋白质和有机酸的分离,成功地从葡萄汁中分离分析出4种阴离子化合物[74]。他们还利用表面引发原子转移自由基聚合,在石英毛线管壁面化学接枝PIL,提高了石英毛线管壁面PIL在用于碱性蛋白质和有机酸的分离过程中的稳定性[75]。
4 总结和展望
近5年来,聚离子液体(PIL)在天然产物分离领域研究发展迅速,初步展示了其在分离过程中的巨大应用潜力。将PIL用作天然产物分离的萃取剂或吸附剂,一方面继承了离子液体IL与天然产物间的π-π、氢键、静电、疏水基团亲和等相互作用,具有分离效率高、选择性好、绿色环保等优点,另一方面提供了IL所不具备的回收容易、热稳定性和化学稳定性好、结构可调等优势。但由于相关研究时间尚短,拓展PIL在天然产物分离领域应用,需要完善以下几个方面。
(1)系统了解和掌握IL与天然产物化合物间相互作用机理,充分利用在PIL制备过程中可引入共聚单体官能团这一优势,发掘共聚官能团与IL协同增强分离效率和选择性的能力,掌握PIL的共聚物链序列结构和拓扑结构对分离效率和选择性的影响规律,指导高效PIL的设计和定制。
(2)与传统溶剂萃取剂相比,PIL制备复杂、成本较高,为了降低其在分离过程的使用成本,需从3方面着手:①设计易回收再利用的PIL,在PIL引入诸如CO2、温度[70]等刺激响应性能,可大大方便回收,降低操作成本;②开发廉价的高性能IL以降低PIL的成本,从便宜的天然原料着手合成新型IL是可行方案之一[76];③从共聚物链结构设计出发,充分发挥PIL中IL单元的使用效率,可减少PIL中IL的用量,从而降低PIL成本。
(3)在液液萃取过程,PIL仍须溶于小分子溶剂用于分离,另外,萃取剂的黏度影响分离操作;由于常规PIL的黏度远高于常规溶剂,因此开发液态PIL(低分子量或特殊拓扑结构)可避免挥发性有机溶剂的使用,同时避免小分子IL易损耗、稳定性差的问题。目前,已有一些报道通过设计尺寸较大和分子不对称性较强的阴阳离子削弱离子间相互作用力,使得所合成的PIL具有较低的玻璃化转变温度。Yuan等[77]通过在季铵型阳离子的烷基链上引入氧原子,从而屏蔽季铵阳离子与阴离子的相互作用,得到液态的PIL,可用于液液两相萃取。现有报道的液态PIL目前仅局限于此一种结构,但该PIL的热稳定性较差,需要开发新型的液态PIL。
References
[1] 徐任生,叶阳,赵维民. 天然产物化学[M]. 2版. 北京:科学出版社,2004:1-2. XU R S, YE Y , ZHAO W M. Natural Products Chemistry [M]. 2nd ed. Beijing: Science Press, 2004: 1-2.
[2] SARKER S D, LATIF Z, GRAY A I. Natural Products Isolation [M]. 2nd ed. New York: Humana Press, 2006: 3-4.
[3] 谭天伟. 天然产物分离新技术[J]. 化工进展,2004,22(7): 665-668 TAN T W. New separation and purification methods for natural herbs [J]. Chem. Eng. Prog., 2003, 22(7): 665-668.
[4] HUDDLESTON J G, WILLAUER H D, SWATLOSKI R P, et al. Room temperature ionic liquids as novel media for ‘clean’liquid-liquid extraction [J]. Chem. Commun., 1998, 16: 1765-1766.
[5] PEREIRO A B, ARAÚJO J M M, ESPERANÇA J M S S, et al. Ionic liquids in separations of azeotropic systems — a review [J]. J. Chem. Thermodyn., 2012, 46: 2-28.
[6] FADEEV A G, MEAGHER M M. Opportunities for ionic liquids in recovery of biofuels [J]. Chem. Commun., 2001: 295-296.
[7] BALTAZAR Q Q, LEININGER S K, ANDERSON J L. Binary ionic liquid mixtures as gas chromatography stationary phases for improving the separation selectivity of alcohols and aromatic compounds [J]. J. Chromatogr. A, 2008, 1128: 119-127.
[8] HOLBREY J D, VISSERA E, SPEAR S K, et al. Mercury(Ⅱ) partitioning from aqueous solutions with a new, hydrophobic ethylene-glycol functionalized bis-imidazolium ionic liquid [J]. Green Chem., 2003, 5: 129-135.
[9] WANG X Q, LIU W X, TIAN J, et al. Cr(Ⅵ), Pb(Ⅱ), Cd(Ⅱ) adsorption properties of nanostructured BiOBr microspheres and their application in a continuous filtering removal device for heavy metal ions [J]. J. Mater. Chem. A, 2014, 2: 2599-2608.
[10] LIU Z, WANG H S, LIU C, et al. Magnetic cellulose-chitosan hydrogels prepared from ionic liquids asreusable adsorbent for removal of heavy metal ions [J]. Chem. Commun., 2012, 48: 7350-7352.
[11] ROUT A, BINNEMANS K. Separation of rare earths from transition metals by liquid-liquid extraction from a molten salt hydrate to an ionic liquid phase [J]. Dalton Trans., 2014, 43: 3186-3195.
[12] GUO L, CHEN J, SHEN L, et al. Highly selective extraction and separation of rare earths (Ⅲ) using bifunctional ionic liquid extractant [J]. ACS Sustain. Chem. & Eng., 2014, 2(8): 1968-1975.
[13] KAHLEN J, MASUCH K, LEONHARD K. Modelling cellulose solubilities in ionic liquids using COSMO-RS [J]. Green Chem., 2010,12(12): 2172-2181.
[14] GUO Z, LUE B M, THOMASEN K, et al. Predictions of flavonoid solubility in ionic liquids by COSMO-RS: experimental verification, structural elucidation, and solvation characterization [J]. Green Chem., 2007, 9(12): 1362-1373.
[15] SMITH K B, BRIDSON R H, LEEKE G A. Solubilities of pharmaceutical compounds in ionic liquids [J]. J. Chem. Eng. Data, 2011, 56(5): 2039-2043.
[16] HAN D, ROW K H. Recent applications of ionic liquids in separation technology [J]. Molecules, 2010, 15: 2405-2425.
[17] BERTHOD A, RUIZ-ANGEL M J, CARDA-BROCH S. Ionic liquids in separation techniques [J]. J. Chromatogr. A, 2008, 1184: 6-18.
[18] DU F Y, XIAO XH, LUO X J, et al. Application of ionic liquids in the microwave-assisted extraction of polyphenolic compounds from medicinal plants [J]. Talanta, 2009, 78: 1177-1184.
[19] TANG F, TAO L, LUO X, et al. Determination of octopamine, synephrine and tyramine in Citrus herbs by ionic liquid improved ‘green’ chromatography [J]. J. Chromatogr. A, 2006, 1125: 182-188.
[20] ABE M, FUKAYA Y, OHNO H. Extraction of polysaccharides from bran with phosphonate or phosphinate-derived ionic liquids under short mixing time and low temperature [J]. Green Chem., 2010, 12: 1274-1280.
[21] YANG Q, XING H, CAO Y, et al. Selective separation of tocopherol homologues by liquid-liquid extraction using ionic liquids [J]. Ind. Eng. Chem. Res., 2009, 48(13): 6417-6422.
[22] DU Z, YU Y L, WANG J H. Extraction of proteins from biological fluids by use of an ionic liquid/aqueous two-phase system [J]. Chem. Eur. J., 2007, 13: 2130-2137.
[23] QI S, TIAN K, ZHANG H, et al. High electric field strengths in micellar electrokinetic capillary electrophoresis with ionic liquids as modifiers [J]. Anal. Lett., 2006, 39: 2039-2053.
[24] XU L, LI A, SUN A, et al. Preparative isolation of neomangiferin and mangiferin from Rhizomaanemarrhenae by high-speed countercurrent chromatography using ionic liquids as a two-phase solvent system modifier [J]. J. Sep. Sci., 2010, 33: 31-36.
[25] BROWN R A, POLLET P, MCKOON E, et al. Asymmetric hydrogenation and catalyst recycling using ionic liquid and supercritical carbon dioxide [J]. J. Am. Chem. Soc., 2001, 123(6): 1254-1255.
[26] GARCIA M T, GATHERGOOD N, SCAMMELLS P. Biodegradable ionic liquids (Ⅱ): Effect of the anion and toxicology [J]. Green Chem., 2005, 1(7): 9-14.
[27] PETKOVIC M, SEDDON K R, REBELO L P N, et al. Ionic liquids: a pathway to environmental acceptability [J]. Chem. Soc. Rev., 2011, 40: 1383-1403.
[28] ZHAO P, MENG Y, ANDERSON J L. Polymeric ionic liquids as selective coatings for the extraction of esters using solid-phase microextraction [J]. J. Chromatogr. A, 2008, 1208(1): 1-9.
[29] MECERREYES D. Polymeric ionic liquids: broadening the properties and applications of polyelectrolytes [J]. Prog. Poly. Sci., 2011, 36: 1629-1648.
[30] LI F, CHENG F, SHI J, et al. Novel quasi solid electrolyte for dye sensitized solar cells [J]. J. Power Sources, 2007, 165: 911-915.
[31] MARCILLA R, BLAZQUEZ J A, RODRIGUEZ J, et al. Tuning the solubility of polymerized ionic liquids by simple anion-exchange reactions [J]. J. Polym. Sci., Part A: Polym. Chem., 2004, 42: 208-212.
[32] MARCILLA R, BLAZQUEZ JA, FERNANDEZ R, et al. Synthesis of novel polycations using the chemistry of ionic liquids [J]. Macromol. Chem. Phys., 2005, 206: 299-304.
[33] DING S, TANG H, RADOSZ M, et al. Atom transfer radical polymerization of IL 2-(1-butylimidazolium-3-yl)ethyl methacrylate tetrafluoroborate [J]. J. Polym. Sci., Part A: Polym. Chem., 2004, 42: 5794-5801.
[34] TANG J B, SUN W L, TANG H D, et al. Enhanced CO2absorption of poly(ionic liquid)s [J]. Macromolecules, 2005, 38: 2037-2039.
[35] TANG J B, TANG H D, SUN W L, et al. Poly(ionic liquid)s: a new material with enhanced and fast CO2absorption [J]. Chem. Commun., 2005: 3325-3327.
[36] TANG J B, TANG H D, SUN W L, et al. Poly(ionic liquid)s as new materials for CO2absorption [J]. J. Polym. Sci., Part A: Polym. Chem., 2005, 43: 5477-5489.
[37] SATO T, MARUKANE S, NARUTOMI T, et al. High rate performance of a lithium polymer battery using a novel ionic liquid polymer composite [J]. J. Power Sources, 2007, 164: 390-396.
[38] OHNO H, YOSHIZAWA M, OGIHARA W. Development of new class of ion conductive polymers based on ionic liquids [J]. Electrochim. Acta, 2004, 50: 255-261.
[39] JUGER J, MEYER F, VIDAL F, et al. Synthesis, polymerization and conducting properties of an IL-type anionic monomer [J]. Tetrahedron Lett., 2009, 50: 128-131.
[40] RICKS-LASKOSKI H L, SNOW A W. Synthesis and electric field actuation of an ionic liquid polymer [J]. J. Am. Chem. Soc., 2006, 128: 12402-12403.
[41] PUJOL-FORTIN M L, GALIN J C. Poly (ammonium alkoxydicyanoethenolates) as new hydrophobic and highly dipolar poly(zwitterions) (Ⅰ): Synthesis [J]. Macromolecules, 1991, 24: 4523-4530.
[42] BI W, TIAN M, ROW K H. Combined application of ionic liquid and hybrid poly (ionic liquid)-bonded silica: an alternative method for extraction, separation and determination of flavonoids from plants [J]. Anal. Lett., 2013, 46: 416-428
[43] BI W, TIAN M, ROW K H. Solid-phase extraction of matrine and oxymatrine from Sophora Flavescens Ait using amino-imidazolium polymer [J]. J. Sep. Sci., 2010, 33: 1739-1745.
[44] TIAN M, YAN H, ROW K H. Solid-phase extraction of caffeine and theophylline from green tea by a new ionic liquid-modified functional polymer sorbent [J]. Anal. Lett., 2010, 43: 110-118.
[45] YUAN S F, DENG Q L, FANG G Z, et al. A novel ionic liquid polymer material with high binding capacity for proteins [J]. J. Mater. Chem., 2012, 22: 3965-3972.
[46] PELUSO I, MIGLIO C, MORABITO G, et al. Flavonoids and immune function in human: a systematic review [J]. Crit. Rev. Food Sci. Nutr., 2015, 55(3): 383-395.
[47] MARIMUTHU P, WU C L, CHANG H T, et al. Antioxidant activity of methanolic extract from the bark of Chamaecyparisobtusevar Formosana [J]. J. Sci. Food Agr., 2008, 88: 1400-1405.
[48] FREIRE M G, NEVES C M S S, MARRUCHO I M, et al. High-performance extraction of alkaloids using aqueous two-phase systems with ionic liquids [J]. Green Chem., 2010, 12: 1715-1718.
[49] BRUNETTO M R, GUTIERREZ L, DELGADO Y, et al. Determination of theobromine, theophylline and caffeine in cocoasamples by a high-performance liquid chromatographic method with on-line sample cleanup in a switching-column system [J]. Food Chem., 2007, 100: 459-467.
[50] RAHIMI P, RAFIEE-POUR H, GHOURCHIAN H, et al. Ionic-liquid/ NH2-MWCNTs as a highly sensitive nano- composite for catalase direct electrochemistry [J]. Biosens. Bioelectron., 2010, 25: 1301-1306.
[51] XU H, XIONG H Y, ZENG Q X, et al. Direct electrochemistry and electrocatalysis of heme proteins immobilized in single-wall carbon nanotubes-surfactant films in room temperature ionic liquids [J]. Electrochem. Commun., 2009, 11: 286-289.
[52] ZHU Z H, QU L N, LI X, et al. Direct electrochemistry and electrocatalysis of hemoglobin with carbon nanotube-ionic liquid-chitosan composite materials modified carbon ionic liquid electrode [J]. Electrochim. Acta, 2010, 55: 5959-5965.
[53] FU G Q, YU H, ZHU J. Imprinting effect of protein-imprinted polymers composed of chitosan and polyacrylamide: a re-examination [J]. Biomaterials, 2008, 29: 2138-2142.
[54] YU H, HO T D, ANDERSON J L. Ionic liquid and polymeric ionic liquid coatings in solid-phase microextraction [J]. Trends Anal. Chem., 2013, 45: 219-232.
[55] TRUJILLO-RODRÍGUEZ M J, YU H L, COLE W T S, et al. Polymeric ionic liquid coatings versus commercial solid-phase microextraction coatings for the determination of volatile compounds incheeses [J]. Talanta, 2014, 212: 153-162.
[56] ZHANG Y, WANG X, LIN C, et al. A novel SPME fiber chemically linked with 1-vinyl-3-hexadecylimidazolium hexafluorophosphate ionic liquid coupled with GC for the simultaneous determination of pyrethroids in vegetables [J]. Chromatographia, 2012, 75: 789-797.
[57] FENG J, SUN M, XU L, et al. Novel double-confined polymeric ionic liquids as sorbents for solid-phase microextraction with enhanced stability and durability in high-ionic-strength solution [J]. J. Chromatogr. A, 2012, 1268: 16-21.
[58] TAMAYO F G, TURIEL E, MARTÍN-ESTEBAN A. Molecularly imprinted polymers for solid-phase extraction and solid-phase microextraction: recent developments and future trends [J]. J. Chromatogr. A, 2007, 1152: 32-40.
[59] TIAN M, BI W, ROW K H. Molecular imprinting in ionic liquid-modified porous polymer for recognitive separation of three tanshinones from Salvia miltiorrhiza Bunge [J]. Anal. Bioanal. Chem., 2011, 399: 2495-2502.
[60] BI W, TIAN M, ROW K H. Separation of phenolic acids from natural plant extracts using molecularly imprinted anion-exchange polymer confined ionic liquids [J]. J. Chromatogr. A, 2012, 1232: 37-42.
[61] BI W, TIAN M, ROW K H. Evaluation of molecularly imprinted anion-functionalized poly(ionic liquid)s by multi-phase dispersive extraction of flavonoids from plant [J]. J. Chromatogr. B, 2013, 913: 61-68.
[62] YUAN S F, DENG Q L, FANG G Z, et al. Protein imprinted ionic liquid polymer on the surface of multiwall carbon nanotubes with high binding capacity for lysozyme [J]. J. Chromatogr. B, 2014, 960:239-246.
[63] ZHANG Q, WANG W, LU Y, et al. Reversibly coagulatable and redispersible polystyrene latex prepared by emulsion polymerization of styrene containing switchable amidine [J]. Macromolecules, 2011, 44: 540-545.
[64] ZHANG Q, YU G, WANG W, et al. Preparation of N2/CO2triggered reversibly coagulatable and redispersible latexes by emulsion polymerization of styrene with a reactive switchable surfactant [J]. Langmuir, 2012, 28: 5940-5946.
[65] ZHANG Q, YU G, WANG W, et al. Preparation of CO2/N2-triggered reversibly coagulatable and redispersible polyacrylatelatexes by emulsion polymerization using a polymeric surfactant [J]. Macromol. Rapid Commun., 2012, 33: 916-921.
[66] ZHANG Q, YU G, WANG W, et al. Switchable block copolymer surfactants for preparation of reversiblycoagulatable and redispersible poly(methyl methacrylate) latexes [J]. Macromolecules, 2013, 46: 1261-1267.
[67] LIU P, LU W, WANG W, et al. Highly CO2/N2-switchable zwitterionic surfactant for pickering emulsions at ambient temperature [J]. Langmuir, 2014, 30: 10248-10255.
[68] LEE H, PIETRASIK J, SHEIKO S, et al. Stimuli-responsive molecular brushes [J]. Prog. Polym. Sci., 2010, 35: 24-44.
[69] YU G, LU Y, LIU X, et al. Polyethylenimine-assisted extraction of a-tocopherol from tocopherol homologues and CO2-triggered fast recovery of the extractant [J]. Ind. Eng. Chem. Res.,2014, 53: 16025-16032.
[70] LU Y, YU G, WANG W J, et al. Design and synthesis of thermoresponsive ionic liquid polymer in acetonitrile as a reusable extractant for separation of tocopherol homologues [J]. Macromolecules, 2015, 48: 915-924.
[71] TANG S, LIU S, GUO Y, et al. Recent advances of ionic liquids and polymeric ionic liquids in capillary electrophoresis and capillary electrochromatography [J]. J. Chromatogr. A, 2014, 1357: 147-157
[72] LI J, HAN H, WANG Q, et al. Polymeric ionic liquid as dynamic coating additive for separation of basic proteins by capillary electrophoresis [J]. Anal. Chim. Acta, 2010, 674: 243-248.
[73] LI J, WANG Q, HAN H, et al. Polymeric ionic liquid as additive for the high speed and efficient separation of aromatic acids by co-electroosmotic capillary electrophoresis [J]. Talanta, 2010, 82: 56-60.
[74] LI J, HAN H, WANG Q, et al. Polymeric ionic liquid-coated capillary for capillary electrophoresis [J]. J. Sep. Sci., 2011, 34: 1555-1560.
[75] LI J, HAN H F, WANG Q, et al. Poly(N-vinylimidazole)-grafted capillary for electrophoresis prepared by surface-initiated atom transfer radical polymerization [J]. J. Sep. Sci., 2010, 33: 2804-2810.
[76] LI W, ZHANG Z, HAN B, et al. Conversion of fructose to 5-hydroxymethylfurfural using ionic liquids prepared from renewable materials [J]. Green Chem., 2008, 10: 1142-1145.
[77] PRESCHER S, POLZER F, YANG Y, et al. Polyelectrolyte as solvent and reaction medium [J]. J. Am. Chem. Soc., 2014, 136(1): 12-15.
DOI:10.11949/j.issn.0438-1157.20151258
中图分类号:TQ 028.8
文献标志码:A
文章编号:0438—1157(2016)02—0416—09
基金项目:国家自然科学基金项目(21420102008,21376211,20976153);化学工程联合国家重点实验室开放课题(SKL-ChE-14D01)。
Corresponding author:WANG Wenjun,wenjunwang@zju.edu.cn supported by the National Natural Science Foundation of China (21420102008, 21376211, 20976153) and the Chinese State Key Laboratory of Chemical Engineering at Zhejiang University (SKL-ChE-14D01).
Poly(ionic liquid)s and their applications in natural product separation
LU Yangyang, WANG Wenjun, LI Bogeng
(State Key Laboratory of Chemical Engineering, Zhejiang University, Hangzhou 310027, Zhejiang, China)
Abstract:Development of natural products relies heavily on advanced separation technologies for extraction from abundant biomass raw material sources. A novel approach for isolating natural products and their precursors is the use of the poly(ionic liquid). Poly(ionic liquid) extractants provide the polarity, designability and selectivity of ionic liquids while being less toxic and more easily recoverable. In this review, synthetic methods of polycations, polyanions and polyzwitterions are summarized. The latest progress in the use of poly(ionic liquid)-mediated solid phase extraction, solid phase microextraction, molecular imprinted solid phase extraction, liquid-liquid extraction and capillary electrophoresis technologies to separate natural products such as flavonoids, alkaloids, phenols and proteins are reviewed. This will include a description of the proposed separation mechanism and the features of this approach including the reported efficiencies, stability, and recoverability of poly(ionic liquid)s. The specific focus will be on the use of smart polymeric materials for separation of natural products. Moreover, the designing and synthetic tailoring of new species to address current challenges and expand the applicability of poly(ionic liquid)-mediated technologies for separating natural products will be introduced.
Key words:poly(ionic liquid); natural product; separation; extraction; stimuli-responsive extractant; recovery

