超广谱β-内酰胺酶基因分型特点及其对抗生素敏感性分析
招钜泉马均宝刘红军
超广谱β-内酰胺酶基因分型特点及其对抗生素敏感性分析
招钜泉1马均宝2刘红军3
【摘要】目的 探讨超广谱β-内酰胺酶(ESBLs)的基因分型特点及其对抗生素的敏感性。方法 选取2014年8月至2015年8月从佛山市南海区第四人民医院收治的不同住院患者,及其不同部位有效分离出来的大肠埃希菌100株和肺炎雷伯菌150株,对所有菌株实施科学化的分离与鉴定,然后采用纸片扩散的药敏实验方式来明确超广谱β-内酰胺酶的基因分型情况,观察所有菌株对抗生素药物的敏感情况。结果 从大肠埃希菌100株和肺炎雷伯菌150株中确认出来的超广谱β-内酰胺酶菌株有120株,其中40株大肠埃希菌中携带TEM型基因占45%,80株肺炎克雷伯菌单独携带有TEM 型β-内酰胺酶基因占25%。此外,超广谱β-内酰胺酶细菌对于头孢菌素类以及青霉素类抗生素的实际敏感性为0%~40%。结论 超广谱β-内酰胺酶细菌的基因分型以TEM型为主,且具有相对较强的耐药性。
【关键词】超广谱β-内酰胺酶;基因分型;抗生素;敏感性
1佛山市南海区第四人民医院检验科,广东佛山 528200
2佛山市第一人民医院检验科,广东佛山 528000
3广州达安临床检验中心有限公司实验室,广东广州 510000
现阶段,大肠埃希菌以及肺炎克雷伯菌属于临床上比较常见的病菌,从某种程度上讲也是医院感染科比较常见的致病菌[1]。目前,随着头孢菌素在临床中的广泛使用,超广谱β-内酰胺酶肺炎克雷伯菌与大肠埃希菌的感染情况也越来越严重,这是β-内酰胺类型抗生素产生耐药性的重要原因之一。超广谱β-内酰胺酶主要是由质粒介导,非常容易在同一种属或者是不同种属之间的细菌进行传递,进而形成暴发流行,最终给治疗带来困难,包括患者的病死率不断增高、住院时间日益延长、治疗费用上升以及治疗过程中的选择性不断狭窄等[2]。而且,随着新型抗生素在临床中的应用,相关人员更应该对超广谱β-内酰胺酶抗生素的敏感性实施科学化分析研究[3]。为探讨超广谱β-内酰胺酶(ESBLs)的基因分型特点及其对抗生素的敏感性,本研究选取2014年8月至2015年8月我院收治的不同住院患者及其不同部位有效分离出来的大肠埃希菌100株和肺炎雷伯菌150株,并将其作为分析研究对象,现报道如下。
1 资料与方法
1.1 一般资料 选取2014年8月至2015年8月我院收治的不同住院患者及其不同部位有效分离出来的大肠埃希菌100株和肺炎雷伯菌150株,对研究中的所有菌株采用常规方法以及板条进行科学化鉴定,具体质控菌株是大肠埃希菌,型号为ATCC25922。
1.2 方法
1.2.1 纸片扩散法实施药敏实验 借助双纸片协同试验方法进行初筛,具体操作方法是将阿莫西林棒酸纸片放置于培养皿中央,然后在其周围20 mm位置贴上头孢他啶纸片、头孢噻肟纸片、头孢曲松纸片以及氨曲南纸片。抗生素纸片均购于Ox-oid有限公司,在35 ℃条件下科学培养18 h,当阿莫西林棒酸纸片以及周围其他纸片之间出现协同性抑菌作用时,则可初筛诊断为超广谱β-内酰胺酶呈现为阳性。初筛实验完成后,再采用浓度梯度方法进行确认,采用瑞士公司提供的标准化Etest(E试验)试条,根据规范化方法进行操作。Etest试条主要包括含有或不含有棒酸的氨曲南药物成分、头孢他啶药物成分以及头孢噻肟药物成分,其中棒酸可以使最小抑菌浓度(MIC)下降约8倍以上,可以诊断为ESBLs呈现为阳性。
1.2.2 核型的检测方法与电泳检测方法 采用美国公司提供的相关检测工具,该检测过程主要包括菌细胞的溶解、菌株DNA片段在凝胶电泳方面的分离、限制性内切酶EcoRⅠ对细菌DNA专业化的酶切情况,以及将大肠杆菌与肺炎肺炎雷伯菌rRNA所操纵的DNA探针和所分离出来的DNA片段之间的杂交情况。严格根据DNA具体位置以及强度实施自动化核型分析与比较。如果相似系数≥0.93,则可判定为相同核型。在脉冲场的凝胶电泳检测方法中采用限制性内切酶类型SpeⅠ的消化细菌DNA,然后利用浓度为1%的琼脂糖凝胶在CHEF-DRⅡ型电泳仪上实施检测。脉冲时间控制在5~60 s,温度13 ℃,电压200 V,实际电泳时间控制在23 h,比较每一菌株在电泳条带上的变化情况,当3条以上电泳带存在差异时,则可认为是不同分型;当1~3条条带存在差异时,可认为是不同亚型。在β-内酰胺酶的制备过程中,需要将细菌接种于5 ml胰大豆液中进行过夜培养,然后再选取剂量为0.5 ml,并稀释至为9.5 ml相对新鲜的胰大豆液中,在37 ℃条件下进行振荡培养约5 h,确保离心收集的细胞悬浮于250 μl 0.2 mol/L pH值为5.5的醋酸钠中,将干冰和37 ℃的水进行反复冻融,冰浴约30 min,收集上清β-内酰胺酶粗提物,-37 ℃保存,将其作为电聚焦的电泳样品。电聚焦电泳检测过程,需要在含有两性的电解质标准化聚丙烯酰胺的凝胶上实施,其两性电解质pH在3.5~9.5、5.5~8.5以及4.0~6.5,并采用已知等电点值进行判定标准。
1.3 观察指标 观察超广谱β-内酰胺酶的实际基因分型特征以及对抗生素的实际敏感性。
2 结果
2.1 超广谱β-内酰胺酶检出情况 经过纸片扩散法从大肠埃希菌100株和肺炎雷伯菌150株中确认出来的超广谱β-内酰胺酶菌株有120株,其中包括大肠埃希菌40株和肺炎雷伯菌80株,得出大肠埃希菌的超广谱β-内酰胺酶实际检出率为40.0%,而肺炎雷伯菌的实际检出率为53.3%;不同标本所进行分离出来的超广谱β-内酰胺酶细菌存在差异性。120株超广谱β-内酰胺酶菌株中,呼吸科检出56例(46.7%),重症监护病房(ICU)检出30例(25.0%),老年科检出25例(20.8%),烧伤科检出9例(7.5%),不同科室的分离情况存在差异性。这种情况可能与抗生素应用情况有着密切关系。
2.2 超广谱β-内酰胺酶基因分型情况 从基因分型情况上进行分析,40株大肠埃希菌中,单独携带有TEM型β-内酰胺酶基因有18株(45.0%),单独携带SHV型基因有3株(7.5%),同时携带SHVB-内酰胺酶基因基因与TEM型基因的有19株(47.5%)。80株肺炎克雷伯菌基因分型中,单独携带有TEM型β-内酰胺酶基因有20株(25.0%),单独携带SHV型β-内酰胺酶基因有8株(10.0%),同时携带SHV型基因以及TEM型基因的β-内酰胺酶基因有52株(65.0%)。
2.3 超广谱β-内酰胺酶对抗生素药物的敏感性情况 超广谱β-内酰胺酶细菌对于头孢菌素类以及青霉素类的实际敏感性为0%~40%。青霉素类与头孢菌素类以及加酶抑制剂之间的合剂对于超广谱β-内酰胺酶细菌的实际效果好于未加酶抑制剂的实际效果,而且哌拉西林他唑巴坦以及头孢哌酮舒巴坦的抗生素敏感性相对较高,均>30%。超广谱β-内酰胺酶细菌对于亚胺培南、美罗培南以及多黏菌素B的敏感性均为100.00%,对于头孢唑林、哌拉西林以及头孢噻肟的敏感性均为0.00%。拉氧头孢以及头孢西丁的敏感性也相对较高,分别为78.03%以及68.25%,见表1。
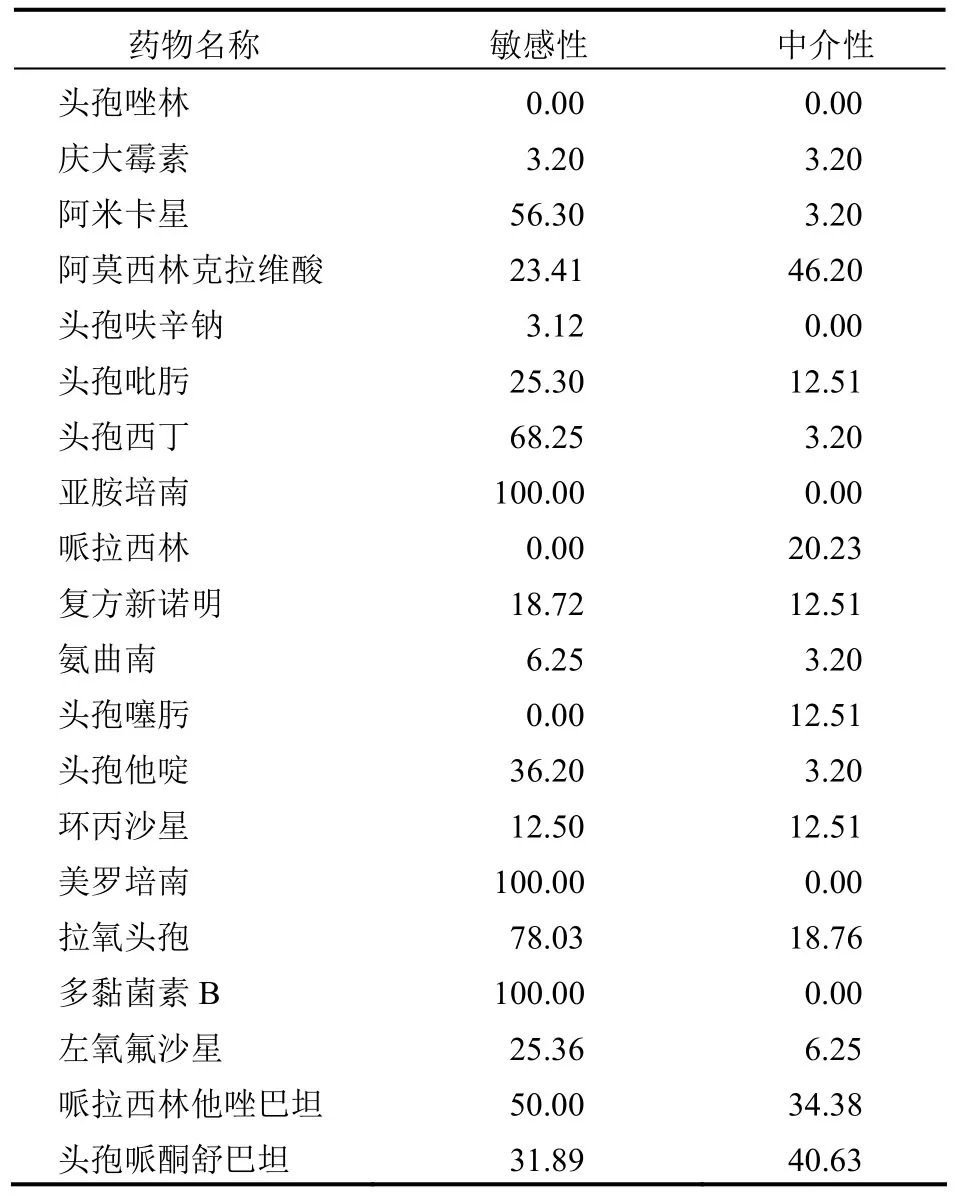
表1 超广谱β-内酰胺酶对抗生素的敏感性情况(%)
3 讨论
现阶段,从某种程度上讲,超广谱β-内酰胺酶的出现属于第3代头孢菌素最终选择的结果,其中肺炎克雷伯菌以及大肠埃希菌属于比较典型的代表菌,而且不同国家以及地区之间因抗生素使用情况的差异(使用种类以及数量)而不同,其基因分型也存在较大差异[4]。一般情况下,超广谱β-内酰胺酶细菌虽然会对头孢类抗生素具有较强耐药性,尽管个别细菌体外试验相对敏感,但体内治疗效果却不明显[5]。此外,因细菌所携带的超广谱β-内酰胺酶细菌质粒能够同时携带喹诺酮类、氨基糖甙类以及磺胺类等药物的耐药基因,所以可以使超广谱β-内酰胺酶细菌存在多种耐药表型[6]。在基因分型方面,核型分析属于自动过程,操作方法相对简单、快捷,但是因所反映rRNA基因的相关区域酶切位点出现改变,且分辨率较低,所以只能进行初步分型,尤其是对于分型情况存在差异者,可以做出流行病学的不相关结论,核型相同的情况下需要进行脉冲场的凝胶电泳分型,其分辨率较高,能够反映基因相关性,效果显著[7]。总之,超广谱β-内酰胺酶细菌具有较强耐药性,且耐抗生素的种类相对较多,在临床上应高度重视超广谱β-内酰胺酶细菌的检测以及监测,避免引起医院大面积的流行感染。
本研究中,超广谱β-内酰胺酶细菌具有较强的多重耐药性,而且超广谱β-内酰胺酶的肺炎克雷伯菌以及大肠埃希菌均携带了不同程度上的SHV型和TEM型β-内酰胺酶基因,超广谱β-内酰胺酶细菌对于头孢菌素类以及青霉素类抗生素的实际敏感率性为0%~40%。针对所需研究的第一亚群情况对β-内酰胺酶细菌情况进行基因分型调查,所分离出的β-内酰胺酶细菌菌株以及携带有TEM型的β-内酰胺酶细菌菌株情况与郭小兵等[1]研究的菌株类型相比较具有一致性,然而不同基因分型情况所占比率有较大差异[8]。说明超广谱β-内酰胺酶细菌的基因分型以TEM型为主,且具有相对较强的耐药性。
参考文献
[1] 郭小兵,代志峰,宋海容,等.CTX-M-38型超广谱β-内酰胺酶快速检测方法的建立[J].郑州大学学报(医学版),2014,11(1):66-69.
[2] 蒋鸿超,奎莉越,黄海林,等.儿童产超广谱β-内酰胺酶大肠埃希菌Ⅰ类整合子及其与ESBLs基因关系的研究[J].临床儿科杂志, 2015,12(4):345-347.
[3] 贾芳,周学章.SHV-12型超广谱β-内酰胺酶的原核表达及免疫原性分析[J].宁夏大学学报(自然科学版),2011,32(2):164-167.
[4] 侯佳惠,童郁,费静娴,等.铜绿假单胞菌超广谱β-内酰胺酶、质粒介导AmpC酶基因分布及流行特征分析[J].检验医学,2012,27(1): 39-43.
[5] 徐艳霞,陈建丽,王和,等.儿童重症监护室产超广谱β-内酰胺酶肺炎克雷伯菌的耐药基因及其流行病学特征[J].中华实用儿科临床杂志,2015,30(10):738-742.
[6] 王晓丽,陈赵慧,李兴华,等.314株铜绿假单胞菌超广谱β-内酰胺酶及AmpC酶的分布及多药耐药性分析[J].中国实验诊断学,2014,10(6):978-981.
[7] 郭桐生,崔恩博,鲍春梅,等.病毒性肝炎后肝硬化住院患者血液感染大肠埃希菌超广谱β-内酰胺酶基因型调查[J].中华实验和临床病毒学杂志,2013,27(5):348-350.
[8] 刘亚丽,徐和平,肖盟,等.评估纸片扩散法与Vitek2-compact GN13测定肠杆菌科细菌体外药敏及ESBLs可靠性的研究[J].中华微生物学和免疫学杂志,2015,12(2):139-145.
【中图分类号】R446.5
【文献标志码】A 【DOI】10.12010/j.issn.1673-5846.2016.05.088
作者简介:招钜泉(1964.03-),大专学历,副主任检验师。主要从事微生物学方向的研究

