脱硫催化剂(2-羧基酞菁钯键合MCM-41)的合成及表征
薛 科 创(陕西国防工业职业技术学院 化学工程学院,陕西 西安 710302)
脱硫催化剂(2-羧基酞菁钯键合MCM-41)的合成及表征
薛 科 创
(陕西国防工业职业技术学院 化学工程学院,陕西 西安 710302)
摘要:为了降低空气中逐渐增多的硫化物,首先合成了2-羧基酞菁钯,然后将其键合在MCM-41的表面,运用红外光谱、粉末衍射、扫描隧道显微镜对其进行了表征,最后测定了它的催化活性。结果表明:当MCM-41表面键合2-羧基酞菁钯之后,对噻吩的去处率达到了98%。
关键词:2-羧基酞菁钯;MCM-41;噻吩;去除率
由于燃油车辆的增加,使得各种油品的用量在逐年增加,因而产生了空气中的硫氧化物(SOx)逐渐增多的现象,为了控制空气中的硫含量,我国要将油品中的硫氧化物从 50×10-6降至10×10-6。这些含硫化合物主要来源于油品中硫醇、硫醚、噻吩等的燃烧[1],因此除去这些含硫化合物成为降低 SOx的关键问题。
20世纪初人们发现了具有18个π电子的共轭体系的大环共轭化合物—酞菁,它具有良好的热稳定性和化学稳定性,经常作为催化剂被人们进行研究。Gautam Das等人[2]合成了四磺酸基酞菁钴并研究了其对液相石油气的催化活性。然而2-羧基酞菁钯键合MCM-41作为一种脱硫催化剂却很少加到报道,基于此,本文合成了2-羧基酞菁钯键合MCM-41催化剂,并研究了其脱去噻吩的催化活性。
1 2-羧基酞菁钯键合MCM-41(CPcPd @MCM-41)的合成
1.1仪器与试剂
所有的试剂都购买于国药集团化学试剂有限公司。碳、氢、氮的含量采用德国elementar Vario EL III元素分析仪测定。红外光谱数据采用KBr压片,通过德国Bruker EQUINOX55红外光谱仪收集。紫外-可见光谱用美国PE公司生产的Lambda40p紫外-可见光谱光谱仪测定。粉末衍射数据通过日本理学D/MAX-3C X射线衍射仪,2θ在2 10°以1° /min速率进行收集。
1.22-羧基酞菁钯(CPcPd)的合成
2-羧基酞菁钯的合成参考文献[3]的报道,合成过程如图1所示。1,2,4-苯三酸酐1.0 g,邻苯二甲酸酐 5.2 g,(NH4)2Mo2O70.1 g,NH4Cl 1.5 g,尿素15.0 g,PdCl21.3 g,于210 ℃在硝基苯中回流5 h,静置,冷却到室温。讲反应混合物过滤,然后分别用乙醇、丙酮、乙醚、四氢呋喃、三氯甲烷回流2 h,最后用100 mL 2.0 mol/L的NaOH于100 ℃的水解12 h,过滤后,用100 mL 2.0 mol/L的HCl水解5 h,过滤,烘干,即得到2-羧基酞菁钯(CPcPd)。
1.3催化剂(CPcPd@MCM-41)的合成
0.04g 2-羧基酞菁钯与30 mL SOCl2在50 ℃回流5 h后,冷却到室温,加入0.2 g MCM-41-NH[4],240 mL无水DMF,先室温搅拌2 h,然后在70 ℃回流24 h,抽滤,然后将烘干,如图1所示。
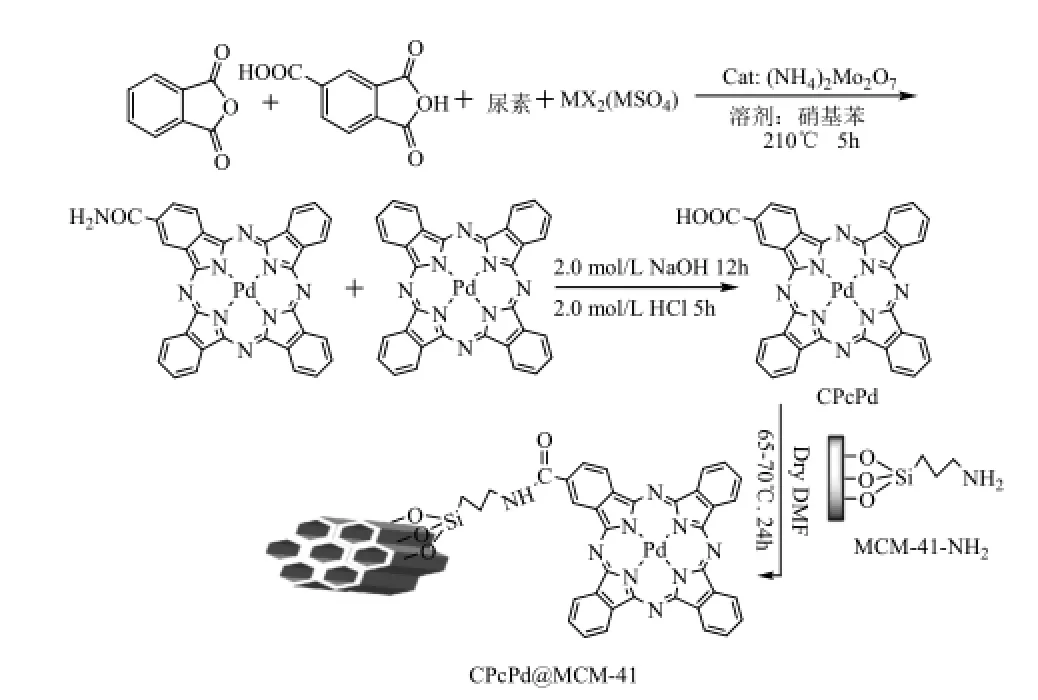
图1 2-羧基酞菁钯及CPcPd@MCM-41的合成Fig.1 Synthesis of 2-carboxylphthalocyanine palladium and CPcPd@MCM-41
1.4催化活性测试
配置2 000×10-6的噻吩溶液,加入制备的催化剂并通入空气进行反应,结束后进行离心分离,取2 μl用气相色谱测定。
2 结果与讨论
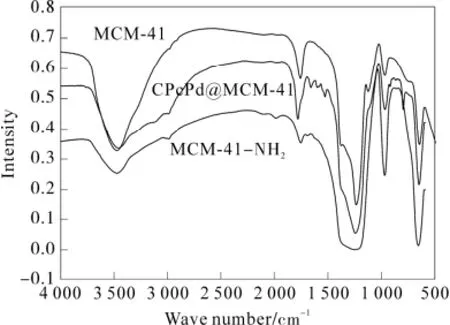
图2 MCM-41,MCM-41-NH2 and CPcPd@MCM-41的红外光谱Fig.2 FT-IR spectra of MCM-41,MCM-41-NH2 and CPcPd@MCM-41
2.12-羧基酞菁钯的表征
对 2-羧基酞菁钯进行熔点测试,熔点超过了300 ℃,利用采用德国elementar Vario EL III元素分析仪测定碳、氢、氮的含量,分别为C:59.93(59.79),H:2.43(2.48),N:16.90(16.75),元素含量基本相等。采用德国Bruker EQUINOX55红外光谱仪对2-羧基酞菁钯进行红外光谱测定,通过美国Lambda40p紫外-可见光谱光谱仪测定 2-羧基酞菁钯的紫外-可见光谱。从红外光谱图上可以看出:1 700 cm-1出现了C=O的伸缩振动吸收峰[5]。而出现于1 110,1 330,930 cm-1的吸收峰归属于酞菁环骨架的振动吸收[6]。C-N的伸缩振动吸收峰位于1 240 cm-1处。C-H的面外弯曲振动吸收峰出现在770 cm-1处[7]。在紫外-可见光谱图上出现了两个强的吸收区域:一个是在紫外区(250~350 nm)处的B带,另一个是在可见光区(600~700 nm)处的Q带[8]。B带的出现归因于酞菁中LUMO的π→π*跃迁[9]。由于羧基的影响,B带的吸收波长向短波方向移动。
2.2催化剂(CPcPd@MCM-41)的表征
2-羧基酞菁钯与MCM-41键合后,其键合的结果通过红外光谱和粉末衍射进行了证实。红外光谱图如图2所示。
在没有键合2-羧基酞菁钯的 MCM-41的红外光谱图中,由于MCM-41中SiO4四面体的Si-O-Si吸收峰,致使在1 080 cm-1处出现的宽而强的吸收峰,而Si-O-H 的伸缩振动吸收峰则出现在960 cm-1处,此外,在460 cm-1处还出现了SiO4四面体的弯曲振动峰[10]。与MCM-41红外光谱图进行比较,在MCM-41-NH2中有以下明显的变化[11]:960 cm-1处的Si-O-H吸收峰消失,在2 940 cm-1和1 540 cm-1处分别出现了 C-H和 N-H伸缩振动,这些都说明MCM-41-NH2的生成。当2-羧基酞菁钯通过氨基与MCM-4键合之后,出现了1 650 cm-1左右的尖吸收峰为酰胺键C=O的伸缩振动,1 510 cm-1左右的吸收峰是N-H的振动吸收,而在1 500 ~1 400 cm-1处存在着C-H的弯曲振动和C-N的振动吸收。但在1 460 cm-1的吸收峰变强,这可能是由于芳香环的振动与C-H的振动相互叠加,以至于使吸收峰变强。酞菁环的振动吸收峰出现在1 393 cm-1和950 cm-1处。从粉末衍射图(图3)可以看出:
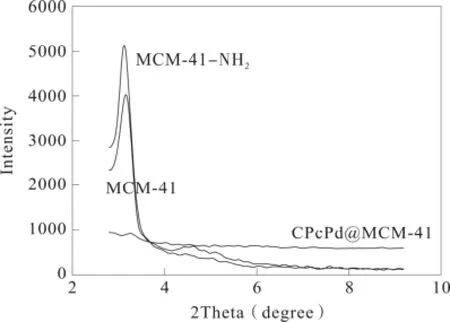
图3 MCM-41,MCM-41-NH2 and CPcPc@MCM-41的粉末衍射图Fig.3 XRD of MCM-41,MCM-41-NH2 and CPcPc@MCM-41
100晶面(2θ=2.430°),110晶面(2θ=4.262°)以及120晶面面(2θ=4.862°)出现了三个强的衍射峰,这与MCM-41文献报道的一致[12],说明MCM-41是高度有序的,MCM-41-NH2图中100晶面的衍射峰仍旧存在,110晶面和 120晶面消失,说明MCM-41的结构仍然存在,但是有序程度有所降低。当2-羧基酞菁钯键合MCM-41之后,出现了许多弱衍射峰,这种情况归因于在MCM-41表面键合2-羧基酞菁钯所致。
利用扫描隧道显微镜对键合前后的MCM-41表面进行表征如图4。

图4 MCM-41和CPcPd@MCM-41的扫描电镜图片Fig.4 SEM images of MCM-41 and CPcPd@MCM-41
可以明显看出:2-羧基酞菁钯没有与MCM-41键合之前,表面是不平整的,但基本上是一个整体,当2-羧基酞菁钯没有与MCM-41键合之后,表面覆盖了被许多层状的物质,这可能是由于MCM-41的表面键合了2-羧基酞菁钯的结果。
2.3催化活性讨论
利用气相色谱分别对MCM-41和MCM-41与2-羧基酞菁钯键合后的催化活性进行了测定,结果如图5所示。
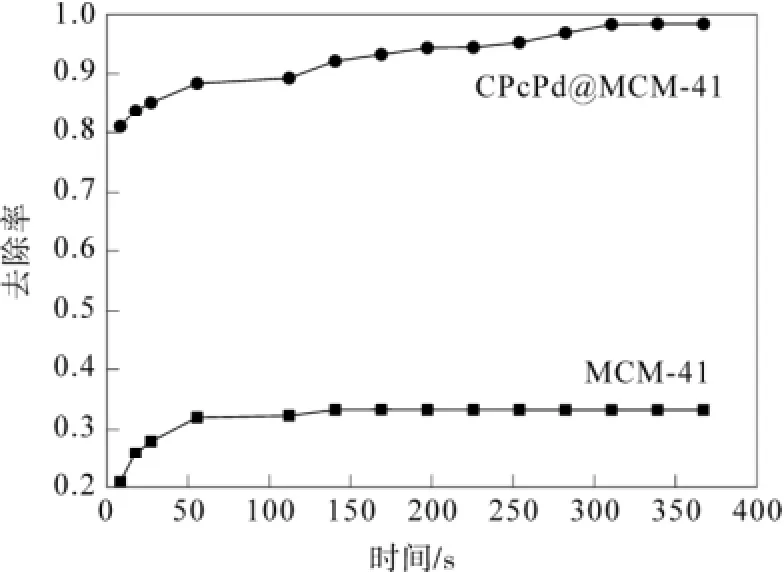
图5 CPcPd@MCM-41去除噻吩的催化活性Fig.5 Catalytic activity of the removal of CPcPd@MCM-41
可以看出:当MCM-41表面没有键合2-羧基酞菁钯时,催化活性是很低的,对噻吩的去除率只有33%,这种脱硫可能不属于化学反应脱硫,而是由于MCM-41高的吸附能力,发生了物理吸附,吸附了部分噻吩而使溶液中硫含量有所降低。当MCM-41的表面键合2-羧基酞菁钯之后,催化活性达到了98%。对这种结果可以这样认为,非均相催化要经过扩散、吸附、反应、脱附、扩散的过程,首先是MCM-41高的吸附能力,吸附溶液中的噻吩到催化剂表面,很快促进了反应的结果。
3 结 论
制备了一种脱硫催化剂(CPcPd@MCM-41),通过红外光谱、X-ray粉末衍射、扫描电子显微镜对其进行了表征,然后测定了它们去除噻吩的催化活性,结果表明:由于MCM-41高的吸附能力,吸附溶液中的噻吩到催化剂表面,很快促进了反应的结果,使 CPcPd@MCM-41对噻吩的去除率达到了98%。
参考文献:
[1]I.V.Babich,J.A.Moulijn.Hydrodesulphurization perform -ance of NiW/TiO2-Al2O3catalyst for ultra clean diesel [J].Catalysis Today,2003,140∶187-191
[2]Gautam Das,Bir Sain,Sunil Kumar,et al.Synthesis,cha -racterization and catalytic activity of cobalt phthalocyanine tetrasulphonamide in sweetening of LPG [J].Catalysis Today,2009,141∶152-156.
[3]Jincan C.,Naisheng C.,Jinling H.,et al,Derivatizable phthalocyanine with single carboxyl group∶ Synthesis and purification [J].Inorg.Chem.Commun.,2006,9∶ 313-315.
[4]Bart M.L.Dioos,Wouter A.Geurts,Pierre A.Jacobs.Coordination of CrIII (salen) on functionalised silica for asymmetric ring opening reactions of epoxides [J].Catalysis Letters,2004,97(3-4)∶125-129.
[5]Sharman W.M.,Lier van J.E..A newprocedureforthesy nthesisofwater-solubletricationic and -anionic phthalocyanin es [J].J.Porphyrins Phthalocyanines,2005,9∶ 651-658.
[6]Mack J.,Stillman M.J..Assignment of the optical spectrum of metal phthalocyanines through spectruml band deconvolution analysis and ZINDO calculations [J].Coordin.Chem.Rev.,2001,219-221∶993-1032.
[7]Achar B.N.,Lokesh K.S..Studies on polymorphic modifications of copper phthalocyanine [J].J.Solid State Chem.,2004,177∶1987-1993.
[8]Özil M.,Ağar E.,Sxasxmaz S.,et al.Microwave-assisted synthesis and characterization of the monomeric phthalocyanines containing naphthalene-amide group moieties and the polymeric phthalocyanines containing oxa-aza bridge [J].Dyes and Pigments,2007,75∶ 732-740.
[9]Yarasir M.N.,Kandaz M.,Senkal B.F.,et al.Metal-ion sensing and aggregation studies on reactive phthalocyanines bearing soft-metal receptor moieties;synthesis,spectroscopy and electrochemistry [J].Polyhedron 2007,26∶ 5235-5242.
[10]Alexandre G.S.Prado,Claudio Airoldi.Different neutral surfactant template extraction routes for synthetic hexagonal mesoporous silicas [J].J.Mater.Chem.,2002,12(12):3823-3826.
[11]Pankaj Das,Ana Rosa Silva,Ana P.Carvalho,et al.Organo-func tionalized mesoporous supports for Jacobsen-type catalyst∶ Laponit e versus MCM-41[J].J Mater Sci.,2009,44∶ 2865-2875.
[12]Shinji I,Shiyou G,Yoshiaki F,et al.Novel mesoporous materials with a uniform distribution of organic groups and inorganic oxide in their frameworks [J].J.Am.Chem.Soc.,1999,121∶ 9611-96143.
Synthesis and Characterization of Desulfurization Catalyst (MCM-41 With 2-Carboxyl Phthalocyanine Palladium)
XUE Ke-chuang
(School of Chemical Engineering,Shaanxi Institute of Technology,Shaanxi Xi'an 710302,China)
Abstract:2-Carboxyl phthalocyanine palladium was synthesized and then bonded to the surface of MCM-41,and it was characterized by FT-IR,powder diffraction and scanning tunneling microscope,and its catalytic activity was determined.The results show that the removal rate of thiophene is 98% when the surface of MCM-41 is bonded by 2-carboxyl phthalocyanine palladium.
Key words:2-carboxyl phthalocyanine palladium;MCM-41;Thiophene;Removal rate
中图分类号:TQ 426
文献标识码:A
文章编号:1671-0460(2016)01-0051-03
基金项目:陕西国防工业职业技术学院项目,项目号:Gfy 15-21。
收稿日期:2015-09-23
作者简介:薛科创(1985-),男,陕西咸阳人,讲师,硕士学位,研究方向:催化剂的设计与合成,从事教学工作。E-mail:xuekechuang@126.com。

