miR-181a吸附海绵载体改善肝细胞胰岛素抵抗作用研究
西安交通大学医学院附属西安市第九医院内分泌科(西安710054)
牛 瑜 王述进Δ
miR-181a吸附海绵载体改善肝细胞胰岛素抵抗作用研究
西安交通大学医学院附属西安市第九医院内分泌科(西安710054)
牛瑜王述进Δ
摘要目的:构建对肝癌细胞系HepG2中内源性成熟miR-181a具有的抑制作用的特异性吸附海绵载体 (miR-181a-sponge),验证其在葡萄糖胺诱导的HepG2细胞胰岛素抵抗模型中改善胰岛素敏感性的作用。方法:针对成熟人源miR-181a的序列,设计在9-12位发生突变的反义序列,并重复7个拷贝,串联至pEGFP-C2真核表达载体及pGL3-Promoter载体中,通过双荧光素酶报告基因系统验证该吸附海绵的效果;同时在葡萄糖胺诱导的HepG2细胞胰岛素抵抗模型中转染miR-181a吸附海绵载体,检测细胞对胰岛素刺激的应答效果。结果:pEGFP-C2-181a-SP载体可以成功的在细胞中表达,其绿色荧光呈阳性。双荧光素酶报告基因系统显示,pEGFP-C2-181a-SP载体可以显著抑制外源性miR-181amimics的活性(P< 0.05)。Western blot结果显示转染pEGFP-C2-181a-SP载体可以改善葡萄糖胺诱导的HepG2胰岛素抵抗细胞模型对胰岛素的应答。结论:miR-181a吸附海绵载体策略可以成功的诱导吸附miR-181a,构建的pEGFP-C2-181a-SP载体基因显著增加HepG2细胞的胰岛素敏感性,为改善miR-181a导致的肝细胞胰岛素抵抗提供了潜在的解决方案,有可能成为2型糖尿病治疗的新策略。
主题词@microRNA-181a吸附海绵载体胰岛素抗药性糖尿病,实验性肝细胞
2型糖尿病(Type2 diabetesmellitus, T2DM)患者胰岛素抵抗发病率超过80%, 胰岛素抵抗被认为是引发T2DM的始动因素[1-2],因此深入探寻代谢器官中胰岛素抵抗发生及发展的机制,以寻找潜在的治疗策略对突破2型糖尿病的治疗瓶颈意义重大。成熟微小RNA(microRNA, miRNA)是一类由20~23个核苷酸组成的内源性非编码单链小RNA,通过与靶基因mRNA的3’端非翻译区(3’-untranslated region,3’-UTR)互补结合导致靶基因的降解或抑制靶基因的翻译,在转录后水平调节基因的表达[3]。到目前为止,已发现数种microRNA在肝、骨骼肌和脂肪细胞等胰岛素主要效应器官的过表达引起胰岛素在靶组织的信号转导及功能调节的障碍,导致胰岛素抵抗[4]。microRNA-181a(miR-181a)是其大家族中的一员。而干涉microRNA的表达及功能已经成为一项成熟技术。我们可人为地改变miRNA 的合成及功能,使机体内异常的miRNA 水平得以纠正,从而缓解胰岛素抵抗。microRNA吸附海绵载体是利用microRNA的“种子序列”,通过互补识别使细胞内源性的成熟microRNA结合到该载体上,从而抑制目的microRNA的活性,是目前干涉microRNA广泛采用的方法。且此法设计操作较便捷,还可将其包装于病毒内,应用于体内实验,成本较低。本文采用microRNA吸附海绵策略[5],构建针对miR-181a的反义吸附片段,串连克隆至真核表达载体pEGFP-C3中,并转染肝癌细胞系HepG2,探讨miR-181a吸附海绵载体对改善肝脏细胞胰岛素敏感性的应用。
材料和方法
1细胞与试剂人源肝癌细胞系HepG2 购自中国科学院上海生命科学研究院细胞资源中心,HEK293T细胞为本科室保存。表达载体pEGFP-C3及pGL3-Promoter为本科室留存。胎牛血清及DMEM 培养基购自GIBCO。实时荧光定量检测试剂盒( SYBR Green ),EcoRI、EcoRⅤ及BamHI核酸内切酶购自TAKARA。逆转录酶( Reverse Transcriptase,M-MLV) 、Lipofectamine2000,Trizol,第一链cDNA合成试剂盒( TransScriptⅡFirst-Strand cDNA Synthesis SuperMix)购自invitrogen。miRcutemicroRNA cDNA第一链合成试剂盒及miRcute microRNA荧光定量检测试剂盒( SYBR Green ),T4连接酶购自天根。双荧光素酶报告基因(DLRTM)检测试剂盒购自Promega公司。miR-181amimics及阴性对照NC-mimic购自上海吉玛公司。RiPA蛋白裂解液购自碧云天。anti--pAKT(s473)及anti-total AKT一抗购自cell signaling。远红外荧光二抗iRDye 800CW goat anti-rabbit IgG(H+L)购自Li-cor公司。
2方法
2.1miR-181a吸附海绵片段的设计:根据miRBase网站所录has-miR-181a的成熟序列(MiMAT0000256)5’-AACATTCAACGCTGTCGGTGAGT-3’,设计miR-181a的反义序列(miR-181a-AS),保持其种子序列区严格互补配对的同时,将与miR-181a第9~12位对应的碱基突变为“ATC”以防止吸附海绵在细胞的剪切降解,再在两个反义序列之间加入“GCGC”等富含GC的连接序列,最终构成7个拷贝的吸附海绵(miR-181a-sponge或miR-181a-SP)(图1)。设计EcoRi酶切位点于该构件的上游,EcoRⅤ及BamHi酶切位点于该构件的下游,以便进行重组质粒的构建,并在EcoRi酶切位点后面加上终止密码子TAG。通过基因合成的方法,获得含199bp吸附海绵序列的表达载体pUC57-181a-SP。基因合成由上海生工公司完成。
2.2miR-181a吸附海绵真核表达载体及Luciferase检测载体构建及细胞转染:构建pEGFP-C2-181a-SP载体:EcoRi及BamHi双酶切pUC57-181a-SP及pEGFP-C2空载体,经DNA凝胶电泳,回收215bp小片段及pEGFP-C3双酶切载体。T4连接酶将两者4℃过夜连接,连接产物转化DH5α感受态菌种,涂布于氨苄青霉素抗性LB培养基平板,37℃过夜培养。次日,挑取若干菌落在LB液体培养基中扩增培养,并保存菌种送测序鉴定。构建pGL3-181a-SP载体:EcoRi及EcoRⅤ双酶切pUC57-181a-SP及pGL3-Promoter载体,该克隆载体制作步骤同上。将HEK293T细胞均匀接种至6孔板中,待细胞融合至80%,按Lipofectamine2000脂质体试剂盒说明书,将构建好的pEGFP-C2-181a-SP载体转染至细胞内,以pEGFP-C2空载体作对照组。转染24h后收集细胞,检测荧光素酶活性。
2.3Luciferase荧光素酶报告基因系统验证miR-181a吸附海:HEK293T细胞以8∶1的体积比共转染pEGFP-C2-181a-SP及pGL3-181a-SP,同时转染pRL-TK内参质粒和miR-181a mimics(100nM每孔),以pEGFP-C2空载体做对照,各重复3个孔。转染24h后,用试剂盒提供的被动裂解液裂解细胞并置冰上快速震摇30min;随后离心,在Promega GLOMA luminometer仪器上检测荧光素酶活性。
2.4胰岛素抵抗细胞模型建立及处理:将HepG2细胞均匀接种至6孔板中,待细胞融合至80%,依前述方法,将构建好的pEGFP-C2-181a-SP载体转染至细胞内,以pEGFP-C2空载体作对照组。转染48h后,用含18nmol/L的葡萄糖胺及10%胎牛血清的低糖DMEM培养细胞12h,随后再用含100 nmol/L胰岛素的无血清高糖DMEM处理细胞30min及60min。收集细胞用RiPA蛋白裂解液裂解细胞制备蛋白样本,用于Western blot检测。
2.5Western blot检测:将裂解好的蛋白样本,按BCA法蛋白定量试剂盒说明书进行总蛋白定量,取40μg蛋白样品进行SDS-PAGE 凝胶电泳,随后将凝胶蛋白转移到硝酸纤维膜(NC)膜上,用兔抗人anti-pAKT及anti-total AKT一抗(1∶800稀释)4℃孵育过夜、GAPDH蛋白(36KD)作为内参,二抗用iRDye 800CW goat anti-rabbit IgG(H+L)(1∶10000 稀释)室温孵育1h,于Odyssey远红外扫膜仪成像。
2.6统计学方法:应用SPSS 19.0统计学软件进行t检验,P<0.05认为有统计学意义。
结果
1miR-181a吸附海绵真核表达载体验证miR-181a吸附海绵作为3’UTR插入pEGFP-C2载体,可以与成熟的miR-181a特异性结合,诱骗吸附细胞内的miR-181a,同时由于其9~12位的突变,可以在结合区形成一个“空泡”,从而逃避细胞内降解机制对该处位点的识别,稳定成熟miR-181a在吸附海绵上的结合(图1)。测序结果显示,pEGFP-C2-181a-SP 载体构建成功(图2)。pEGFP-C2-181a-SP转染HepG2细胞24h后,于荧光显微镜下观测绿色荧光,以检验表达效率(图3)。
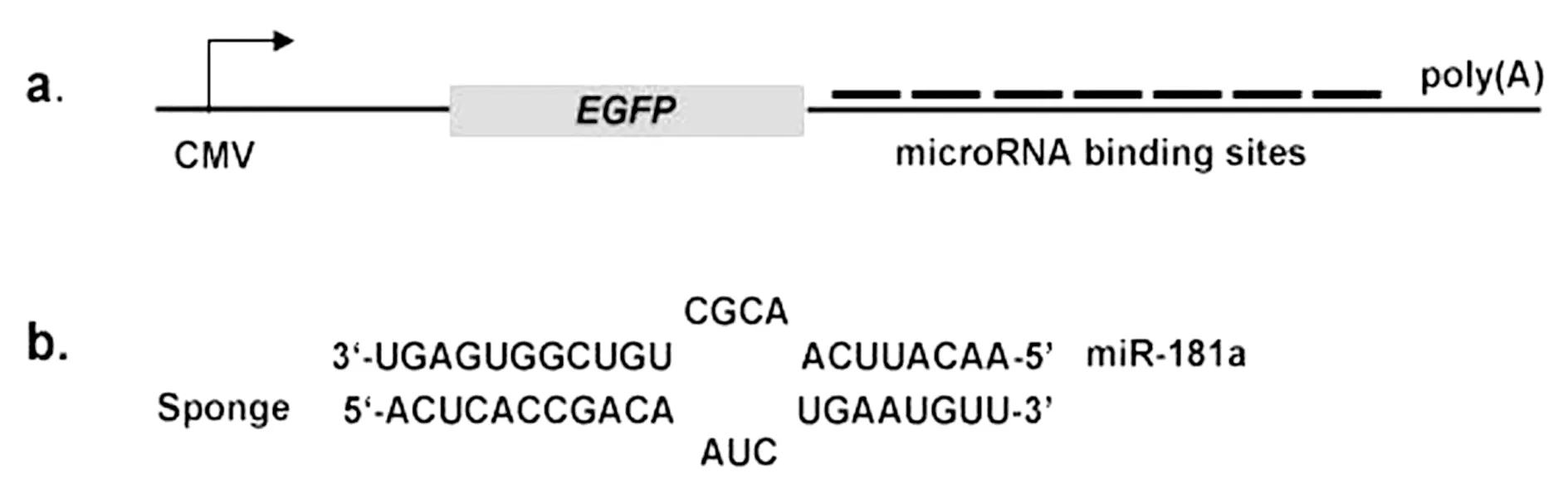
图1 microRNA吸附海绵结构示意图(a:pEGFP-C2-181a-SP载体构建策略图;b:miR-181a 吸附海绵“空泡”突变策略图)
2双荧光素酶报告基因系统验证pEGFP-C2-181a-SP吸附成熟体miR-181a效果为验证pEGFP-C2-181a-SP吸附miR-181a的效果,我们构建了pGL3-181a-SP 荧光素酶报告基因载体,当与pEGFP-C2-181a-SP共转染HEK293T细胞时,外源性的miR-181a mimics会被吸附海绵载体诱骗吸附,而无法抑制海肾荧光素酶表达。结果显示与预期一致,与共转染pEGFP-C2空载体对比,共转染pEGFP-C2-181a-SP荧光素酶活性显著升高(P<0.05,图4)。
3Western blot检测pEGFP-C2-181a-SP改善HepG2细胞胰岛素敏感性效果在葡萄糖胺诱导胰岛素抵抗HepG2细胞中经胰岛素处理,Western blot检测胰岛素通路应答Marker即磷酸化的AKT(pAKT)表达变化,结果显示,转染pEGFP-C2-181a-SP吸附海绵载体后与对照组相比,pAKT蛋白水平显著升高,提示胰岛素敏感性增强(图5)。

图3 pEGFP-C2-181a-SP载体转染HepG2细胞24h绿色荧光表达

图4 双荧光素酶报告基因系统验证miR-181a-sponge 对miR-181a的吸附作用

图5 miR-181a-sponge显著增加pAKT蛋白表达水平
讨论
本实验采用microRNA吸附海绵策略,成功构建了针对miR-181a的吸附海绵载体pEGFP-C2-181a-SP,并在人源HepG2肝癌细胞中表达,且转染pEGFP-C2-181a-SP载体至葡萄糖胺诱导胰岛素抵抗HepG2细胞中24h后,可显著降低HepG2细胞内源性成熟miR-181a的表达。并通过检测胰岛素通路应答marker即磷酸化的AKT(pAKT)表达变化显示转染pEGFP-C2-181a-SP吸附海绵载体后与对照组相比,pAKT蛋白水平显著升高,提示胰岛素敏感性增强。
胰岛素抵抗是糖尿病发生发展的关键因素,主要指机体对一定量胰岛素的生物效应减低。胰岛素的主要效应器官是肝、骨骼肌和脂肪细胞,当这些器官对胰岛素的敏感性和反应性降低时,即出现胰岛素抵抗。microRNAs是葡萄糖动态平衡的调节器。研究表明,miRNAs直接调控胰岛素分泌、胰岛发育、胰岛B细胞分化,间接调控葡萄糖和脂类代谢[4]。miR-181家族包括miR-18a、miR-181b、miR-181c和miR-181d。在以往的研究中多关注miR-181a在细胞的增殖、发育和分化过程中起着重要的调控作用。而近年来在机体能量代谢异常组织中发现miR-181a呈异常高表达,提示其在代谢性疾病中的重要作用[6]。miR-181a可以通过直接作用于异柠檬酸脱氢酶1(IDH1)的3'UTR,抑制其表达,从而抑制高脂饮食小鼠的脂质及固醇合成,促进脂肪酸氧化[7]。此外有研究发现,在db/db2型糖尿病小鼠模型中,miR-181a呈高表达,提示其可能参与了机体的胰岛素应答[8]。我们的实验发现吸附海绵载体pEGFP-C2-181a-SP可以与成熟的miR-181a特异性结合,抑制其在肝细胞表达,增强了胰岛素敏感性,表明miR-181a在肝细胞的胰岛素应答中有重要作用,而肝细胞是胰岛素抵抗的主要效应器官。
干涉microRNA的表达及功能已经成为一项成熟技术。我们可人为地改变miRNA 的合成及功能,使机体内异常的miRNA 水平得以纠正,从而改善患者的胰岛功能,缓解胰岛素抵抗。microRNA的干涉是研究某一目的microRNA生理功能的主要手段,目前针对microRNA的干涉主要有三种办法,即基因敲除,针对目的microRNA的化学修饰反义寡核苷酸抑制剂以及microRNA吸附海绵载体[5]。其中,基因敲除是唯一完全抑制目的microRNA活性的方法,但此法耗时且成本大;而化学修饰反义寡核苷酸抑制剂则有良好的特异性,但其作用发挥需依赖转染手段,对于难转染的细胞其作用有限,尤其是在体内实验中用量大且成本较高。microRNA吸附海绵载体则是利用microRNA的“种子序列”,通过互补识别使细胞内源性的成熟microRNA结合到该载体上,从而抑制目的microRNA的活性。此法设计操作较便捷,还可将其包装于病毒内,应用于体内实验,成本较低。我们的实验成功构建了针对microRNA-181a的吸附海绵载体pEGFP-C2-181a-SP,该miR-181a吸附海绵亦可显著抑制外源性miR-181a mimics的活性,进一步证明此吸附海绵对miR-181a的特异性诱骗吸附能力。且该miR-181a吸附海绵片段还可克隆入慢病毒载体中,有望实现在细胞内对miR-181a的稳定长期抑制效果。
miRNA对糖尿病的作用机制复杂, 目前仍有很多问题需要探讨。最近关于miRNA拮抗剂在体内结合miRNA的研究已成为目前miRNA研究的热点, 本文构建的吸附海绵载体pEGFP-C2-181a-SP作为miR-181a的拮抗剂在2型糖尿病中进一步研究miR-181a的功能奠定了基础,其可能为糖尿病及其并发症提供新的治疗方法。
参考文献
[1]Kahn S E, Cooper M E, Del Prato S. Pathophysiology and treatment of type 2 diabetes: Perspectives on the past, present, and future [J]. Lancet, 2014, 383(9922): 1068-83.
[2]Morley T S, Xia J Y, Scherer P E. Selective enhancement of insulin sensitivity in the mature adipocyte is sufficient for systemic metabolic improvements [J]. Nature communications, 2015, 6:7906.
[3]Kadamkode V, Banerjee G. Micro RNA: An epigenetic regulator of type 2 diabetes [J]. MicroRNA, 2014, 3(2): 86-97.
[4]He A,Zhu L,Gupta N,etal. Overexpression of micro ribonucleicacid 29,highly upregulated in diabetic rats,leads to insulin resistance in 3T3-L1 adipocytes[J]. Mol Endocrinol,2007,21( 11) : 2785-2794.
[5]Ebert M S, Sharp P A. MicroRNA sponges: progress and possibILities [J]. Rna, 2010, 16(11): 2043-50.8 Gauth ier BR, W o llhe im CB. M icroRNAs: ribo- regulators of glucose hom eostasis[J]. Nat Med, 2006, 12B:36- 38.
[6]Shukla U, Tumma N, Gratsch T,etal. insights into insulin-mediated regulation of CYP2E1: miR-132/-212 targeting of CYP2E1 and role of phosphatidylinositol 3-kinase, Akt (protein kinase B), mammalian target of rapamycin signaling in regulating miR-132/-212 and miR-122/-181a expression in primary cultured rat hepatocytes [J]. Drug Metabolism and Disposition: The Biological Fate of Chemicals, 2013, 41(10): 1769-77.
[7]Chu B, Wu T, Miao L,etal. MiR-181a regulates lipid metabolism via IDH1 [J]. Scientific Reports, 2015,5:8801.
[8]Zhou B, Li C, Qi W,etal. Downregulation of miR-181a upregulates sirtuin-1 (SiRT1) and improves hepatic insulin sensitivity [J]. Diabetologia, 2012, 55(7): 2032-43.
(收稿:2015-10-15)
通讯作者△
【中图分类号】R392.6
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.07.04

