山杏初代培养影响因素研究
刘晓光,徐岩岩,刘 璐,杨晓歌
(1.河北民族师范学院 化学系,河北 承德 067000;2.北京工业大学 生命科学与生物工程学院,北京 朝阳 100124)
山杏初代培养影响因素研究
刘晓光1,徐岩岩1,刘 璐1,杨晓歌2
(1.河北民族师范学院 化学系,河北 承德 067000;2.北京工业大学 生命科学与生物工程学院,北京 朝阳 100124)
以山杏幼嫩茎尖为外植体,研究在75%的酒精及75%酒精和升汞不同处理时间下,茎尖的污染率和成活率,以及不同植物生长调节剂配比下的诱导率和生长情况。结果表明,使用75%酒精(20 s)+0.1% HgC12(3 min)处理山杏外植体成活率最高;6-B A可有效促进外植体的萌发,1.2mg·L-1时萌发率最高。6-B A 1.2mg·L-1与不同浓度的生长素IBA和NAA组合,可促进外植体的萌发生长,萌发率最高为94.16%。山杏茎尖外植体初代培养最适宜的培养基为MS+6-B A1.2mg·L-1+I B A1.0mg·L-1。
山杏;灭菌时间;植物生长调节剂;初代培养
文献著录格式:刘晓光,徐岩岩,刘璐,等.山杏初代培养影响因素研究[J].浙江农业科学,2016,57(1):84-86.
山杏(Prunus sibiric)为蔷薇科杏属灌木或小乔木,主要分布在黑龙江、内蒙古、河北等地区,是造林绿化的先锋树种,具有优良的水土保持和防风固沙功能,同时山杏具有很高的经济价值和药用价值。目前山杏栽培中的难题是优良品种的利用,利用组织培养快速繁殖可获得大量与母株性状一致的无性系组培苗。本研究以山杏幼嫩茎尖为外植体,用酒精和升汞灭菌处理,探索出最适合的灭菌时间,筛选出适合山杏外植体灭菌的流程;探究6-BA浓度及与IBA和NAA浓度组合对初代培养的影响,筛选出适宜的培养基,为山杏工厂化育苗提供参考。
1 材料与方法
1.1 材料
以山杏的幼嫩茎尖作为外植体,2014年7月采自承德市冯营子镇野生山杏林。
1.2 方法
1.2.1 材料预处理
将采集后的幼嫩茎尖,剪去多余带有木质部的枝条,剩下的茎段具有嫩叶且长度为2~3 cm,先用清水冲洗2~3次,再用流水冲洗30 min,然后将其放置在超净台上备用。
1.2.2 灭菌方式
酒精灭菌方法。选取冲洗好的外植体分别用以下5种方法进行灭菌:质量分数75%酒精浸泡5 s;质量分数75%酒精浸泡10 s;质量分数75%酒精浸泡15 s;质量分数75%酒精浸泡20 s;质量分数75%酒精浸泡30s。灭菌后,分别用无菌水冲洗3次,然后将幼嫩茎尖的叶和多余的茎段切取,接种到MS培养基上。每个处理接种30株,重复3次。接种8 d后统计污染率、死亡率、存活率、生长情况。
升汞灭菌方法。选取山杏幼嫩茎尖作为外植体,在流水下冲洗30 min,用最适酒精灭菌时间进行处理后,无菌水冲洗3次,再用0.1%升汞进行灭菌处理。灭菌时间处理分别为:0.1% HgC12浸泡 1 min、0.1%HgC12浸泡 3min、0.1%HgC12浸泡5 min、0.1%HgC12浸泡7 min;随后无菌水冲洗5次,将幼嫩茎尖接种在MS培养基中。每处理接种30株山杏外植体,重复3次。20 d后统计污染率、死亡率、存活率、侧芽萌发率、生长情况。
1.2.3 培养基
6-BA基本培养基。采用M S培养基+蔗糖30 g· L-1+琼脂g·L-1。采用不同浓度6-B A进行处理,浓度梯度设为0,0.4,0.8,1.2mg·L-1,接种20 d后统计萌芽率、芽萌发天数、生长情况。
6-BA分别与IBA和NAA组合处理。在对6-B A浓度的考察基础上,将上一步所得到的最适宜的6-B A浓度分别与IBA和NAA组合处理,IBA和NAA浓度均设3个梯度:0,0.5,1.0mg·L-1。
1.2.4 培养条件
培养温度24~26℃,光照强度设为2 500~3 000 1 x,光暗周期14/8 h,空气相对湿度60%~70%,培养基的pH值5.8。
1.2.5 数据分析
在培养基中出现各种颜色的菌斑或外植体附近有黏液状和发酵泡沫状物质或培养基出现浑浊和云雾状痕迹,这些都视为污染植株。
生长情况的评价标准分3个等级:第一等级为山杏外植体叶色浓绿,长势健壮,有新芽萌发(+++);第二等级为组培苗叶色发黄,生长缓慢(++);第三等级为嫩叶或茎尖被褐化,茎段是绿色(+)。
外植体出现白化现象,不再生长,整株组培苗全部严重褐化,无生命迹象视为死亡。
用Exce1和SPSS进行数据处理和分析。
2 结果与分析
2.1 酒精灭菌时间对山杏外植体成活率的影响
由表1得知,75%酒精对山杏外植体进行灭菌处理,处理5~15 s,山杏外植体成活率逐渐下降,最低成活率仅50%。灭菌处理20 s时成活率达到最高,为 93.3%。灭菌处理30 s,成活率下降,为86.7%。其原因是随着时间的延长,酒精灭菌会加大山杏茎尖细胞水分流失,导致山杏茎尖表面细胞脱水,进而降低茎尖组织生物活性,导致成活率降低[1]。灭菌 15 s山杏外植体的死亡率最高,其次是5,10 s的灭菌处理,死亡率最低的灭菌处理是20,30 s。因为短时间的灭菌处理不能杀死菌体,导致成活率下降。灭菌处理5~15 s,山杏茎尖生长健壮,嫩芽萌发,叶色浓绿。20,30 s的灭菌处理因为酒精长时间的处理,破坏了茎尖组织细胞内的生物活性,表现出叶色发黄,生长缓慢的状态,但不会导致外植体死亡。综合考虑成活率、污染率、死亡率和生长情况,用75%酒精灭菌处理20 s时效果最好。
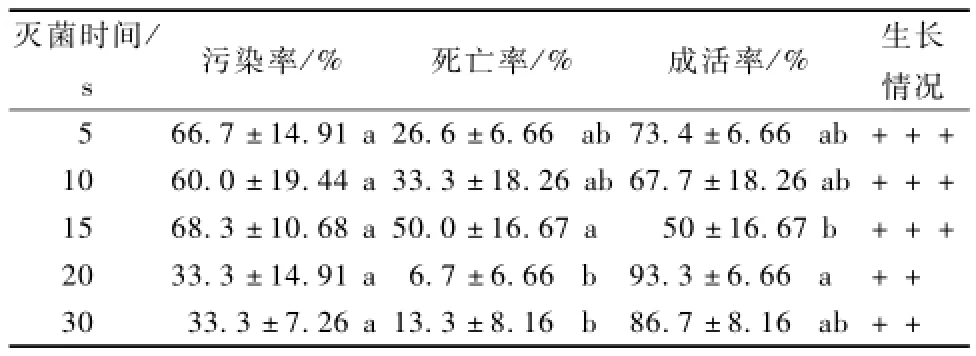
表1 酒精灭菌时间对外植体成活率的影响
2.2 升汞灭菌时间对山杏外植体成活率的影响
用75%酒精灭菌20 s后,再用0.1%升汞处理。由表2可知,灭菌处理1,3 min萌芽效果高,达26.7%;灭菌处理5,7 min萌芽率较低。灭菌处理 1 min污染率最高,达40%;处理 3,5,7 min时,外植体污染率效果不显著,污染率最低为0%。随处理时间的延长,污染率逐渐下降。山杏外植体的成活率最高的是灭菌3 min,成活率达93.3%;其次为1,5和7 min。观察中发现,用0.1%升汞灭菌处理,山杏茎尖生长状况因升汞的影响,绝大多数茎尖褐化,经过一段时间后,处理1,3 min的茎尖,生长状况发生转变,褐化部分长出新的嫩芽,叶色也转绿,但生长仍缓慢。综合考虑萌芽率、污染率、成活率、死亡率和生长情况,用0.1%升汞对山杏外植体灭菌,最佳灭菌时间为3 min。

表2 升汞灭菌时间对山杏外植体成活率的影响
2.3 6-B A浓度对山杏外植体生长的影响
在山杏初代培养基上添加不同浓度的细胞分裂素6-B A。由表3可知,6-B A浓度为0时,其萌芽率比0.4mg·L-1时的萌芽率高,但前者的萌芽天数为8 d,后者萌芽天数为4 d。空白培养基上外植体的萌发率为49.91%,芽生长缓慢,长势一般;使用6-B A处理,随着浓度的升高,腋芽的萌发率依次升高,分别为39.65%,59.73%,74.92%,其中浓度为1.2mg·L-1时萌发率最高,长势最好。综上,山杏初代培养用6-B A处理,最适宜的培养基为MS+1.2mg·L-16-B A。
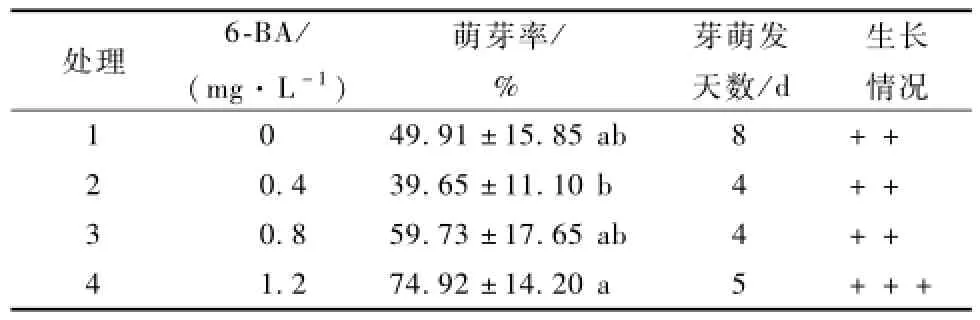
表3 6-B A浓度对山杏外植体生长的影响
2.4 6-B A与生长素共同作用对山杏初代培养的影响
在山杏初代培养基上添加1.2mg·L-16-B A与不同的生长素。
由表4可知,接种3~4 d时外植体开始萌发,N A A处理比 I B A处理的外植体萌发早。20 d后,用6-B A与I B A共同处理的外植体萌发率为86.24%,94.16%;用6-B A与N A A共同处理的外植体萌发率为83.43%和83.8%,各处理间差异不显著。4组处理中外植体均长势良好,30 d时腋芽伸长生长明显且部分出现增殖的现象。综上,山杏初代培养最适宜的培养基为MS+6-B A1.2mg· L-1+I B A1.0mg·L-1。
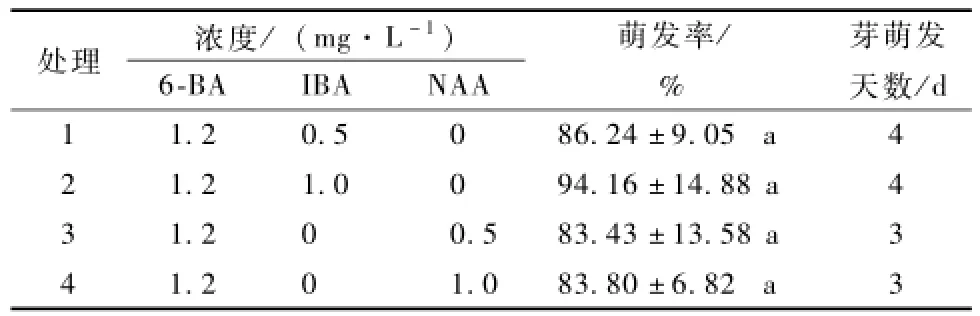
表4 6-B A与生长素共同作用对山杏初代培养的影响
3 小结与讨论
本研究以山杏幼嫩茎尖为植株材料,研究了不同灭菌时间对山杏外植体成活率的影响。结果表明,用75%的酒精(20 s)+0.1%HgC12(3 min)成活率最高。对山杏外植体进行初代培养时,最适宜的培养基为M S+6-B A1.2mg·L-1+I B A1.0mg·L-1,试验结果各项指标均优于郑可等[2]的研究。
外植体是进行组培时从植物体上切取下来的组织或器官[3],通常采用75%酒精和0.1%升汞交叉对外植体进行灭菌[4-5]。本试验得到的结果与齐高强等[6]和郭晖[7]的研究有所不同,用升汞灭菌的时间缩短1倍,但成活率仍能够达到93%以上。山杏茎尖培养芽的分化多以MS培养基为基本培养基[5]。本试验得到的最佳植物生长调节剂浓度较其他学者[7-9]研究略高。有研究表明,夏季气温较高,各类菌的活跃程度较高,污染率也高[10]。但山杏的新梢萌发快,只定于3-5月份采样处理,时间短且任务重。虽本次试验的采样时间在7月份,但试验结果表明,经处理后的山杏茎尖的成活率、萌发率较高,生长状况良好。因此,为山杏外植体的培养延长了采样时间,更能够应用于实际生产。
[1]苗玉青,李冠,吴松林,等.薄皮核桃组织培养与快速繁殖[J].新疆农业科学,2010,47(3):503-507.
[2]郑可,董胜君,田明芳,等.山杏组培繁殖技术[J].北方园艺,2013(3):115-118.
[3]李静,王云德.西伯利亚百合鳞片组织培养与快速繁殖[J].生物学通报,2012,47(4):56-58.
[4]李建民,文清成,吕守城,等.大岩桐的组培快繁及其产业化技术研究[J].北方园艺,2011(4):153-154.
[5]朱广廉.植物组织培养中的外植体灭菌[J].植物生理学通讯,1996,32(6):444-449.
[6]齐高强,赵忠,张存旭,等.大扁杏组培基本培养基与培养条件的优化研究[J].西北农林科技大学学报,2006,34(3):115-118.
[7]郭晖.大扁杏离体组织茎芽分化诱导试验[J].平原大学学报,2007,8(4):122-125.
[8]田毅,王艳,赵宇瑛.凯特杏愈伤组织的诱导[J].现代农业科技,2006(9):10-13.
[9]杜雪玲,余如刚,宋运贤,等.“巴斗杏”组培快繁体系建立与耐盐植株筛选[J].亚热带植物科学,2011,40(2):34-38.
[10]马琳,何丽娜,姜岩,等.锯叶班克木外植体的选择及消毒方法的研究[J].中南林业科技大学学报,2011,31(12):134-137.
(责任编辑:张瑞麟)
S665.1
A
0528-9017(2016)01-0084-03
10.16178/j.issn.0528-9017.20160132
2015-11-04
承德市财政局项目(CZ2014004)
刘晓光(1980-),女,河北石家庄人,博士,讲师,从事野生植物资源开发与利用方面的研究,E-mai1:zaosy126@126.com。

