阿司匹林通过促进海马功能性神经再生改善颞叶癫痫慢性期小鼠的空间记忆能力
朱 坤,胡 明,,杨蓬勃,张建水,陈新林,,刘建新
(西安交通大学医学部基础医学院:1. 神经生物学研究所;2. 人体解剖与组织胚胎学系,陕西西安 710061)
◇基础研究◇
阿司匹林通过促进海马功能性神经再生改善颞叶癫痫慢性期小鼠的空间记忆能力
朱坤1,胡明1,2,杨蓬勃2,张建水2,陈新林1,2,刘建新1
(西安交通大学医学部基础医学院:1. 神经生物学研究所;2. 人体解剖与组织胚胎学系,陕西西安710061)
目的评估阿司匹林(aspirin)通过抑制脑内炎症反应对颞叶癫痫(TLE)慢性期小鼠空间学习记忆能力的影响,并从海马神经再生角度初探其机制。方法匹鲁卡品(pilocarpine)制作小鼠TLE模型,在慢性期分别腹腔注射不同剂量阿司匹林(20、60、80 mg/kg)或同体积生理盐水,用Western blot和ELISA检测海马环氧化物酶-2(COX-2)和前列腺素E2(PGE2)变化,Morris水迷宫实验评估动物的空间学习记忆能力并观察海马神经元C-fos表达变化,BrdU+C-fos免疫荧光双标染色观察齿状回新生细胞的功能整合。重复测量(repeated measures)ANOVA比较各组水迷宫潜伏期,One-way ANOVA方法分析各组染色阳性细胞计数结果。结果腹腔注射60、80 mg/kg阿司匹林可以明显降低海马COX-2和PGE2的表达(P<0.01)。与正常同龄对照组比较,TLE慢性期动物在Morris水迷宫任务中的表现明显下降,而与生理盐水注射模型组比较,阿司匹林治疗组明显缩短了定位航行实验第3~5天的潜伏期并提高了空间探索实验中穿越目的象限的时间比例 (P<0.01)。BrdU+C-fos免疫荧光染色结果显示阿司匹林组动物齿状回双标细胞数量较生理盐水注射组明显增多(P<0.01)。结论阿司匹林可以改善TLE慢性期小鼠空间记忆能力。通过抑制脑内炎症反应、改善齿状回微环境,促进海马功能性神经再生可能是阿司匹林的治疗作用机制之一。
阿司匹林;颞叶癫痫;海马;神经再生;学习记忆;环氧化物酶-2(COX-2);前列腺素E2(PGE2)
脑内炎症反应参与癫痫相关脑区(如海马)的高兴奋性和自发性反复性癫痫发作(spontaneous recurrent seizures, SRSs)[1],抑制脑内炎症反应已渐成为癫痫治疗的新策略。环氧化物酶-2(cyclooxygenase-2, COX-2)是介导癫痫后脑内炎症反应的重要信号路径,将花生四烯酸转变成前列腺素,而后者作为炎症介质介导一系列炎症反应[2]。已有研究证明COX-2抑制剂可以减轻癫痫慢性期海马细胞丢失、胶质化和苔藓纤维芽发等病理变化,并有效改善SRSs[3]。空间认知障碍是颞叶癫痫(TLE)慢性期另一个较为严重的症状[4],尚无研究报道TLE慢性期阻断COX-2对认知障碍的影响。阿司匹林是COX-2的阻断剂,长期应用较为安全。由于许多癫痫患者同时伴有心血管或其他系统疾病,也在长期使用阿司匹林,因此,研究这一药物对TLE慢性期海马等相关脑区的病理发展和疾病转归的影响具有实际的临床意义。本研究应用匹鲁卡品(pilocarpine)诱导小鼠TLE模型,应用行为学和形态学方法研究在疾病慢性期应用阿司匹林对癫痫动物空间记忆障碍的影响,并从海马神经再生角度初步探究其可能的机制。
1 材料与方法
1.1动物雌性昆明小鼠购自西安交通大学医学部医学实验动物中心,所有实验经过西安交通大学医学部生物医学伦理委员会审批。在满足研究要求的条件下,尽量减轻动物痛苦和减少实验动物数量。
1.2模型制作与视频监测25~30 g雌性昆明小鼠,在安静、较暗的动物实验室进行诱导。诱导前30 min皮下注射硝酸甲基东莨菪碱基1 mg/kg(0.025 mg/mL)(Catalog No.S2250, Sigma, USA)以减轻匹鲁卡品对周围神经的损害;匹鲁卡品 300 mg/kg(75 mg/mL)(Catalog No. P6503, Sigma, USA)腹腔注射,5 min后给予声音、提尾等轻微刺激,绝大多数动物进入癫痫持续状态(status epilepticus, SE)。为观察慢性期癫痫发作,鼠笼上架设高清存储式摄像头,实验动物(3只/笼)在癫痫持续状态后2月接受为期2周、每天24 h的视频监测。分析视频资料,剔除无自发性反复癫痫发作的动物。
1.3动物分组及给药方法动物分为正常同龄对照组、癫痫+生理盐水组(TLE生理盐水组)、癫痫+阿司匹林组(TLE阿司匹林组,共设3个质量浓度,即20、60、80 mg/kg)。阿司匹林(Catalog No.A2093, Sigma, USA)溶于生理盐水(室温下搅拌2 h),配制成质量浓度为3.3 g/L。SE后3月开始分别腹腔注射阿司匹林或等量生理盐水,每日1次。每组每个处死时间点为6只动物。
1.4Western blot分析COX-2蛋白水平各组注射10周后,水合氯醛(0.4 g/kg)麻醉动物,冰上取出两侧完整海马组织。RIPA裂解液裂解、超声破碎提取蛋白,进行聚丙烯酰胺凝胶电泳并电转到PVDF膜,50 g/L脱脂奶粉室温封闭4 h,加入兔抗COX-2(1∶1 000, Catalog No.12282, Cell Signal Technology, USA)一抗孵育液4 ℃过夜孵育。洗涤后用辣根过氧化物酶标记的抗兔IgG(1∶2 000, Catalog No.31460, Pirece Biotechnology, USA)孵育液室温孵育2 h。洗涤后加入化学发光底物(Catalog No.JPC001, Genshare Biological, China)。将PVDF膜在暗室中曝光,显影。将胶片上的条带在凝胶成像仪中(Syngene, Cambridge, UK)进行图像分析。内参选用β-actin。
1.5ELISA分析PGE2蛋白水平按照小鼠前列腺素E2(prostaglandin E2, PGE2)酶联免疫分析试剂盒(Catalog No.ml028719,上海酶联生物科技公司)进行操作。将5倍稀释的海马组织悬液50 μL和标准样加入固相包被有兔抗小鼠PGE2抗体的48孔板,37 ℃孵育30 min。洗涤5次后加入辣根过氧化物酶标记的IgG,洗涤后加入100 μL显色液进行显色。分光光度仪测量吸光度A值,绘制标准曲线并计算样本的PGE2含量。
1.6Morris水迷宫实验Morris水迷宫系统由1个圆柱形金属泳池(直径120 cm,深度60 cm)和其上方的高清摄像头及连接的图像分析系统构成。泳池外表涂以黑色无毒漆。水深40 cm,水温(20±2)℃。在定向航行学习训练中,将泳池平分为4个象限,将直径10 cm的透明平台隐匿在其中1个象限水面下5 cm。动物随机由4个不同象限入水。从入水到找到隐匿平台的时间记录为潜伏期。如动物在60 s内未能找到,则将动物沿水面缓慢拖到平台并允许站立10 s,潜伏期记录为60 s。定向航行训练共进行5 d,每天上下午各1次,每次每只动物随机从4个象限分别入水。图像记录分析系统记录动物的潜伏期、游泳速度和游泳轨迹。在第6天的空间探索实验中,将隐匿平台去掉,动物随机从4个象限分别入水,记录分析动物60 s内在目标象限(定向航行训练中隐匿平台象限)停留时间的比例。
1.75-溴脱氧尿嘧啶核苷(5-bromo-2-deoxy uridine, BrdU)标记及BrdU+C-fos免疫荧光双标染色阿司匹林注射4周后进行BrdU标记。一次性腹腔注射BrdU(Catalog No.B5002, Sigma, USA),剂量为150 mg/kg。BrdU标记后6周,水合氯醛(0.4 g/kg)麻醉动物。分别用0.1 mol/L PBS缓冲液和40 g/L多聚甲醛(0.1 mol/L PB缓冲液溶解)固定液灌注动物,取脑,后固定3 h, 300 g/L蔗糖溶液中4 ℃过夜。恒温冰冻切片机(Slee Technik, Mainz, Germany)切取40 μm厚含全长背侧海马的冠状脑片(前囟后2.80~4.52 mm),每次连续切取5张,依次放入装有0.1 mol/L PBS的10个板孔内,反复上述操作,最终每个板孔内包含6~8片间隔200 μm的背侧海马脑片。
每只动物取出1个板孔内的脑片,0.1 mol/L PBS洗涤3次,浸入2 mol/L HCl 在37 ℃水浴箱内变性30 min;洗涤后用小鼠抗BrdU(1∶300, Catalog No. VP-B209, Vector, USA)和兔抗C-fos(1∶1 500, Catalog No.2250, Sigma, USA)混合一抗溶液(用加入3 mL/L的Triton和10 mL/L的山羊血清的0.1 mol/L PBS配制)孵育,4 ℃过夜;0.1 mol/L PBS洗涤3次,用Cy3标记的山羊抗小鼠IgG(1∶200, Catalog No.0311, ZSGB-Bio, China)和FITC标记的山羊抗兔IgG(1∶200, Catalog No.0313, ZSGB-Bio, China)二抗混合液室温孵育2 h,0.1 mol/L PBS洗涤3次,锚定、封片,激光共聚焦显微镜(TCS, Sp2, Leica, Germany)观察并计数免疫荧光染色细胞。每组6只动物,每只计数6~8张脑片(连续切片,每间隔5张取1张)SGZ-GCL区域全部BrdU+C-fos或BrdU免疫阳性细胞数量。所得细胞数量×5计算得出各区域所含免疫阳性细胞数量绝对值。
1.8统计分析计量资料以均数±标准差表示,用GraphPad Prism 4软件进行数据分析。细胞计数、Western blot和ELISA结果采用One-way ANOVA进行多组间比较,其后再采用Newman-keuls方法进行两两比较。Morris水迷宫定向航行实验潜伏期采用Repeated Measures ANOVA进行分析,空间探索实验穿越目的象限时间比采用One-way ANOVA进行多组间比较,其后再采用Newman-keuls方法进行两两比较。以P<0.05为差异具有统计学意义。
2 结 果
2.1匹鲁卡品诱导SE的行为学表现匹鲁卡品诱导的行为学变化包括起始的肌肉紧张,尾部翘起,发展到四肢肌肉痉挛,剧烈跳动、摔倒,最后维持在头颈部肌肉抽动,持续快速点头的状态。自腹腔注射匹鲁卡品到动物出现连续无中断发作的时间为(15.6±6.4)min,持续时间为(7.4±1.4)h。32只动物接受视频监测,其中29只动物出现自发性反复性癫痫发作,发作频率为(1.78±0.9)次/24 h,单次持续时间为(9.0±6.4)s。生理盐水注射动物无异常行为学改变。
2.2Western blot检测各组海马COX-2的表达变化正常对照和阿司匹林不同剂量组之间海马COX-2表达有差异(F(5,26)=11.20,P=0.000);TLE慢性期注射生理盐水组较正常同龄对照组增高(P<0.01);60、80 mg/kg的阿司匹林注射组较生理盐水组降低(P<0.01);20 mg/kg阿司匹林组COX-2水平和生理盐水注射组之间差异无统计学意义(P>0.05。图1A、1B、1C)。
2.3ELISA检测海马PGE2的水平变化各实验组间海马PGE2蛋白水平有差异(F(5,26)=34.20,P=0.001)。TLE慢性期注射生理盐水组海马PGE2水平较正常同龄对照组明显增高;60、80 mg/kg的阿司匹林组较生理盐水组明显降低(P<0.01);20 mg/kg阿司匹林组与生理盐水注射组之间差异无统计学意义(P>0.05。图1D)。根据阿司匹林对COX-2和PGE2的抑制效果,后续实验选用阿司匹林的剂量为60 mg/kg。
2.4Morris水迷宫实验结果在定向航行实验中,训练的前2 d正常对照组、生理盐水组和阿司匹林组潜伏期差异无统计学意义;在后3 d的实验中,生理盐水组潜伏期较正常同龄对照组明显延长(P<0.05),而60 mg/kg阿司匹林组潜伏期较生理盐水组缩短(P<0.05);在第5天的空间探索实验中,生理盐水组在60 s内穿越目的象限的时间比例较正常同龄对照组降低(P<0.01),而60 mg/kg阿司匹林组动物穿越目的象限的时间比例较生理盐水组提高(P<0.01);Morris水迷宫实验中各组动物的平均游泳速度差异无统计学意义(P>0.05。图2)。
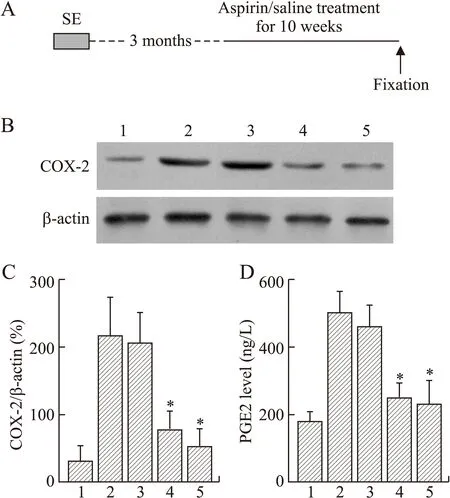
图1颞叶癫痫慢性期应用阿司匹林对海马COX-2和PGE2的影响
Fig.1 The effects of treatment of aspirin during the chronic stage of TLE on the levels of COX-2 and PGE2 in the hippocampus
A:实验设计路线;B:Western blot检测COX-2的蛋白条带;C:Western blot检测海马COX-2的统计柱形图;D:ELISA检测海马PGE2的统计柱形图。各泳道及统计图的1~5分别为正常对照组、癫痫+生理盐水组及癫痫+阿司匹林组(20、60、80 mg/kg)。*P<0.01vs. Epilepsy+saline(n=6)。
2.5BrdU+C-fos免疫荧光双标染色结果Morris水迷宫实验后90 min,齿状回颗粒细胞层可见部分C-fos免疫阳性细胞;与正常同龄对照组动物比较,TLE慢性期生理盐水组齿状回SGZ-GCL区域BrdU+C-fos免疫双标细胞数量减少(P<0.01);60 mg/kg阿司匹林组SGZ-GCL区域BrdU+C-fos免疫双标细胞数量较生理盐水注射组增多(P<0.01);正常组、TLE生理盐水组和TLE阿司匹林组之间,SGZ-GCL区域BrdU+C-fos免疫双标细胞数量占各自BrdU免疫阳性细胞数量的比例差异无统计学意义(图3)。
3 讨 论
癫痫慢性期海马胶质化、苔藓纤维芽发和CA区细胞丢失等病理变化已基本形成,但脑内炎症反应持续存在[5]。本研究关注针对这一时期的炎症治疗时对空间认知能力障碍和海马神经再生的影响,因此,阿司匹林治疗和海马新生细胞标记选择在SE后3月(匹鲁卡品诱导小鼠SE后2月已经进入慢性期[6])进行;TLE慢性期脑内炎症反应的控制是一个较为长期的过程,故选择持续10周的阿司匹林治疗,本研究Western blot 和ELISA检测发现,阿司匹林治疗10周可以有效抑制海马COX-2和PGE2水平;由于6周龄海马新生细胞已经可以功能性整合到海马神经网络并支持学习记忆功能[7],故选择BrdU标记6周后进行新生细胞的功能整合的观察。

图2阿司匹林对TLE慢性期小鼠水迷宫实验潜伏期和穿越目的象限时间比例的影响
Fig.1 The effects of treatment of aspirin during the chronic stage of TLE on the performances of mice in Morris water maze
A:实验设计路线;B:定向航行训练潜伏期统计折线图;C:游泳速度统计折线图;D:空间探索实验穿越目的象限的时间比例统计柱形图。*P<0.01vs. Epilepsy+saline(n=6)。
研究已经发现COX-2抑制剂可以减轻Alzheimer’s病和外伤性脑损伤后的学习记忆障碍[8-9]。本研究证实60 mg/kg阿司匹林腹腔注射可以明显改善匹鲁卡品诱导的TLE慢性期小鼠在Morris水迷宫中的表现。海马齿状回新生细胞参与支持海马学习记忆功能,因此,进一步分析了阿司匹林是否可以改善TLE慢性期小鼠海马功能性神经再生。经过定向航行训练、空间探索实验可以有效激活参与空间记忆的海马神经元,这些神经

图3阿司匹林对小鼠TLE慢性期功能性海马神经再生的影响
Fig.3 The effects of treatment of aspirin during the chronic stage of TLE on functional neurogenesis in the hippocampus
A:实验设计路线;B、C:分别为生理盐水对照组、阿司匹林组BrdU+C-fos免疫荧光染色,B1~B3、C1~C3分别为B、C图中大箭头所示c细胞的分色图;D:BrdU+C-fos双标细胞计数统计柱形图;E:BrdU+C-fos双标细胞比例统计柱形图。
*P<0.01vs. Epilepsy+saline(n=6)。B、C标尺=100 μm;B1~B3、C1~C3标尺=50 μm。
元表达即早基因C-fos[9]。因此,在Morris水迷宫实验后,利用BrdU+C-fos免疫荧光染色评估了海马功能性神经再生,发现60 mg/kg阿司匹林腹腔注射明显增加匹鲁卡品诱导的TLE慢性期功能性整合的新生神经元的数量。
TLE慢性期海马神经再生活动严重下降[10],其机制尚不完全清楚。脑内持续炎症反应导致齿状回神经再生微环境的破坏可能是其中的重要原因[11],炎症反应中小胶质细胞的激活和一些炎症因子,如肿瘤坏死因子和白细胞介素等可能介导了上述神经再生微环境的破坏[12]。COX-2-PGE2是癫痫慢性期脑内炎症反应的重要路径,本研究也证实60、80 mg/kg阿司匹林腹腔注射10周明显抑制了海马COX-2和PGE2表达水平。因此,阿司匹林可能通过抑制脑内炎症反应和改善齿状回局部微环境而促进TLE慢性期小鼠海马功能性神经再生,并改善其空间记忆能力。
本研究还发现,阿司匹林治疗并没有改变齿状回BrdU+C-fos荧光双标细胞占BrdU细胞总数的比例,提示阿司匹林对海马功能性神经再生的促进作用可能并不是通过提高新生神经元的整合能力实现的。而促进新生细胞的存活,使得更多的新生神经元能够参与功能整合可能是阿司匹林促进TLE慢性期小鼠海马神经再生的途径。
本研究为阿司匹林改善TLE慢性期空间记忆能力的治疗作用提供了初步证据。下一步研究还需要系统评估阿司匹林对癫痫慢性发作、癫痫慢性期海马新生细胞的异常整合以及颗粒细胞兴奋性的影响。
[1] VEZZANI A, FRIEDMAN A, DINGLEDINE RJ. The role of inflammation in epileptogenesis[J]. Neuropharmacology, 2013, 69(2013):16-24.
[2] ROJAS A, JIANG J, GANESH T, et al. Cyclooxygenase-2 in epilepsy[J]. Epilepsia, 2014, 55(1):17-25.
[3] JUNG KH, CHU K, LEE ST, et al. Cyclooxygenase-2 inhibitor, celecoxib, inhibits the altered hippocampal neurogenesis with attenuation of spontaneous recurrent seizures following pilocarpine-induced status epilepticus[J]. Neurobiol Dis, 2006, 23(2):237-246.
[4] CASANOVA JR, NISHIMURA M, SWANN JW. The effects of early-life seizures on hippocampal dendrite development and later-life learning and memory[J]. Brain Res Bull, 2014, 103(2014):39-48.
[5] GERSHEN LD, ZANOTTI-FREGONARA P, DUSTIN IH, et al. Neuroinflammation in temporal lobe epilepsy measured using positron emission tomographic imaging of translocator protein[J]. JAMA Neurol, 2015, 72(8):882-888.
[6] LIU JX, CAO X, TANG YC, et al. CCR7, CCR8, CCR9 and CCR10 in the mouse hippocampal CA1 area and the dentate gyrus during and after pilocarpine-induced status epilepticus[J]. J Neurochem, 2007, 100(4):1072-1088.
[7] KEE N, TEIXEIRA CM, WANG AH, et al. Preferential incorporation of adult-generated granule cells into spatial memory networks in the dentate gyrus[J]. Nat Neurosci, 2007, 10(3):355-362.
[8] MELNIKOVA T, SAVONENKO A, WANG Q, et al. Cycloxygenase-2 activity promotes cognitive deficits but not increased amyloid burden in a model of Alzheimer's disease in a sex-dimorphic pattern[J]. Neuroscience, 2006, 141(3):1149-1162.
[9] GOPEZ JJ, YUE H, VASUDEVAN R, et al. Cyclooxygenase-2-specific inhibitor improves functional outcomes, provides neuroprotection, and reduces inflammation in a rat model of traumatic brain injury[J]. Neurosurgery, 2005, 56(3):590-604.
[10] HU M, ZHU K, CHEN XL, et al. Newly generated neurons at 2 months post-status epilepticus are functionally integrated into neuronal circuitry in mouse hippocampus[J]. Exp Neurol, 2015, 273(2015):273-287.
[11] EKDAHL CT, CLAASEN JH, BONDE S, et al. Inflammation is detrimental for neurogenesis in adult brain[J]. Proc Natl Acad Sci USA, 2003, 100(23):13632-13637.
[12] MONJE ML, TODA H, PALMER TD. Inflammatory blockade restores adult hippocampal neurogenesis[J]. Science, 2003, 302(5651):1760-1765.
(编辑国荣)
Aspirin attenuates cognitive deficits of chronically epileptic mice by promoting the functional integration of newly generated neurons
ZHU Kun1, HU Ming1,2, YANG Peng-bo2, ZHANG Jian-shui2, CHEN Xin-lin1,2, LIU Jian-xin1
(1. Institute of Neurobiology, 2. Department of Human Anatomy,Histology and Embryology, School of Basic Medical Sciences of Xi’an Jiaotong University Health Science Center, Xi’an 710061, China)
ObjectiveTo assess the effects of chronic administration of aspirin on the cognitive deficits and functional integration of newly generated neurons from the dentate gyrus. MethodsPilocarpine was used to induce status epilepticus (SE) in mice (TLE). At 3 months after SE, the mice were injected i.p. with either aspirin (20, 60 and 80 mg/kg) in experimental groups or saline of the same volume in the control group for 10 weeks. The protein levels of COX-2 and PGE2 in the hippocampus were detected by Western blot or enzyme linked immunosorbent assay, respectively. Morris water maze (MWM) task was employed to assess the spatial cognitive ability of the mice. The newly generated neurons that were integrated into memory circuits were visualized by detecting activation of BrdU+cells, following a recall of spatial memory test at the chronic stage of TLE. Repeated measures ANOVA or One-way ANOVA methods were used to analyze the escape latencies in MWM task or other data respectively. ResultsTen-week treatment with 60 mg/kg or 80 mg/kg of aspirin decreased significantly the levels of COX-2 and PGE2 in the hippocampus when compared with saline treatment (P<0.01). On the last three days of the place navigation test, saline-treated epileptic mice took a much longer latency than normal mice or aspirin-treated mice with the dose of 60 mg. In the spatial probe test, the mice in the saline group spent significantly less time in the target quadrant than the mice in apirin groups (P<0.01). When compared with the saline-treated mice, more double labeling cells of BrdU+C-fos in the subgranular zone-granule cell layer (SGZ-GCL) were found in the mice with 10-week aspirin treatment (P<0.01). ConclusionChronic treatment of aspirin attenuates cognitive deficits of epileptic mice. Inhibiting brain inflammation and consequently restoring functional integration in the hippocampus may partially contribute to the therapeutic effect of aspirin.
aspirin; temporal lobe epilepsy; hippocampus; neurogenesis; learning and memory; COX-2; PGE2
2016-03-15
2016-04-14
国家自然科学基金面上项目资助(No.81171232,81371427)
刘建新. E-mail: liujianxin@mail.xjtu.edu.cn
R322.8
A
10.7652/jdyxb201605002
Supported by the National Natural Science Foundation of China (No.81171232 and 81371427)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160802.1146.008.html(2016-08-02)

