不同居群大赖草醇溶蛋白分析
薛晓东,代培红,吾买尔夏提·塔汉,周桂玲
(1.新疆农业大学草业与环境科学学院,乌鲁木齐 830052;2.新疆农业大学农学院,乌鲁木齐 830052 )
不同居群大赖草醇溶蛋白分析
薛晓东1,代培红2,吾买尔夏提·塔汉1,周桂玲1
(1.新疆农业大学草业与环境科学学院,乌鲁木齐 830052;2.新疆农业大学农学院,乌鲁木齐 830052 )
【目的】研究新疆大赖草[Leymusracemosus(Lam.) Tzvel]不同居群种子醇溶蛋白,探讨大赖草种质在居群间和居群内的差异及遗传多样性。【方法】采用酸性聚丙烯酰胺凝胶电泳(A-PAGE)技术对采集到的5个居群间及居群内大赖草种子醇溶蛋白进行遗传多样性研究。【结果】5份居群间材料共分离出19条带纹,只有2条是共有带,多态率为89.47%。居群内共分离出17条谱带,7条为共同带,多态率为58.82%,小于居群间;材料间的Shannon指数范围是0.346 7~0.400 0,平均值为0.372 7。Nei-Li遗传相似系数(GS)的变异范围为1.583 7~1.738 5,平均值1.659 4。相似系数GS值变异范围是0.429~0.733,平均为0.554。进一步聚类分析表明,在GS值为0.62的水平上供试材料可聚成3个大类,生境相似的居群聚为一类,表现出一定的分布规律。【结论】大赖草种子遗传多样性在居群间差异明显,而居群内不明显。醇溶蛋白凝胶电泳可以作为指纹图谱,用于研究同一物种不同居群间及居群内的差异是可行的。
大赖草;不同居群;醇溶蛋白;遗传多样性;聚类分析
0 引 言
【研究意义】麦醇溶蛋白是麦类植物种子胚乳中的主要贮藏蛋白,其电泳图谱常被用作品种、种质及品质鉴定的标准[1-3]。醇溶蛋白因极其复杂的多态性和不受一般环境条件影响的遗传稳定性,被称为品种的生化指纹。大赖草[Leymusracemosus(Lam.) Tzvel]为禾本科小麦族植物。主要分布在新疆准噶尔盆地古尔班通古特沙漠沿额尔齐斯河两岸的沙丘上及俄罗斯东南部的一些沙漠中[4-6]。大赖草因其地上、地下生殖构件强,所以对沙丘的固定起着重要的作用。同时,它穗大、多花、秆强,并且具有抗干旱、寒冷、盐碱和多种病虫害等特点,使得国内外不少学者在小麦育种及转基因工作中对大赖草的优良种质进行了大量的应用[7-9]。【前人研究进展】目前,醇溶蛋白电泳分析应用广泛,研究发现醇溶蛋白在麦类近缘属植物的种间、种内不同来源材料间也存在着明显差异。采用此方法对沙生冰草[10]、垂穗披碱草[11]、节节麦[12]和大麦[13]等植物的遗传多样性及起源与进化的研究均有报道。【本研究切入点】采用醇溶蛋白技术对大赖草的遗传多样性研究还未见报道。研究分析新疆大赖草不同居群种子醇溶蛋白,以及其居群间和居群内的差异和多样性。【拟解决的关键问题】采用麦醇溶蛋白酸性聚丙烯酰胺凝胶电泳技术,对分布于新疆阿勒泰地区的大赖草进行居群间和居群内的分析,研究大赖草种质在居群间和居群内的差异及遗传多样性,为大赖草种质资源的开发、利用及保护提供重要的理论参考依据。
1 材料与方法
1.1 材 料
所用大赖草均分布于新疆阿勒泰地区额尔齐斯河沿岸的沙丘上,共采集了5个居群,它们是:福海县加勒合孜胡德克村(P1),哈巴河县185团拜铁禄村(P2),布尔津县喀腊幸格勒村(P3),哈巴河县阿克多尕拉克村(P4),阿勒泰市喀拉干德阔拉村(P5)。列出材料的编号、采集地及生境等。表1
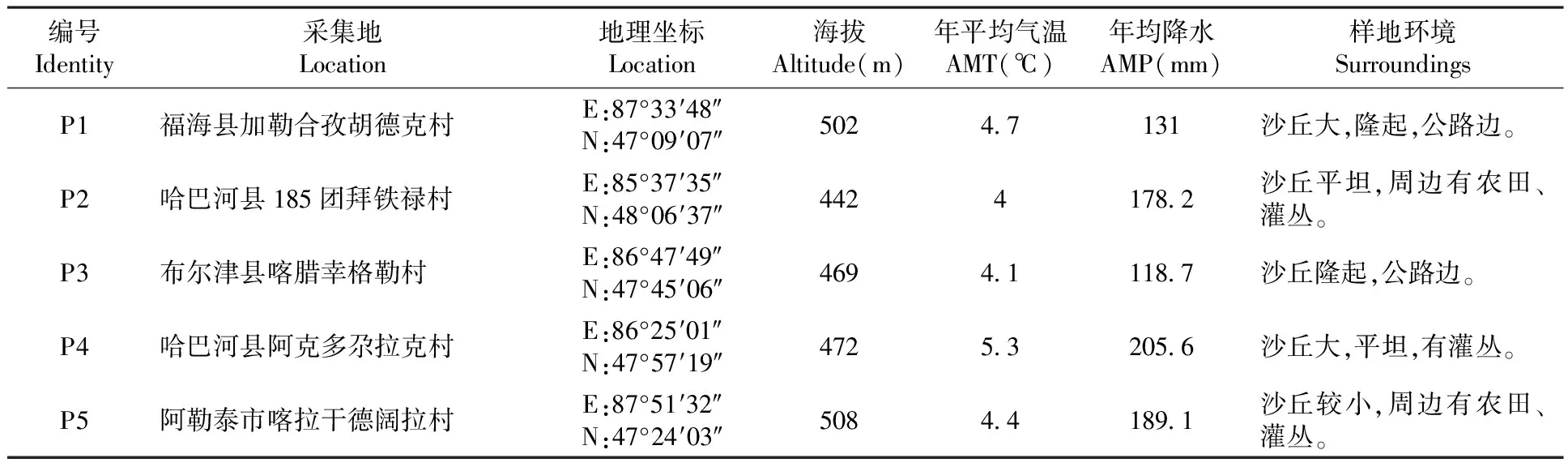
表1 供试材料采集地、编号和生境Table 1 The distribution region,serial number,habitat
1.2 方 法
1.2.1 试验设计
从以上5个居群分别采集20个相互独立(每株间隔最少15 m)成熟饱满的果穗,然后每个居群从其中随机取5个果穗上的种子进行居群间实验,每穗随机取两粒种子。居群内研究取样:选择居群4(面积大,植株多),取5个结实的果穗,每穗之间间距至少15~20 m,尤其避免采集到克隆植株。将所取种子研碎后,采用ISTA(1986)颁布的酸性聚丙烯酰胺凝胶电泳(Acid polyacrylamide gel electrophoresis,简称A-PAGE)(pH 3.1)标准程序(稍加改进)电泳分析醇溶蛋白[1,2,14]。电泳仪器为北京六一仪器厂的DYY-12型电源,电泳槽为DYCZ-24EN。具体方法参照魏秀华等[15]。
1.2.2 数据处理
参照小麦醇溶蛋白分别按迁移距离和分子量大小划分的α、β、γ、ω四个区并计算大赖草醇溶蛋白的相对迁移率。数据处理中对醇溶蛋白谱带采用“0-1”数据转换,有带记为1,无带记为0,获得数据距阵。对不同居群间的数据聚类分析利用NTSYS-pc软件按基于Nei-Li遗传相似系数(GS,即Dice系数)的不加权成对算术平均法(UPAMA)进行。按公式 GSij=2Nij/(Ni+Nj)计算(其中,Nij为材料i和j共有条带数目,Ni、Nj分别为材料i、j的条带数目)
1.2.3 计算
参照车永和等[16]及马啸等[11]的方法计算Shannon-weaver指数H和Simpson指数D(即Nei氏基因多样性指数)来估计各种质及其生态地理类群间的遗传多样性。
2 结果与分析
2.1 居群间醇溶蛋白分析
2.1.1 供试材料醇溶蛋白多态性
5个居群的种子醇溶蛋白分别用大麦和小麦两种提取剂[17]进行提取。多次试验表明,大麦提取液能更充分地提取出大赖草种子醇溶蛋白。因此,利用该提取液实验所得数据进行分析。结果表明,5个居群的醇溶蛋白共分离出19条带纹,每份材料可分离出6~15条带纹。按迁移率由大到小可分为α、β、γ、ω共4个区,带纹集中分布于ω区(6条),β区也较多(5条),α、γ区较少(各4条)。19条带纹中,仅2条是所有材料共有的,其中β和ω区各有1条,其多态率为89.47%,而α、γ区没有一条带纹是所有居群共有的,其多态率均为100%。4个区的平均带纹多态率为90.83%,平均Shannon指数为0.372 7,平均Simpson指数为1.659 4 。各电泳分区的Shannon指数H和Simpson指数D所揭示的遗传多样性的变化趋势基本一致。图1,表3
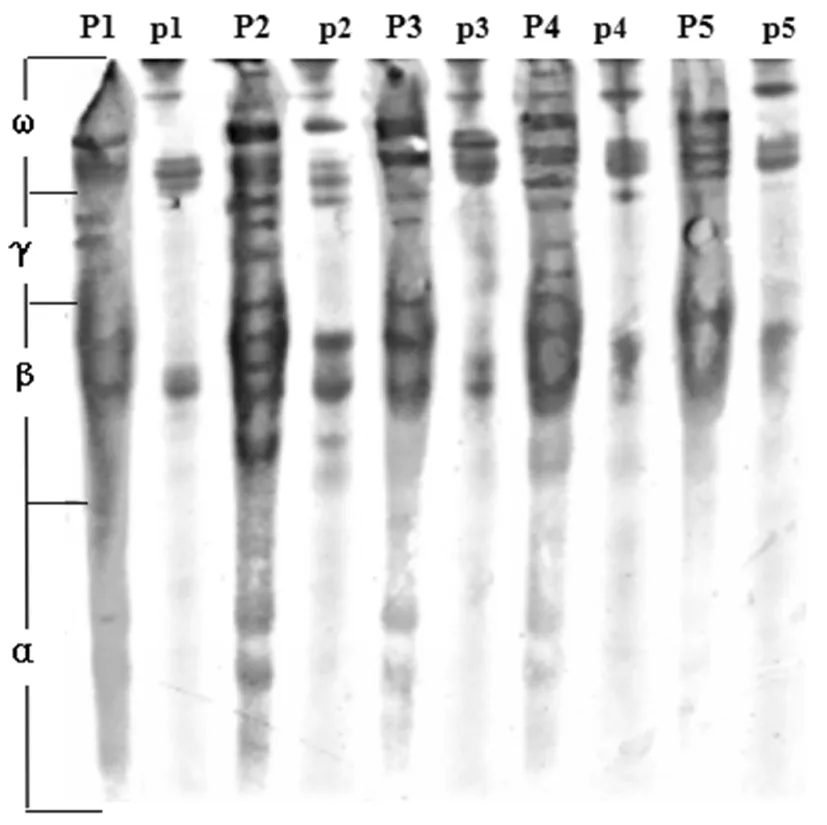
P:表示用大麦提取液,p:表示用小麦提取液
Note:P: extracting alcohol soluble protein with barley extract,p: extracting alcohol soluble protein with wheat extract
图1 5个居群大赖草材料的醇溶蛋白电泳图谱
Fig.1 Gliadin patterns of 5Leymusracemosus(Lam.) Tzvel populations A-PAGE
2.1.2 相似系数
对醇溶蛋白电泳结果采用Nei-Li相似系数(GS)的计算方法,得到供试材料相似系数矩阵。5个居群大赖草的种质GS值变异范围为0.429~0.733,平均 0.554,变幅为0.304,由相似系数矩阵可以看出,P1与P5之间遗传相似系数最小,其遗传距离最大,表明它们相互地区间材料的亲缘关系最远。而P2与P4的两份种质之间的遗传相似系数最大,其遗传距离小,表明这两份材料亲缘关系最近。以上结果进一步表明,5个居群之间差异明显,具有较为丰富的醇溶蛋白遗传多样性。表4
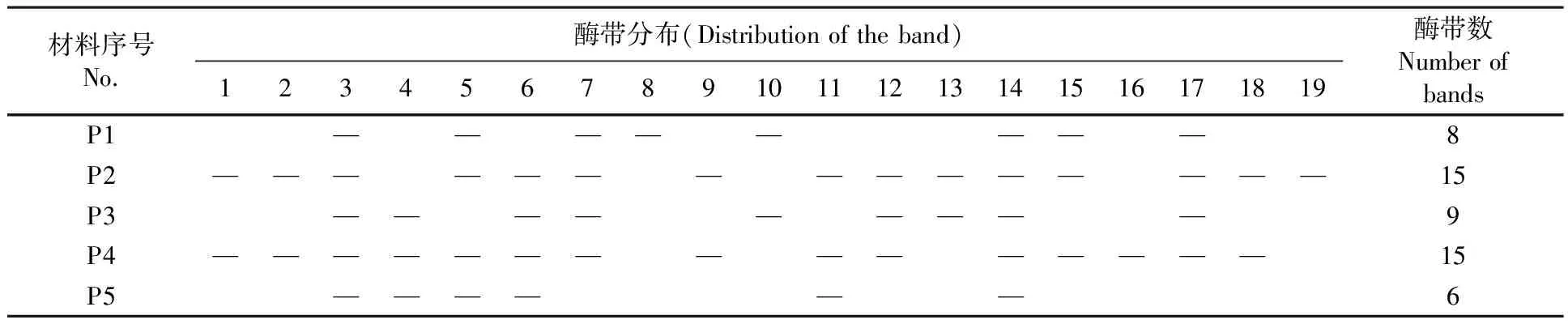
表2 5个居群大赖草材料的电泳酶带数及分布Table 2 Distribution and number of gliadin bands of 5 Leymus racemosus (Lam.)Tzvel populations
注:“—”代表酶带存在位置
Note: “—”Indicates the position of the band
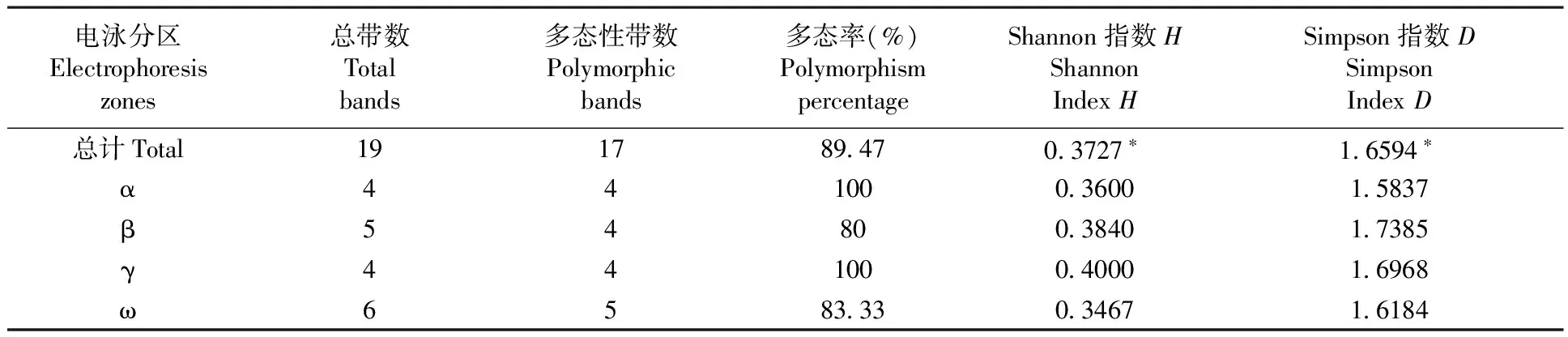
表3 5个居群大赖草的醇溶蛋白多态性Table 3 The gliadin genetic polymorphism of 5 Leymus racemosus (Lam.) Tzvel populations
注:*:α、β、γ、ω 4个区H值和D值的平均数
Note:*:Means the average numbers of Shannon index(H)and Simpson index(D) for four electrophoretic zones
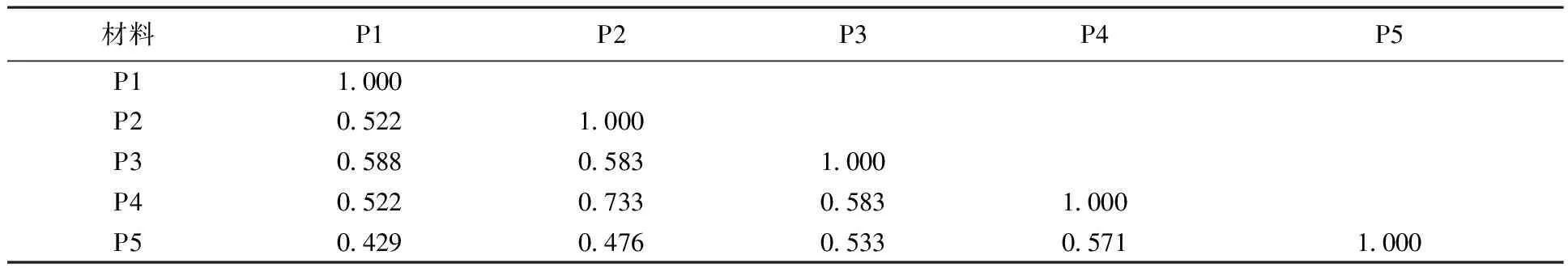
表4 大赖草5个居群间遗传相似系数Table 4 Genetic similarity coefficients of 5 Leymus racemosus (Lam.) Tzvel populations
对5个居群大赖草醇溶蛋白遗传相似系数按UPGMA法进行聚类分析。结果显示,当GS=0.62水平时,5个居群可以划分为3大类,P2与P4聚为一类;P1、P3聚为第二类;P5单独为一类。结合5个居群生境可以看出,根据供试材料的遗传相似系数得出的聚类分析结果与其地理来源有一定相关性,具有相同地理来源的材料趋向于聚在一起。图2
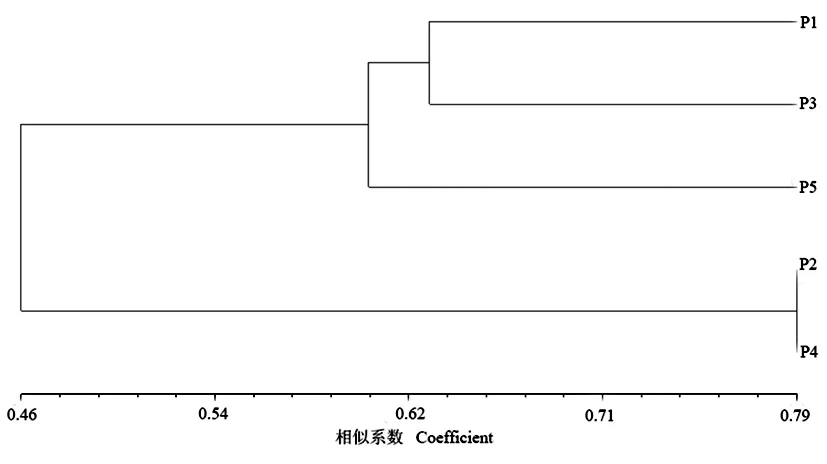
图2 5个居群大赖草醇溶蛋白数据聚类Fig.2 Dendrogram of 5 Leymus racemosus (Lam.) Tzvel populations gliadin data using Nei-Li,s genetic similarity coefficients
2.2 居群内醇溶蛋白
实验选用大麦提取液进行操作。以居群P4为研究对象,进行了居群内醇溶蛋白电泳分析,结果共得到17条谱带,可以看到,z1 所得到的条带最为清晰,共15条。图3
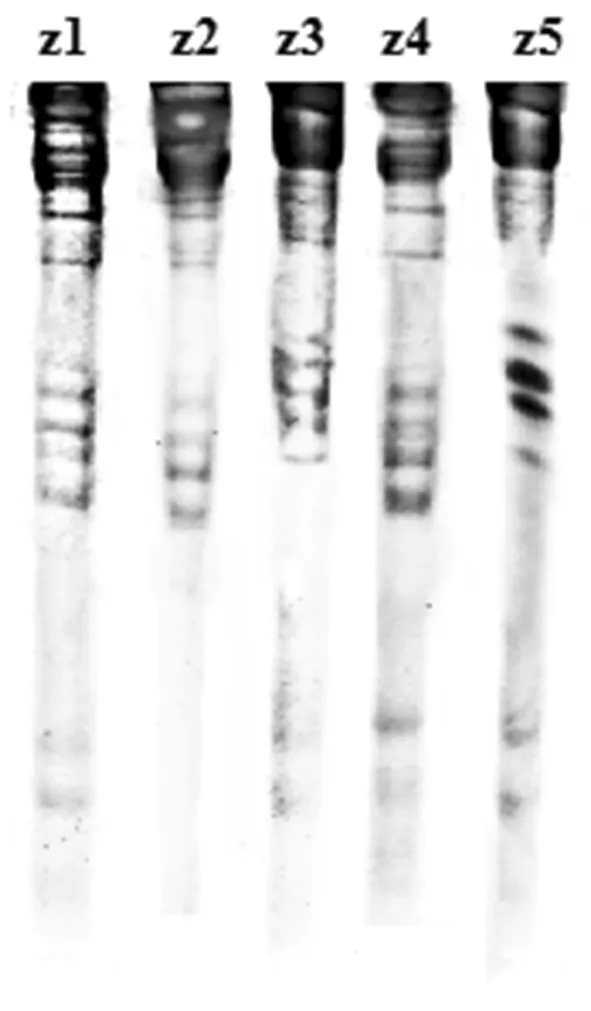
图3 大赖草居群内醇溶蛋白电泳图谱Fig.3 Gliadin patterns of Leymus racemosus(Lam.) Tzvel within population A-PAGE
另外,z2、z3及z5上部有1~2条弱带,其余材料没有,除此之外,各材料间强带几乎完全相同,共有的条带为7条,多态率为58.82%。
3 讨 论
报道显示,醇溶蛋白具有高度异质性和复杂性,使用其研究方法对于评价不同物种间以及同种不同居群间的遗传多样性具有一定的可行性[18-19]。
3.1 居群间
研究通过电泳分离出6~15条迁移率不同的醇溶蛋白带纹,只有2条是共同带,多态率为89.47%,多态性比较高。不同居群间的材料醇溶蛋白带型表现出较大的相似性,α和γ区的带纹较少,且没有一条带纹是所有材料共有的,β、ω区带纹多态性最大,分别各有一条共有条带,与马啸[11]对垂穗披碱草的分析类似。由相似系数矩阵可以看出,P1与P5之间遗传距离最大,说明它们之间亲缘关系最远。P2与P4之间遗传距离小,表明它们之间的亲缘关系最近。但是从实际距离上看,P1与P5之间相隔40 km左右,而P2与P4之间相隔有60多km之多,那么P2、P4两个居群的遗传距离大于P1与P5间的遗传距离,可以解释为环境是造成其差异的主要因素。P1与P5居群间虽然距离较近,但中间相隔了2个县级城市与一个乌伦古湖,使其成为一个屏障,阻隔了两地的基因流动;而P2与P4虽然距离较远,但二者之间是连绵的沙漠和部分农田。基因交流通畅、生境相同。
严学兵等[20]通过分子技术研究披碱草属植物遗传分化和亲缘关系的地理因素分析时得出总遗传变异的8.9%与地理距离有关,14%是由生境造成的,肯定了生境条件对披碱草属植物遗传变异的影响。马啸等[11]对野生垂穗披碱草种质的醇溶蛋白遗传多样性分析表明,醇溶蛋白图谱类型与材料的生态地理环境具有一定的相关性。
3.2 居群内
通过大赖草居群内凝胶电泳得到的电泳图与前人[21]的结果进行对比可以看出其研究结果相似,即大赖草居群内各试验材料种子蛋白电泳所获得的条带数量和位置上都比较一致,尤其是强带几乎完全相同,个别材料的差异仅表现在弱带上,与魏秀华等[15]对鹅观草属居群内的分析类似。但因凝胶的速度及浓度稍微不均导致各试验材料所得条带并不是一一对应,即迁移率大小一样的蛋白,各试验材料横向带纹在图谱上的位置并不是显示在同一个水平上,但这并不影响分析,资料记载[21]也有类似的情况。唐慧慧等[13]对“中国野生大麦醇溶蛋白遗传多态性研究”也发现,地理环境相似地区的材料有着相似的醇溶蛋白图谱类型。可以看出同一居群内种子醇溶蛋白的差异不是很大。
3.3 居群间与居群内对比
严学兵等[22]采用等位酶分析法研究了老芒麦等9个披碱草属物种40个居群的遗传多样性,结果发现每个物种居群内的遗传多样性远低于居群间,属级水平上的遗传多样性主要存在于种间和种内居群间,而且各居群的遗传距离与海拔和经纬度相关性显著。研究也发现,大赖草的居群间条带多态性(89.47%)大于居群内(58.82%),说明了居群内的遗传多样性低于居群间,环境上的差异是不同居群间遗传多样性产生的主要原因。Nevo[23]分别观察了在大、小地理尺度下自然居群的蛋白质变异,发现在大尺度地理条件下,由于生境不同阻碍了基因漂移,从而造成较大的遗传差异。
4 结 论
研究对大赖草5个居群间和居群内进行醇溶蛋白电泳图谱分析,结果显示5个居群之间条带差异明显,居群内不明显,说明醇溶蛋白凝胶电泳可以作为指纹图谱,用于研究同一物种不同居群间及居群内的差异是可行的,同时也表明,大赖草居群间及居群内都发生了遗传变异,居群间大于居群内。
References)
[1]王学路,钱曼懋,宋春华,等.改良ISTA醇溶蛋白电泳方法及其应用[J].作物品种资源,1994,(2):32-34.
WANG Xue-lu, QIAN Man-mao, SONG Chun-hua, et al. (1994). Modified ISTA Gliadin electrophoresis and its application [J].ChinaSeeds, (2):32-34. (in Chinese)
[2] Draper, S. R. (1987). Ista variety committee - report of the working group for biochemical tests for cultivar identification 1983-1986.SeedScience&Technology. (15):431-434.
[3] 傅宾孝,于光华,王乐凯,等.小麦醇溶蛋白电泳分析的新方法[J].作物学报,1993,19(2):185-187.
FU Bin-xiao, YU Guang-hua, WANG Le-kai, et al. (1993). An Improved A-PAGE Method for Analyzing Gliadin in Wheat [J].ActaAgronomicaSinica, 19(2):185-187. (in Chinese)
[4] 刘媖心.中国沙漠植物志.[M].(第一卷)北京:科学出版社,1985:105.
LIU Ying-xin. (1985).DesertfloraofChina[M].(Volumn 1)Beijing: Science Press:105. (in Chinese)
[5] 董玉琛,孙雨珍,钟干远,等.新疆阿尔泰地区大赖草的考察和初步研究[J].中国农业科学,1985,(2):54-56.
DONG Yu-chen, SUN Yu-zhen, ZHONG Gan-yuan, et al. (1985). The Explortion and Prelimcary study ofLeymusracemosus(Lam.) Tzvelev in Xinjiang Altai [J].ScientiaAgriculturaSinica, (2):54-56. (in Chinese)
[6] 崔乃然,崔大方,刘国钓,等.新疆植物志,第六卷[M].乌鲁木齐:新疆科技卫生出版社,1996:214.
CUI Nai-ran, CUI Da-fang, LIU Guo-diao, et al. (1996).FloraXinjiangensis[M]. Urumqi, Xinjiang Science&.Technology &.Hygiene Publishing House:214. (in Chinese)
[7] Mujeeb-Kazi, A., & Rodriguez, R. (1981). Intergeneric hybrid of triticum aestivum l. x elymus giganteus.JournalofHeredity. (72):253-256.
[8] 王子霞,张茂银,杨克锐,等. 新疆大赖草DNA导入小麦后代之间"聚合效应"研究[J].新疆农业科学, 2000,(6):253-256.
WANG Zi-xia, ZHANG Mao-yin, YANG Ke-rui, et al. (2000). The study on Polymerization of Progenies from Comm on Wheat Transformed by XinjingLeynusracemosus(Lam) Tzwel DNA [J].XinjiangAgriculturalSciences, (6):253-256. (in Chinese)
[9] 杨松杰,王子霞,海热古力·阿布力孜,等. 供体新疆大赖草的研究[J].新疆农业科学,1997,(6):255-256.
YANG Song-jie, WANG Zi-xia, Haireguli, et al. (1997). Donor XinjiangL.racemosusresearch[J].XinjiangAgriculturalSciences, (6):255-256. (in Chinese)
[10] 车永和,杨欣明,杨燕萍,等.沙生冰草醇溶蛋白遗传多样性研究[J].麦类作物学报, 2007,27(5):767-771.
CHE Yong-he, YANG Xin-ming, YANG Yan-ping, et al. (2007). Genetic Diversity of Prolamines in Agropyron desertorum (Fisch ex Link) Schult [J].JournalofTriticeaeCrops, 27(5):767-771. (in Chinese)
[11] 马啸,周永红,于海清,等.野生垂穗披碱草种质的醇溶蛋白遗传多样性分析[J].遗传,2006,28(6): 699-706.
MA Xiao, ZHOU Yong-hong, YU Hai-qing, et al. (2006). Genetic Diversity of Gliadin in Wild Germplasm of Elymus nutans Griseb. [J].Hereditas, 28(6):699-706. (in Chinese)
[12] 兰秀锦,魏育明,王志容,等.中国节节麦与中东节节麦的醇溶蛋白遗传多样性比较研究[J].四川农业大学学报, 1999, 17(3): 245-248.
LAN Xin-jin, WEI Yu-ming, WANG Zhi-rong, et al. (1999). Gliad in Comparison between Aegilops Tauschii Cosson from Chinensis Middle-East [J].JournalofSichuanAgriculturalUniversity, 17(3):245-248. (in Chinese)
[13] 唐慧慧,丁毅,胡耀军.中国近缘野生大麦醇溶蛋白的遗传多态性研究[J].武汉植物学研究,2002,20(4):251-257.
TANG Hui-hui, DING Yi, HU Yao-jun. (2002). Genetic Polymorphism of Hordein in Wild Relatives of Barley from China [J].JournalofWuhanBotanicalResearch, 20(4):251-257. (in Chinese)
[14] 张玉良,张晓芳.小麦醇溶蛋自电泳技术及其应用[J].作物品种资源,1994,(1):33-34.
ZHANG Yu-liang, ZHANG Xiao-fang. (1994). Since wheat gliadin protein electrophoresis technique and its application [J].CropGermplasmResources, (1):33-34. (in Chinese)
[15] 魏秀华,周永红,杨瑞武,等.鹅观草属三个物种及其居群间的醇溶蛋白分析[J].广西植物,2005,25(5):464-468.
WEI Xiu-hua, ZHOU Yong-hong, YANG Rui-wu, et al. (2005). Study on gliadin variation of three Roegneria (Poaceae: Triticeae) species and their accessions [J].Guihala, 25(5):464-468. (in Chinese)
[16] 车永和,李立会,何蓓如.冰草属(AgropyronGaertn.)植物遗传多样性取样策略基于醇溶蛋白的研究[J].植物遗传资源学报,2004,5(3):216-221.
CHE Yong-he,LI Li-hui,HE Bei-ru. (2004). Sampling Strategy for Genetic Diversity inAgropyronGaertn. Based on Gliadin [J].JournalofPlantGeneticResources, 5(3):216-221. (in Chinese)
[17] 颜启传,黄亚军,徐媛.试用ISTA推荐的种子醇溶蛋白电泳方法鉴定大麦和小麦品种[J].作物学报, 1992, 18(1): 61-68.
YAN Qi-chuan, HUANG Ya-jun, XU Yuan. (1992). Cultivar Identification of Barley and Wheat with Standard Reference Method from International Seed Testing Association (ISTA) [J].ActaAgronomicaSinica, 18(1):61-68. (in Chinese)
[18] 吴若箐,赖文胜,方炜,等.福清黑松醇溶蛋白的群体遗传分析[J].热带亚热带植物学报,2005,13(1):53 -58.
WU Ruo-jing, LAI Wen-sheng, FANG Wei, et al. (2005). Population Genetics Diversity of Gliadin of Pinus thunbergii from Fuqing [J].JournalofTropicalandSubtropicalBotany, 13(1):53 -58. (in Chinese)
[19] 鄢家俊,白史且,张新全,等.青藏高原野生老芒麦种质醇溶蛋白遗传多样性分析[J].农业生物技术学报,2009,17(5):891-901.
YAN Jia-jun, BAI Shi-qie, ZHANG Xin-quan, et al. (2009). Genetic Diversity of Gliadin in Native Elymus sibiricus from Qinghai-Tibetan Plateau in China [J].JournalofAgriculturalBiotechnology, 17(5):891-901. (in Chinese)
[20] 严学兵,郭玉霞,周禾,等.影响披碱草属植物遗传分化和亲缘关系的地理因素分析[J].植物资源与环境学报,2006,18(4):17-24.
YAN Xue-bing, GUO Yu-xia, ZHOU He, et al. (2006). Analysis of geographical conditions affected on variation and relationship among populations of Elymus [J].JournalofPlantResourcesandEnvironment, 18(4):17-24. (in Chinese)
[21] 杨瑞武,魏秀华,周永红,等.赖草属植物醇溶蛋白的遗传多态性[J].云南植物研究,2004,26(1):103-110.
YANG Rui-wu, WEI Xiu-hua, ZHOU Yong-hong, et al (2004).Genetic Polymorphism of Gliadin inLeymus[J].ActaBotanicaYunnanica, 26(1):103-110. (in Chinese)
[22] 严学兵.披碱草属植物遗传多样性研究[D].北京:中国农业大学博士论文,2005.
YAN Xue-bing. (2005).StudyofGeneticDiversityofElymusSpecies[D]. PhD Dissertation. China Agricultural University, Beijing. (in Chinese)
[23] Nevo, E., Beiles, A., Apelbaum-Elkaher, I., & Garty, J. (1997). Natural selection causes microscale allozyme diversity in wild barley and a lichen at 'evolution canyon', mt.carmel,israel.Heredity, 78(4):373-382.
Fund project:Supported by National Natural Science Foundation of China(31160134)
Study on Gliadin of Leymus racemosus (Lam.)Tzvel of Different Populations
XUE Xiao-dong1, DAI Pei-hong2, Wumaierxiati Tahan1, ZHOU Gui-ling1
(1. College of Pratacultural and Environmental Sciences,2.CollegeofAgronomy,XinjiangAgriculturalUniversity,Urumqi830052,China)
【Objective】 In order to investigate the differences and genetic diversity ofLeymusracemosusgermplasm among and within the populations,the project aims to study the seed gliadin of XinjiangLeymusracemosusbetween different populations.【Method】The genetic diversity of 5Leymusracemosuspopulations' seed gliadin were analyzed by using acid polyacrylamide gel electrophoresis(A-PAGE).【Result】(1)19 gliadin bands were separated by electrophoresis between 5 populations of them, 17 bands had polymorphisms and the polymorphic rate was 89.47%. 17 bands were isolated from populations, 10 bands had polymorphisms and the polymorphic rate was 58.82%, the polymorphism rate within populations were less than among the populations.(2)The variation's range of Shannon index between materials was 0.346,7-0.400,0, average value was 0.372,7. The variation's range of Nei-Li genetic similarity coefficient (GS) was 1.583,7-1.738,5, average value of 1.659,4.The variation's range of genetic similarity coefficient (GS) was 0.429-0.733,average value of 0.554. Further clustering analysis showed that the test materials could be clustered into 3 categories when the GS value was 0.62, and habitat similar populations could be clustered together, which also showed that it was a certain distribution between different populations.【Conclusion】The electrophoresis of the seed gliadin showed that the genetic diversity among populations was significantly different and not obvious within populations. It was explained that the electrophoresis of seed gliadin could be used as a fingerprint, and was feasible when it was used to study the differences between and within populations.
Leymusracemosus(Lam.) Tzvel; different populations; gliadin; genetic diversity; cluster analysis
10.6048/j.issn.1001-4330.2016.08.019
2016-03-21
国家自然科学基金项目(31160134)
薛晓东(1983-),男,山西大同人,硕士研究生,研究方向为植物资源学,(E-mail)414273009@qq.com
周桂玲(1957-),女,新疆乌鲁木齐人,教授,硕士生导师,研究方向为植物学,(E-mail)1820944856@qq.com
S184
A
1001-4330(2016)08-1500-07

