IBA浓度对膜荚黄芪不定根生物量、毛蕊异黄酮及毛蕊异黄酮葡萄糖苷积累的影响
李子羊,刘 佳,孙海燕,李德阳,吴松权,全雪丽*
(1.延边大学农学院,吉林 延吉133002;2.吉林省美城园林工程有限责任公司 吉林 长春 130022)
IBA浓度对膜荚黄芪不定根生物量、毛蕊异黄酮及毛蕊异黄酮葡萄糖苷积累的影响
李子羊1,刘 佳1,孙海燕1,李德阳2,吴松权1,全雪丽1*
(1.延边大学农学院,吉林 延吉133002;2.吉林省美城园林工程有限责任公司 吉林 长春 130022)
以长白山不同地区2种膜荚黄芪不定根为试材,研究了IBA浓度对膜荚黄芪不定根生物量、毛蕊异黄酮和毛蕊异黄酮葡萄糖苷含量的影响。结果表明:和龙黄芪与安图黄芪不定根生物量在培养3 d时无显著性变化,并分别在培养7 d的5 mg/L和2 mg/L IBA处理中达到峰值;2种黄芪不定根分别于培养3 d的4 mg/L和2 mg/L IBA处理中呈现了毛蕊异黄酮与毛蕊异黄酮葡萄糖苷含量的峰值。
膜荚黄芪;不定根;IBA浓度;生物量;毛蕊异黄酮;毛蕊异黄酮葡萄糖苷
黄芪,又名绵芪,为多年生草本植物,在我国主要分布于东北、华北地区[1],其味甘、性微温。现代药理学研究表明,黄芪具有保护血管、心肌,调节免疫,抗肿瘤和抗氧化等功效[2]。黄芪中主要活性成分包括黄芪皂苷、多糖、黄酮类[3]。研究表明,黄酮类是一种天然的抗氧化剂,且抗氧化水平明显高于黄芪皂苷[4]。作为一种黄酮类化合物,异黄酮通常与药材的生物活性密切相关[5]。毛蕊异黄酮与毛蕊异黄酮葡萄糖苷是黄芪根中2种主要的异黄酮成分,毛蕊异黄酮在糖基转移酶(UDP-glucose:calycosin 7-O-glucosyltransferase, UCGT)的作用下生成毛蕊异黄酮葡萄糖苷[6-7]。在市场上,药材干燥根中异黄酮类化合物的含量通常决定其价格[8]。《中国药典》2005 年版规定,黄芪药材含量的检测指标仅有黄芪甲苷,而在 2010 年版又增加了毛蕊异黄酮葡萄糖苷。因此,对黄芪中毛蕊异黄酮与毛蕊异黄酮苷的研究得到了更广泛的关注[9]。
近年来,市场上对于黄芪的需求日益增大,加之野生资源的锐减,使得只能依靠人工栽培来满足黄芪的市场供应[10]。而人工栽培黄芪又存在明显的缺点,据报道,人工栽培黄芪的总黄酮含量明显低于野生,同时周期较长,一般3~4年方可采收[11]。不定根培养技术是利用植物器官的培养技术,也是更加快捷且大量得到植物次生代谢产物的有效途径之一,具有生长周期短、病虫害发生率低、遗传背景同一和方便实用等优点[12]。目前,药用植物中人参的不定根研究相对较多,韩国在人参不定根的产业化方面取得了突破性进展;我国也对太子参、三七、红豆杉、甘草、柴胡、苍术、东北刺人参、黄芩等进行了研究[13]。Wu等[14]人于2010年建立了黄芪不定根的培养体系。本研究以长白山区2种膜荚黄芪不定根为材料研究IBA浓度对毛蕊异黄酮与毛蕊异黄酮葡萄糖苷积累的影响,为利用黄芪不定根生物合成毛蕊异黄酮与毛蕊异黄酮葡萄糖苷奠定理论基础。
1 材料与方法
1.1 材料
供试野生膜荚黄芪种子采自吉林省和龙市(海拔1 200 m)与吉林省安图县(海拔500 m)。经延边大学农学院植物学教研室石铁源教授鉴定为膜荚黄芪Astragalusmembranaceus(Fisch.) Bunge。
1.2 药品与试剂
毛蕊异黄酮(110722)和毛蕊异黄酮葡萄糖苷(110907),标准品购自上海融禾医药科技有限公司,质量分数均大于98%。乙腈为色谱纯(美国Fisher公司);水为纯净水(娃哈哈有限公司);分析用甲醇为色谱纯(美国迈瑞达科技有限公司);其他试剂均为分析纯(购于国内各公司)。
1.3 试验方法
1.3.1 膜荚黄芪不定根的诱导
选取饱满膜荚黄芪种子用自来水冲洗2 h,75% 酒精消毒45 s,无菌水漂洗3次,使用0.1%升汞消毒6 min,无菌水漂洗6次后,接种于MS+蔗糖30 g/L+琼脂8 g/L,pH值为5.8的培养基上,于(25±1) ℃,自然光照下培养,待其发芽长成完整植株,取根部新鲜组织,将其切成1 cm长的外植体,接入培养基中。不定根诱导培养基为MS+IBA 3.0 mg/L+蔗糖30 g/L ,不定根增殖培养基为B5+IBA 2.0 mg/L+蔗糖30 g/L的液体培养基,pH值为5.8,于(25 ± 2) ℃、相对湿度70%下暗培养。
1.3.2 IBA浓度对膜荚黄芪不定根生物量、毛蕊异黄酮和毛蕊异黄酮葡萄糖苷含量的影响
取0.5 g新鲜不定根组织接入B5+IBA 2.0 mg/L+蔗糖30 g/L的液体增殖培养基中,培养25 d后添加不同浓度的IBA(0、1、2、3、4、5 mg/L),继续培养3 d和 7 d后收集不定根。培养条件为(25 ± 2) ℃、相对湿度70%,暗培养。将收集的不定根在50 ℃ 下烘干至恒重,称其干物质质量,即生物量。通过高效液相色谱法测定毛蕊异黄酮与毛蕊异黄酮葡萄糖苷含量。
1.3.3 毛蕊异黄酮与毛蕊异黄酮葡萄糖苷含量的测定
参照宋成英等的方法[15]进行测定,1) 标准品溶液制备:准确称取毛蕊异黄酮葡萄糖苷标准品1 mg,加入甲醇配制质量浓度为1 mg/mL的标准品溶液,在 4 ℃冰箱中储存待用;2) 供试品溶液的配制:取烘干的膜荚黄芪不定根,研磨成粉末后精确称量 0.3 g,放入 250 mL 圆底烧瓶中,精确加入分析级甲醇 30 mL,80 ℃加热回流 4 h,经摇匀后过滤,精密量取滤液 25 mL,旋转蒸发至干,残渣加色谱级甲醇溶解至 3 mL,摇匀后经 0.45 μm 微孔滤膜过滤,封存后置于4 ℃冰箱中储存待用。每个处理重复3次;3) 标准曲线绘制: 精密吸取毛蕊异黄酮与毛蕊异黄酮葡萄糖苷标准品溶液,加入色谱级甲醇稀释为 8 个浓度梯度,在高效液相色谱仪中测其峰面积。以毛蕊异黄酮葡萄糖苷标准品的浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,计算回归方程。毛蕊异黄酮回归方程为y=119.51x-100 080.56,R2=0.999 4;毛蕊异黄酮葡萄糖苷回归方程为:y=110.58x-504 111.87,R2=0.998 8;4) 色谱条件:华谱C18色谱柱(250 mm×4.6 mm,5 μm);检测波长 230 nm;柱温为30 ℃;体积流速为0.8 mL/min;进样量20 μL;流动相为乙腈(A)和水(B),梯度洗脱程序:0~30 min,15%~55%乙腈;30~35 min,55%~100%乙腈;35~40 min,100%~15%乙腈;40~45 min,15%乙腈。
1.4 统计分析
利用SPSS 19.0 软件进行数据的统计分析。
2 结果与分析
2.1 IBA浓度对和龙黄芪不定根生物量、毛蕊异黄酮及毛蕊异黄酮葡萄糖苷的影响
由表1可见,和龙黄芪不定根在培养3 d后生物量与对照组无显著性差异,而在培养7 d时在3、4、5 mg/L IBA 浓度下观察到不定根生物量显著提高,且随着IBA浓度的增加而逐渐上升,并于5 mg/L IBA时达到峰值(1.205 g)。
不同IBA浓度对和龙黄芪不定根毛蕊异黄酮葡萄糖苷含量的影响见图1。经不同浓度IBA处理后的毛蕊异黄酮葡萄糖苷含量均显著高于对照组。表明IBA处理不定根可以增加其毛蕊异黄酮葡萄糖苷的含量。这与田海丽等[16]的研究中,IBA可以提高黄芩不定根中总黄酮含量的结果相类似。在4 mg/L IBA培养3 d时达到峰值(225 μg/g),随着IBA浓度的增加,毛蕊异黄酮葡萄糖苷的积累水平在5 mg/L处理显著低于4 mg/L处理。推测不定根在5 mg/L IBA浓度下形成激素胁迫,迫使毛蕊异黄酮葡萄糖苷含量减少。类似地,培养天数为7 d时,4 mg/L IBA处理中毛蕊异黄酮葡萄糖苷的积累量达到峰值(154 μg/g),并在IBA浓度为5 mg/L时显著下降。在4 mg/L和5 mg/L IBA浓度的处理中,和龙黄芪不定根中毛蕊异黄酮葡萄糖苷的含量显著低于3 d时。推测可能由于此时不定根的旺盛生长所致,其生物量于5 mg/L IBA浓度下达到峰值(表1)。在不同IBA浓度对和龙黄芪不定根毛蕊异黄酮的影响中,观察到了其含量类似的趋势(图2),其在不同的培养天数中均于4 mg/L达到峰值(12.8 μg/g,12.2 μg/g)。相对于毛蕊异黄酮葡萄糖苷,毛蕊异黄酮的含量呈现较低水平。这与Tuan等[7]利用茉莉酸甲酯处理黄芪毛状根,测定的毛蕊异黄酮与毛蕊异黄酮葡萄糖苷含量的结果类似。毛蕊异黄酮葡萄糖苷是毛蕊异黄酮糖基化后的产物,糖基化通常是在许多植物天然产物的生物合成最后一步,可以提高天然产物的溶解性和稳定性,并促进其在植物细胞内的存储和积累[17]。

表1 IBA浓度对和龙黄芪不定根生物量影响
注:表中不同小写英文字母代表P<0.05水平的显著性差异,下同。
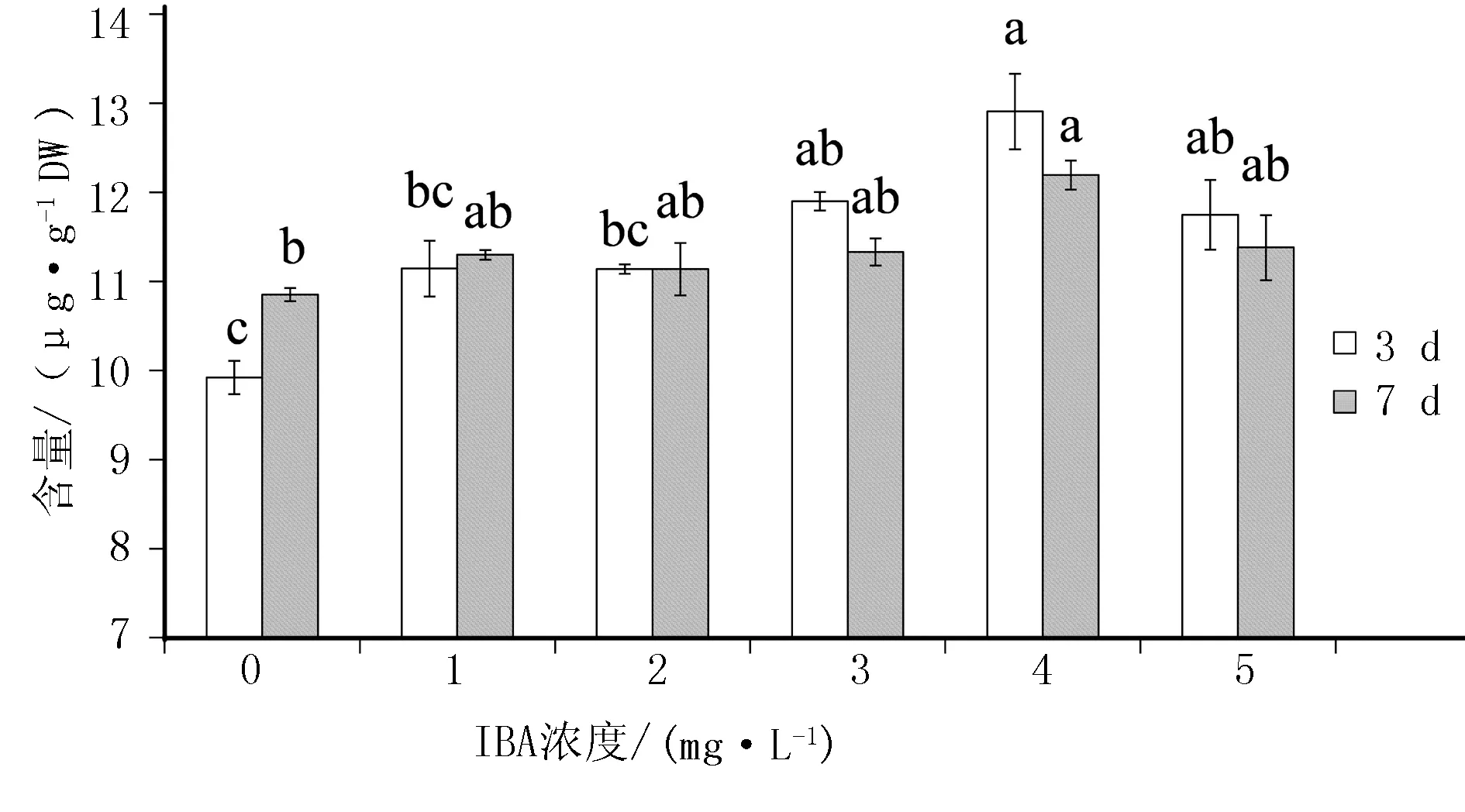
图2 IBA浓度对和龙黄芪不定根毛蕊异黄酮含量的影响
2.2 IBA浓度对安图黄芪不定根生物量、毛蕊异黄酮与毛蕊异黄酮葡萄糖苷含量的影响
由表2可知,安图黄芪不定根在培养3 d时生物量与对照组无显著性差异,这类似于和龙黄芪不定根;当培养天数达到7 d时,安图黄芪不定根生物量在IBA低浓度下(1、2 mg/L)显著增加,并在2 mg/L IBA浓度下达到峰值(1.155 g),而随IBA浓度继续增加,不定根的生物量与对照组无显著性差异。
不同IBA浓度下毛蕊异黄酮葡萄糖苷在安图黄芪不定根中的积累水平见图3。培养天数为3 d时,安图黄芪不定根中毛蕊异黄酮葡萄糖苷的含量在IBA浓度为1 mg/L时与对照组无差异,并在IBA浓度为2 mg/L处理中达到峰值(151 μg/g),此时为对照组的1.5倍;随着浓度的继续增加,毛蕊异黄酮葡萄糖苷的含量显著下降,并在5 mg/L IBA处理中显著低于对照组。在培养天数为7 d时,毛蕊异黄酮葡萄糖苷的含量随IBA浓度的增加逐渐上升。在IBA的高浓度下(4、5 mg/L),毛蕊异黄酮葡萄糖苷的积累机制与培养3 d时截然相反。表明此时不定根已逐渐适应高浓度的IBA,并随着IBA不断地消耗,其次生代谢产物的产量不断增加。毛蕊异黄酮的含量呈现较低水平(图4),其与毛蕊异黄酮葡萄糖苷的含量出现了类似的趋势,分别在3 d处理2 mg/L IBA浓度与7 d处理5 mg/L IBA浓度下达到峰值。

表2 IBA浓度对安图黄芪不定根生物量影响
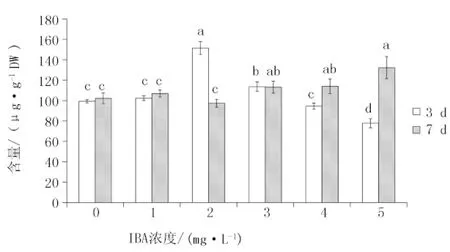
图3 IBA浓度对安图黄芪不定根毛蕊异黄酮葡萄糖苷含量的影响
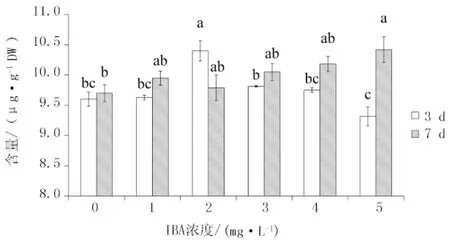
图4 IBA浓度对安图黄芪不定根毛蕊异黄酮含量的影响
3 讨论与结论
随着黄芪野生资源的锐减与市场需求的增大,黄芪人工栽培的种种缺点逐渐暴露出来[10-11]。黄芪多以根入药,因此以黄芪不定根培养技术以其周期短、病虫害率低等特点,使其成为快速且大量获得黄芪次生代谢产物的有效途径之一[12]。IBA是一种能显著提高植物插穗生根率的生长素[18],已被广泛应用于各种植物不定根的诱导。但是不同IBA浓度对于黄芪不定根的影响仍未见报道。本研究以长白山主产区不同海拔高度的2种黄芪为原材料诱导不定根,探究IBA对不同种质资源黄芪不定根的生物量、毛蕊异黄酮与毛蕊异黄酮葡萄糖苷积累的影响。
本研究结果表明,源自相对较高海拔的和龙黄芪不定根(1 200 m)可以较好地适应高浓度的IBA,并且其生物量、毛蕊异黄酮与毛蕊异黄酮葡萄糖苷的含量均高于海拔相对较低的安图黄芪不定根(500 m)。不同地区黄芪质量的差异,可能是由于种间差异、气候因素等引起的[19]。不同海拔地区的年平均温度、土壤等生态因子存在较大差异,这可能导致了2种黄芪不定根对响应外源激素能力的不同。和龙黄芪与安图黄芪不定根分别于培养3 d的 4 mg/L 和 2 mg/L IBA 处理中呈现了毛蕊异黄酮与毛蕊异黄酮葡萄糖苷最高的积累,可在此时收获不定根。
[1] 梁喜龙,方淑梅,刘畅,等.CuSO4与H3BO3对黄芪幼苗建成及部分生理生化指标的影响[J].黑龙江八一农垦大学学报,2012,23(03):1-4.
[2] 刘晓庆,李军,薛恒跃,等.不同来源、不同等级黄芪饮片中毛蕊异黄酮葡萄糖苷含量分析 [J].药物分析杂志,2013,33(05):874-880.
[3] 韩燕.中药黄芪的研究概况[J].河南中医学院学报,2003, 18(109): 86-88.
[4] 汪德清,沈从梅,田亚平,等.黄芪的三种提取成分对氧自由基作用的影响[J].中国药理学通报,1994,10(02):129-132.
[5] Ma X F,Tu P F,Chen Y J,et al.Preparative isolation and purification of two isoflavones from Astragalus membranaceus Bge.var.mongholicus(Bge.)Hsiao by high-speed counter-current chromatography[J].Journal of Chromatography A,2003,992(1-2):193-197.
[6] Park Y J,Thwe A A,Li X H,et al.Triterpene and flavonoid biosynthesis and metabolic profiling of hairy roots,adventitious roots,and seedling roots of Astragalus membranaceus[J].Journal of Agricultural and Food Chemistry,2015,63(40):8862-8869.
[7] Tuan P A,Chuang E,Thew A A,et al.Transcriptional profiling and molecular characterization of astragalosides,calycosin,and calycosin-7-O-β-D-glucoside biosynthesis in the hairy roots of Astragalus membranaceus in response to methyl jasmonate[J].Journal of Agricultural and Food Chemistry,2015,63(27):6231-6240.
[8] Ma X Q,Shi Q,Duan J A,et al.Chemical analysis of Radix Astragali (Huangqi) in China:A comparison with its adulterants and seasonal variations[J].Journal of Agricultural and Food Chemistry,2002,50(17):4861-4866.
[9] 国家药典委员会.中华人民共和国药典(2010年,1部) [M] .北京:中国医药科技出版社,2010.
[10] 秦嘉泽,全雪丽,田海丽,等.长白山野生膜荚黄芪不定根总黄酮积累规律研究[J].北方园艺,2014,16:158-160.
[11] 廉家盛,高日,吴松权,等.膜荚黄芪不定根组织培养的研究[J].安徽农业科学,2008,36(07):2664-2667.
[12] Murthy H N,Hahn E J,Pack K Y.Adventitious roots and secondary metabolism[J].Chinese Journal of Biotechnology,2008,24(05):711-716.
[13] 尹双双,高文远,王娟,等.药用植物不定根培养的影响因素[J].中国中药杂志,2012,37(24):3691-3694.
[14] Wu S Q,Lian M L,Gao R,et al.Bioreactor application on adventitious root culture of Astragalus membranaceus[J].In Vitro Cellular & Developmental Biology-Plant,2011,47(06):719-724.
[15] 宋成英,封加福.HPLC同时测定黄芪药材中毛蕊异黄酮葡萄糖苷和黄芪甲苷[J].中国实验方剂学杂志,2013,19(11):115-117.
[16] 田海丽,全雪丽,秦嘉泽,等.IBA浓度与培养基对黄芩不定根生物量和总黄酮含量的影响[J].江苏农业科学, 2015,43(04):65-66.
[17] Li L,Modolo L V,Escamilla-Trevino L L,et al.Crystal structure of Medicago truncatula UGT85H2-insights into the structural basis of a multifunctional(Iso)flavonoid glycosyltransferase[J].Journal of Microbiology and Biotechnology,2007,370(05):951-963
[18] Kochhar S,Singh S P,Kochhar V K.Effect of auxins and associated biochemical changes during clonal propagation of the biofuel plant-Jatropha curcas[J].Biomass and Bioenergy,2008,32(12):1136-1143.
[19] 段琦梅,梁宗锁,杨东风,等.不同产地黄芪药材质量的差异性分析[J].西北农林科技大学学报(自然科学版). 2010,38(10):187-192.
Effect of IBA concentration on the accumulation of calycosin and calycosin-7-O-β-D-glucoside in adventitious roots of Astragalus membranaceus
LI Ziyang1,LIU Jia1, SUN Haiyan1, LI Deyang2, WU Songquan1, QUAN Xueli1*
(1.AgriculturalCollegeofYanbianUniversity,YanjiJilin133002,China;2.LandscapeEngineeringLimitedCompanyofMeichengofJilinProvince,ChangchunJilin130022,China)
Two types of adventitious roots ofAstragalusmembranaceusin Changbai Mountains as materials, the effect of IBA concentration on the biomass and accumulation pattern of calycosin and calycosin-7-O-β-D-glucoside was investigated. The results showed that biomasses of adventitious roots of bothA.membranaceusfrom Helong and Antu were not significantly changed within 3 days cultured, and both reached peak values when cultured 7 days with 5 mg/L and 2 mg/L IBA treatments, respectively. Additionally, both calycosin and calycosin-7-O-β-D-glucoside contents reached peak values when cultured for 3 days with 4 mg/L and 2 mg/L IBA treatments, respectively.
Astragalusmembranaceus; adventitious roots; IBA concentrations; biomass; calycosin; calycosin-7-O-β-D-glucoside
2016-07-06 基金项目:国家自然科学基金资助项目(21462044)
李子羊(1991—),男,吉林大安人,在读硕士,研究方向为生物技术。全雪丽为通信作者,
E-mail: arswsq@ybu.edu.cn
1004-7999(2016)03-0209-05
10.13478/j.cnki.jasyu.2016.03.005
R284.2
A

