牙周膜干细胞膜片构建的生物性牙根生物学活性研究*
唐雪鹏,李适廷,王崇,管付岩
(1.解放军大连疗养院桃源门诊,辽宁 大连 116013;2.解放军第三军医大学新桥医院,重庆 400037;3.解放军第210医院山屏街医疗区,辽宁 大连 116013;4.解放军第210医院,辽宁 大连 116021)
论著
牙周膜干细胞膜片构建的生物性牙根生物学活性研究*
唐雪鹏1,李适廷2,王崇3,管付岩4
(1.解放军大连疗养院桃源门诊,辽宁 大连 116013;2.解放军第三军医大学新桥医院,重庆 400037;3.解放军第210医院山屏街医疗区,辽宁 大连 116013;4.解放军第210医院,辽宁 大连 116021)
目的将经过鉴定的人牙周膜干细胞(hPDLSC)膜片分别与支架材料预处理牙本质片(TDM)和羟基磷灰石/磷酸三钙(HA-TCP)进行体外共培养,评价不同支架对干细胞分化的影响。方法将单层牙周膜干细胞膜片与2种不同支架材料TDM和HA-TCP分别共培养1周,植入裸鼠皮下,通过扫描电镜和组织学动态观察复合体显微结构变化。结果细胞膜片与TDM边界处结合更为紧密;边界大量矿物沉积和纤维样组织生成;而在HA-TCP组只有单一的走形相对规则的纤维组织生成,未有明显矿化沉积生成。结论复合的hPDLSC/ TDM组更适合具有生物学特点的干细胞发挥其特性,在合适的微环境下使hPDLSC向成牙周组织方向定向分化。
牙周膜干细胞膜片;支架材料;生物性牙根;组织再生
牙周膜干细胞(human periodontalligamentstem cells,hPDLSC)属于成体干细胞,SEO等[1]首次利用克隆筛选和磁珠分离的方法证实有一种本身可以自我更新,而且还具备多项分化潜能的干细胞存在于
牙周膜中,它可以产生牙周组织中具有特定功能的细胞。虽然牙周膜干细胞膜片在牙周组织再生中的研究已取得一定的研究结果,但是如何优化干细胞膜片与支架材料构建生物性牙根仍然是影响组织再生的技术难题[2-4]。支架材料与微环境在牙周再生中起决定性作用[5]。体外成功纯化和培养的牙周膜干细胞与何种支架材料复合能够最大程度模拟出体内牙周组织再生微环境,从而产生最佳的再生效果将对于牙周疾病的治疗和牙周再生医学具有重要意义[6-8]。本实验旨在探索牙周膜干细胞膜片与2种支架材料构建不同生物性牙根,通过异位移植技术模拟牙周组织再生微环境,观察2种生物性牙根组织再生情况,为下一步牙周缺损修复的生物学治疗提供理论基础。
1 材料与方法
1.1 主要试剂与材料
α-DMEM培养基(Gibco公司,美国),胎牛血清(Hyclone公司,美国),青霉素(Gibco公司,美国),L-谷氨酰胺(Gibco公司,美国),I型胶原酶(Sigma公司,美国),抗坏血酸(Sigma公司,美国),地塞米松(Sigma公司,美国),0.25%胰蛋白酶(Amresco公司,美国),PBS(磷酸盐缓冲液),二甲基亚砜(DMSO),β-甘油磷酸钠(Sigma公司,美国)。
1.2 主要仪器
超净工作台(苏州SW-CJ-1SD),二氧化碳恒温孵箱(Forma公司,美国),离心机(Kubota公司,日本),倒置相差显微镜及照相系统(Olympus公司,日本),酶联免疫检测仪(南京华东公司DG5032),6孔培养板(Nunc公司,美国),Transwell共培养房(Nunc公司,美国)。
1.3 方法
1.3.1 牙周膜干细胞的培养与鉴定于第三军医大学新桥医院颌面外科门诊,选择1例无牙周炎症的智齿拔除。PBS冲洗4遍,用刮刀朝一个方向刮取根中1/3的牙周膜组织,置于6孔板内。加入α-MEM培养液(20μg/ml抗坏血酸,10%FBS,0.3 mg/ml谷氨酰胺、100 u/ml青霉素)37℃、40 min、二氧化碳CO2恒温培养,直至细胞从组织块边缘爬出后,继续培养细胞直至生长汇合率达到80%时,采用有限稀释法进行克隆分离、挑选单克隆用于本项实验。
1.3.2 多向分化能力的检测第4代的hPDLSC悬液摇匀后,以1×104个/ml的密度接种到6孔板中,直至细胞扩增至60%时,开始替换为矿化诱导液(含40μg/ml的α-MEM培养液、10%FBS、10 mmol/L β-甘油磷酸钠、0.1μm/L地塞米松),每2天换液一次,诱导14 d后PBS冲洗2遍,4%多聚甲醛固定,茜素红染色,使用倒置显微镜观察。
第4代的hPDLSC细胞悬液,以1×104个/ml的密度均匀接种到6孔板中,直至细胞扩增到60%左右时,加入成脂肪细胞诱导液(含10%FBS的DMEM培养液、0.5 mmol/LIBMT、10μmol/L胰岛素、200μmol/L地塞米松),每2天换液,诱导14 d后PBS冲洗2遍,再用4%多聚甲醛固定,油红O染色,倒置显微镜下观察。
1.3.3 流式细胞仪检测取对数期生长状态良好的4代hPDLSC,先胰酶消化,将2 ml无水乙醇和1 ml PBS充分地吹打均匀,并将细胞密度调整至1× 105/ml,再用40 g/L的多聚甲醛固定30 min;充分洗涤后分别加一抗:抗-CD105(稀释浓度1∶100);抗-CD146(稀释浓度1∶120);抗Stro-1(稀释浓度1∶100)。37℃孵育50 min,加入羊抗兔Ig-FITC,37℃避光50 min,流式细胞仪检测表达水平。
1.4 单层干细胞膜片的制备
将增殖状态良好的经鉴定过的第4代hPDLSC以胰蛋白酶消化5 min,制成均匀的细胞悬液,调整细胞密度1×105个细胞分别均匀接种在培养皿中,加入10 ml诱导培养液(含经抗坏血酸、10%FBS的DMEM0),2 d换液一次,孵育10 d。
1.52 种支架材料的制备与检测
1.5.1 牙本质片的处理(treated dentin matrix,TDM)将用于正畸治疗需要拔除的上颌第一前磨牙2颗与下颌第一前磨牙2颗分别用外科手术刀将剩余牙周组织完全刮除,切取根中1/3牙体组织,将剩余的牙体组织制备成2 mm×3 mm大小的长方体,去离子水中浸泡;17%EDTA浸泡5 min,保存于无菌PBS溶液中,置于4℃冰箱备用。
1.5.2 羟基磷灰石-磷酸三钙(hydroxyapite-tricalcium,HA-TCP)的制备将100 ml的氢氧化钙Ca(OH)2溶液与600 ml磷酸水溶液搅拌均匀直至形成非结晶羟基磷灰石的溶液。表面进行干燥并预烧结12 h,最后修整成3 mm×5 mm大小片状结构,CO60常规消毒备用。
1.5.3 牙周膜干细胞膜片与2种支架材料复合培养扫描电镜观察将制备好的支架材料置于一次性培养皿上,浸泡于含10%FBS的DMEM培养基中30 min,将膜片分别与支架材料全方位复合,构建生
物性牙根体。置于37℃、5%CO2培养箱共孵育7 d,3%戊二醛缓冲液(pH 7.4)固定,PBS冲洗干净,固定、干燥、喷金。扫描电镜观察。
1.5.4 裸鼠皮下异位移植4周龄裸鼠4只购于第三军医大学新桥医院动物中心,并经第三军医大学伦理委员会许可。将细胞与2种支架材料复合体植入裸鼠皮下:左侧实验组植入TDM+HPDLSC膜片(经体外共培养),右侧对照组植入HA-TCP+ HPDLSC膜片(经共培养)。移植6周取材,10%福尔马林固定1周,冲洗、脱钙、系列脱水、石蜡包埋、切片,进行HE染色,光镜下组织学观察。
2 结果
2.1 hPDLSC形态学观察
镜下可见,hPDLSCs呈长梭形纤维状,集落状生长(见图1A、B)。经成骨诱导后出现明显矿化结节,经成脂诱导后出现明显脂滴,说明细胞具有多向分化能力(见图1C、D)。流式细胞仪检测结果显示,细胞表面的干细胞标志性分子CD105、CD146和 STRO-1均成阳性表达(见图2)。成熟的hPDLSCs细胞单层细胞膜片见图3。
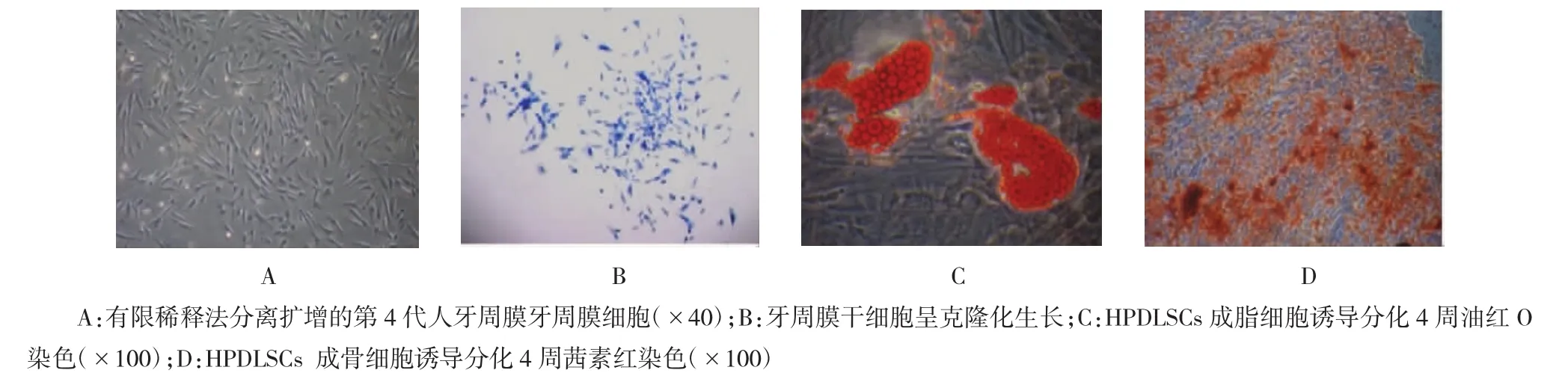
图1 牙周膜干细胞的分离与鉴定
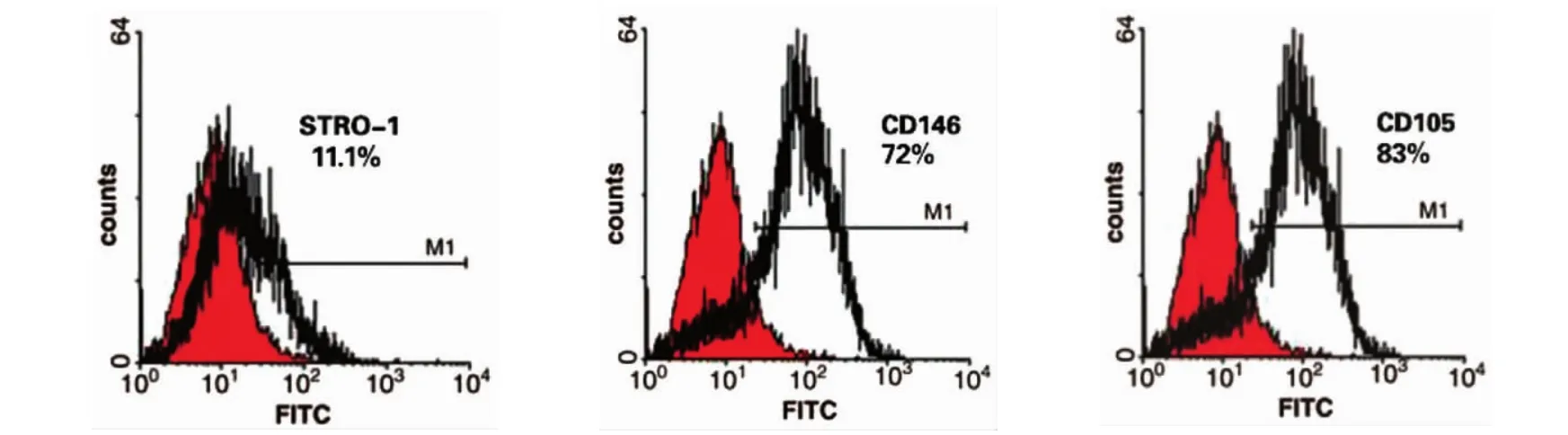
图2 牙周膜干细胞表面特异性CD分子检测

图3 成熟的hPDLSCs细胞单层细胞膜片大体观
2.2 支架材料扫描电镜观察
TDM电镜观显示TDM适合作为支架材料诱导细胞和微环境;HA-TCP扫描电镜观可见表面形态良好,适合细胞黏附和增殖(见图4)。

图4 TDM与HA-TCP扫描电镜观(×30)
2.3 PDLCS膜片与支架材料共培养扫描电镜观察
共培养7 d后,扫描电镜下可见PDLSC/TDM组界面结合处细胞排列整齐紧密,细胞的极性化较为明显,结合处有明显的类牙骨质的矿化结节产生(见图5A、B);而在PDLSC/HA-TCP组可见大量的走形不规则的纤维样组织生成,细胞与支架材料结合处有空隙,未见明显的细胞外矿化基质的产生(见图5C、D)。
2.4 PDLSC膜片与支架材料裸鼠皮下异位移植组织学观察
组织学结果发现,hPDLSC/TDM组细胞极性化趋势更为明显,膜片内细胞与支架材料结合处形成大量走形规则的纤维连接,穿通性明显,还能够观察
到不均量的矿化物沉积和纤维样组织,似牙周膜/牙骨质样结构,箭头处可见交界处明显的矿化沉积(见图6A);PDLSC/HA-TCP组有走形不规则的穿通纤维形成,形成少量的表面矿化沉积,箭头处所示(见图6B)。
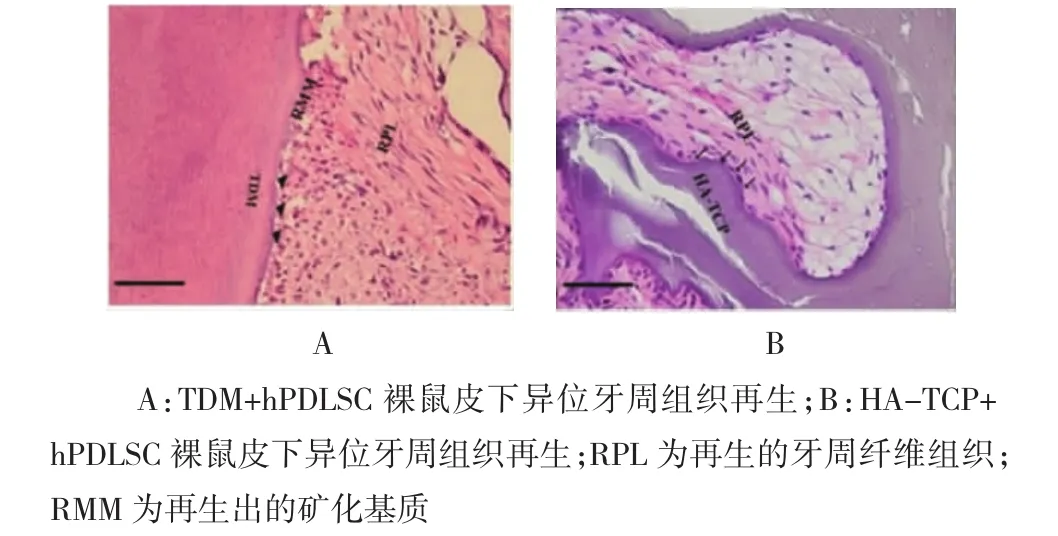
图6 hPDLSC与支架复合物裸鼠体内异位移植组织再生结果(×40)
3 讨论
作为理想的组织工程学的支架材料可以从微观结构上控制生物材料与细胞间的相互作用,实现细胞的定位黏附、增殖分化及细胞微环境的重建[9-11]。细胞定植到支架的表面作为组织再生的第一步尤为重要。只有细胞定植到支架上后,细胞才能够定向增殖并且分泌细胞外基质。细胞外基质作为细胞与支架材料接触最重要的结合位点可以使细胞更好的黏附到支架材料上。目前已有文献证实,通过细胞的三维培养,促使细胞膜片分泌大量的细胞外基质,提高了细胞对材料材料的黏附能力[12-13]。而本实验所选用的经过特殊处理的牙本质片通过梯度化表面修饰处理,不仅可以提高支架材料的诱导特性,并且极大地优化细胞与支架的特异性作用,从而有利于提高种子细胞的生物学特性。
细胞外基质是使用组织工程学原理构建的生物性牙根的重要组成部分,它的构建过程极漫长和复杂,受多方面因素影响[14-16]。但来自于细胞所处的微环境的动态变化将直接或间接影响细胞外基质的平衡的作用,促进细胞外基质的时空变化[17]。当细胞与支架紧密结合后,细胞膜表面特异性受体会识别支架材料表面相应的配体,并与之相结合,从而产生特异性结合,调节和促使种子细胞自分泌细胞外基质及发生适应性结构和功能改建。通过支架材料的诱导,存在于细胞膜片内的干细胞和细胞外基质将发生功能性重组,细胞的排列、形态、细胞内微结构以及细胞外基质骨架的三维构象均将发生转变,该种变化影响着干细胞最终的分化方向[18]。本实验选用的支架材料TDM与HA-TCP均为具有一定活性的诱导性材料,能够诱导牙周膜干细胞向成骨方向定性分化。SEM结果表明,两种支架材料均能使干细胞膜片内细胞分泌细胞外基质,但TDM还表现出具有提升矿化基质沉积量的作用,更为重要的是在接触共培养的情况下膜片内细胞形态学发生明显改变,表现为细胞更为狭长、细胞突起减少和细胞极性增加,该特征是否与膜片内干细胞的分化以及生物学活性的变化有关,是值得进一步探讨的内容。
本实验所选用的2种支架材料均有孔隙率高的特点,有利于细胞的黏附。但块状的HA-TCP存在材料表面的亲和力差、强度不高和表面自由基容易丧失等缺点。而TDM却具有定向诱导、强度硬度较高,更易于细胞表面黏附分子与自由基的附着与固位,在共培养体系中更易诱导干细胞向成骨方向分化。从本实验结果显示,TDM与干细胞膜片的复合共培养更类似体内牙周组织再生的过程,可以为骨组织工程化发展提供新的思路。
[1]SEO B M,MIURA M,GRONTHOS S.Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. Lancet,2004,364(364):149-155.
[2]LU H W,XIE C,ZHAO Y M,et al.Translational research and
therapeutic applications of stem cell transplantation in periodontal regenerative medicine[J].Cell Transplant,2013,22(20):121-128.
[3]TANG X P,GUO W H,HE Y.Scaffold-free cell pellet transplantations can be applied to periodontal regeneration[J].Cell Transplant,2014,23(2):181-194.
[4]LI R,GUO W,YANG B,et al.Human treated dentin matrix as a natural scaffold for complete human dentin tissue regeneration[J]. Biomaterials,2011,32(20):25-38.
[5]PORTER K,FILIPAK M,SCOTT RE.Metaplastic change in mesenchymal stem cell sinduced by activated ras oncogene[J].Am J Pathol,1990,137(5):1091-1102.
[6]卢玉旺,刘宏伟,王晓宇.预培养比格犬干细胞的牙本质片复合牙周膜细胞膜片裸鼠体内移植研究[J].实用口腔医学杂志,2014,5: 598-602.
[7]CHOI Y J,KIM E,HAN J,et al.A novel biomolecule-mediated reduction of graphene oxide:A multifunctional anti-cancer agent[J]. Molecules,2016,21(3):35-40.
[8]DU C,YAO C,LI N,et al.Cell sheet-engineered bones used for the reconstruction of mandibular defects in an animal model [J].Exp Ther Med,2015,10(6):2216-2220.
[9]KIM S J,CHO H R,CHO K W.Multifunctional cell-culture platform for aligned cell sheet monitoring,transfer printing,and therapy[J].Acs Nano,2015,9(3):2677-2688.
[10]FU Q,MARTIN B L,MATUS D Q,et al.Imaging multicellular specimens with real-time optimized tiling light-sheet selectiv e plane illumination microscopy[J].Nat Commun,2016,31(7): 11-16.
[11]GUO W H,WANG S,YU X,et al.Construction of a 3D-rGO-collagen hybrid scaffoement of the neural differentiation of mesenchymal stem cells[J].Nanoscale,2016,8(4):1897-1904.
[12]KAWANI K,NITTA K.Cell sheet-based tissue engineering for mesothelial cell injury[J].Contrib Nephrol,2015,185(15):66-75.
[13]PERROD G,RAHMI G,PIDIAL L,et al.Cell sheet transplantation for esophageal stricture prevention after rndoscopic dubmucosal fissection in a porcine model[J].PLoS One,2016,11 (3):231-238.
[14]ZENG J J,GUO P,ZHOU N,et al.Treatment of large bone defects with a novel biological transport disc in non-vascular transport distraction osteogenesis[J].Int J Oral Maxillofac Surg, 2016,32(12):26-29.
[15]TAKAHASHI M.Retinal cell therapy using IPS cells[J].Nippon Ganka Gakkai Zasshi,2016,120(3):210-224.
[16]ZHANG Q,QU Y,LI Z,et al.Isolation and culture of single cell types from rat liver[J].Cells Tissues Organs,2016,201(4): 253-267.
[17]SANTI P A,ALDAYA R,BROWN A,et al.Scanning electron microscopic examination of the extracellular matrix in the decellularized mouse and human cochlea[J].Assoc Res Otolaryngol, 2016,17(3):159-171.
[18]DEAN KM,ROUDOT P,REISCR.Diagonally scanned light-sheet microscopy for fast volumetric imaging of adherent cells[J].Biophys,2016,110(6):1456-1465.
(张蕾 编辑)
Biological activity of biological roots constructed by periodontal ligament stem cell sheet*
Xue-peng Tang1,Shi-ting Li2,Chong Wang3,Fu-yan Guan4
(1.Taoyuan Clinic of Dalian Sanatorium of Chinese PLA,Dalian,Liaoning 116013,China; 2.Department of Stomatology,Xinqiao Hospital,the Third Military Medical University, Chongqing 400037,China;3.Shanping Medical District of No.210 Hospital of Chinese PLA, Dalian,Liaoning 116013,China;4.The No.210 Hospital of Chinese PLA, Dalian,Liaoning 116021,China)
Objective To co-culture the identified human periodontal ligament stem cell membranes(hPDLSC) respectively with pretreated dentin matrix(TDM)and hydroxyapatite/tricalcium(HA-TCP)in vitro,and evaluate the effects of different scaffolds on stem cell differentiation.Methods Monolayer periodontal ligament stem cell membrane was incubated with two different scaffold materials for 1 week,and implanted into osteoporosis rats.Using scanning electron microscopy and histological section,the microsture changes were dynamically observed.Results A lot of mineral deposition and fibrous tissue were formed in the dentin matrix(TDM)group and there was some irregular fibrous tissue regeneration in the HA-TCP group without obvious mineral material generation.Conclusions hPDLSC/TDM composite is more suitable for the stem cells to fully develope their own biological characteristics.It can be more suitable for hPDLSC to differentiate into periodontium in suitable microenvironment.
periodontal ligament stem cell sheet;scaffold material;biological root;tissue regeneration
R-332
A
10.3969/j.issn.1005-8982.2016.22.003
1005-8982(2016)22-0013-05
2016-05-06
国家自然科学基金(No:81300873)
管付岩,E-mail:1291512662@qq.com.

