白藜芦醇对人前列腺癌细胞株PC-3增殖及TGF-β1/Smad2信号通路影响研究
王享利
(中南大学湘雅医院,湖南 长沙 410008)
论著
白藜芦醇对人前列腺癌细胞株PC-3增殖及TGF-β1/Smad2信号通路影响研究
王享利
(中南大学湘雅医院,湖南 长沙 410008)
目的探讨白藜芦醇对前列腺癌细胞株PC-3增殖及转化生长因子β1(TGF-β1)/Smad2信号通路的影响。方法不同浓度白藜芦醇干预体外培养前列腺癌细胞株PC-3白藜芦醇不同时间。MTT检测白藜芦醇对PC-3细胞生长情况的影响,流式细胞术检测细胞周期的变化情况,逆转录-聚合酶链反应(RT-PCR)和蛋白免疫印迹法(Western blot)分别检测细胞内TGF-β1和Smad2 mRNA和蛋白表达水平的变化情况。结果MTT结果显示白藜芦醇显著抑制了前列腺癌细胞的生长。流式细胞结果表明白藜芦醇明显降低了前列腺癌细胞S期含量而增加了G0/G1期含量。而TGF-β1和其下游因子Smad2的mRNA和蛋白水平的表达也明显受到白藜芦醇的抑制,且这种抑制作用呈浓度一时间依赖性。结论白藜芦醇可能够通过阻断TGF-β1/Smad2信号通路抑制前列腺癌细胞生长前列腺癌。
白藜芦醇;转化生长因子β1;前列腺癌
前列腺癌是一种常见的老年男性疾病,其发病率具有地区差异性,在欧美,前列腺癌在肿瘤中是致男性死亡的第2病因,仅次于肺癌[1]。东亚地区发病率较低,但有增高趋势,我国前列腺癌的发病率较20世纪60年代前明显增高[2]。前列腺癌的细胞生物学行为极不确定,疾病自然进展过程存在极大的个体差异性。有的患者短期内迅速死亡,而有的则预后较好,较长时间疾病也不会有太大进展,患者可以存活较长时间[3]。因此寻找前列腺癌治疗的新方法具有重要临床意义。GOTZMANN等研究发现[3],转化生长
因子β1(transforming growth factor-β1,TGF-β1)在前列腺上皮细胞恶变为前列腺癌细胞过程中发挥重要作用。因此,靶向TGF-β1是前列腺癌治疗的潜在有效靶点。(无环)单萜白藜芦醇是在柠檬、天竺葵及其他从医用植物中提取精油中含量极低的天然化合物。白藜芦醇具有抗氧化、抗微生物和抗炎活性[4]。此外,白藜芦醇还能通过靶向细胞周期和凋亡过程抑制多种人类肿瘤细胞生长[5-7]。本研究主要探讨白藜芦醇对前列腺癌细胞株生长的影响及其与TGF-β1信号通路的关系。
1 材料与方法
1.1 材料来源
1.1.1 细胞培养前列腺癌细胞株PC-3购自中南大学细胞生物实验中心,细胞在37℃,含5%二氧化碳CO2的培养箱内,用含10%小牛血清的DMEM高糖培基(美国Hyclone公司)培养,培养基中分别加入终浓度为100 mg/L的链霉素与青霉素,细胞贴壁生长24 h。细胞用0.05%胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)消化传代,选取对数生长期细胞进行后续实验。
1.1.2 试剂来源白藜芦醇购自美国Sigma公司,Trizol、逆转录-聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)试剂盒购自大连宝生物公司,偏二氟乙烯膜(polyvinylidene fluo ride,PVDF)膜购自美国Millipore公司,抗体TGF-β1和Smad家族成员2(Smad family member 2,Smad2)购自美国Santacruz公司。
1.2 方法
1.2.1 四甲基噻唑蓝(Thiazolyl blue tetrazolium bromide,MTT)法检测白藜芦醇对前列腺癌细胞株PC-3生长的影响PC-3细胞培养至对数生长期后,消化计数,以105个/ml接种于96孔板,培养过夜后,分别用1、2、4、6、8、16mmol的白藜芦醇干预PC-3细胞24、48和72 h,对照组细胞仅加入相应培养基。药物干预完成后,弃去培养基,加入200 ml 5 mg/ml MTT继续培养4 h,最后用50 ml DMSO处理,酶标仪测定OD450 nm时细胞吸光值(optical density,OD),然后计算抑制率。抑制率=(1-药物干预组OD/对照组OD)×100%。并在倒置显微镜下观察未经白藜芦醇处理及经白藜芦醇处理的PC-3细胞形态。
1.2.2 流式细胞仪检测白藜芦醇对前列腺癌细胞株PC-3细胞周期的影响1、2、4、6、8和16 mmol的白藜芦醇干预PC-3细胞48 h(根据MTT结果筛选出的最佳作用时间点)后,弃去培养基,PBS漂洗细胞2次,4%多聚甲醛固定过夜,PI染色后流式细胞仪检测其细胞周期。
1.2.3 RT-PCR检测白藜芦醇对前列腺癌细胞株PC-3细胞TGF-β1和Smad2 mRNA表达的影响采用Oligo 7.0软件设计TGF-β1、Smad2及β-actin引物,并交由美国Invitrogen公司合成。引物序列如下:TGF-β1,5′-CCTTGCTGGACCGCAACAAC-3′(正向),5′-CAGCAGCCGGTTACCGAC-3′(反向);Smad2,5′-CAGGTTCCAGCTATGGAGC-3′(正向),5′-TTCATGGCCGAATCCCAT-3′(反向);β-actin,5′-C AGGTCATACTCCTGCGGCTG-3′(正向),5′-CGGGA CCTCACTGACTACCTC-3′(反向)。Trizol提取细胞tRNA,采用易步发RT-PCR试剂盒扩增。扩增结束后,PCR产物行1.8%琼脂糖凝胶电泳,凝胶成像系统下观察电泳结果,并进行灰度值分析。
1.2.4 蛋白免疫印迹法(Western blot)检测白藜芦醇对前列腺癌细胞株PC-3细胞TGF-β1和Smad2蛋白表达的影响白藜芦醇作用PC-3细胞48 h后,收集细胞,加入1 ml细胞裂解液,超声粉碎,离心,取上清液。分别取100μg样品蛋白/孔上样,SDS聚丙烯酰胺凝胶电泳分离蛋白,湿转1 h(4℃,100 v),5%脱脂奶粉封闭2 h,然后分别用β-actin(1∶1 000),TGF-β1(1∶500)、Smad2(1∶500)一抗4℃平摇过夜,辣根过氧化物酶(horseradish peroxidase,HRP)标记二抗(1∶1 000)避光孵育2 h,显色液显色,显影,定影,扫描条带并行分析,以目的条带与β-actin条带吸光度的比值作为目的蛋白的相对表达量。
1.3 统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间均值比较用重复测量设计的方差分析或单因素方差分析,两两比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 白藜芦醇对前列腺癌细胞株PC-3生长及形态的影响
1、2、4、8及16 mmol白藜芦醇干预组分别与对照组干预后24、48和72 h OD450值比较,采用重复测量数据的方差分析,结果:①1、2、4 mmol白藜芦
醇干预组不同时间点间OD450值差异无统计学意义(F=2.176、1.482及1.153,P=0.284、0.462及0.517),8和16 mmol白藜芦醇干预组不同时间点间OD450值差异有统计学意义(F=10.873、11.285,P=0.001、0.000);②8和16 mmol白藜芦醇干预PC-3细胞72 h,OD450值分别(0.747±0.138)和(0.426± 0.106),低于对照组(1.125±0.589),经t检验,差异有统计学意义(t=2.694、4.826;P=0.003、0.001)(见图1和表1)。MTT结果表明,白藜芦醇以时效性和剂效性抑制PC-3生长。
在不同浓度白藜芦醇干预的细胞分别于培养24,48和72 h后,于倒置相差显微镜下观察,人前列腺癌PC-3细胞经白藜芦醇处理后出现明显的形态学改变。倒置显微镜下观察细胞形态,比较白藜芦醇药物作用组和对照组,未受到白藜芦醇干预的细胞均呈单层细胞贴壁生长,细胞间结构紧密,细胞增殖生长(见图2A)。随药物干预的剂量和时间延长,细胞形态逐渐变圆,细胞间间隙增大,细胞密度逐渐变小,细胞内中毒颗粒增多,折光度下降,部分细胞丧失贴壁能力,悬浮在培养基中生长,随机视野可见细胞密度明显减少。在相同的时间内,细胞对不同浓度药物的反应存在差异。随白藜芦醇药物浓度的增大,前列腺癌PC-3细胞脱落的比例增多,细胞碎裂的比例明显增多。上述结果提示白藜芦醇可以抑制PC-3细胞的增殖(见图2B~D)。
2.2 白藜芦醇对前列腺癌细胞株PC-3细胞周期的影响
方差分析显示,各组间G0/G1、S及G2/M其细胞均有差异,与对照组比较,当白藜芦醇浓度为1、2、4 mmol/L时,处于G0/G1的PC-3细胞的比例差异无统计学意义;当白藜芦醇浓度为8 mmol/L时,G0/G1期PC-3细胞的比例较对照组增加(P=0.006),而S期和G2/M的比例则下降(P=0.007和0.012)(见表2)。
2.3 白藜芦醇对前列腺癌细胞株PC-3 TGF-β1和Smad2 mRNA和蛋白表达的影响
RT-PCR和Western blot实验结果表明,白藜芦醇以时间剂量效应抑制PC-3 TGF-β1和Smad2 mRNA和蛋白表达(见图2~4)。

图1 白藜芦醇干预对前列腺癌细胞株增殖的影响
表1 白藜芦醇干预不同时间OD450值比较(mol/L,±s)
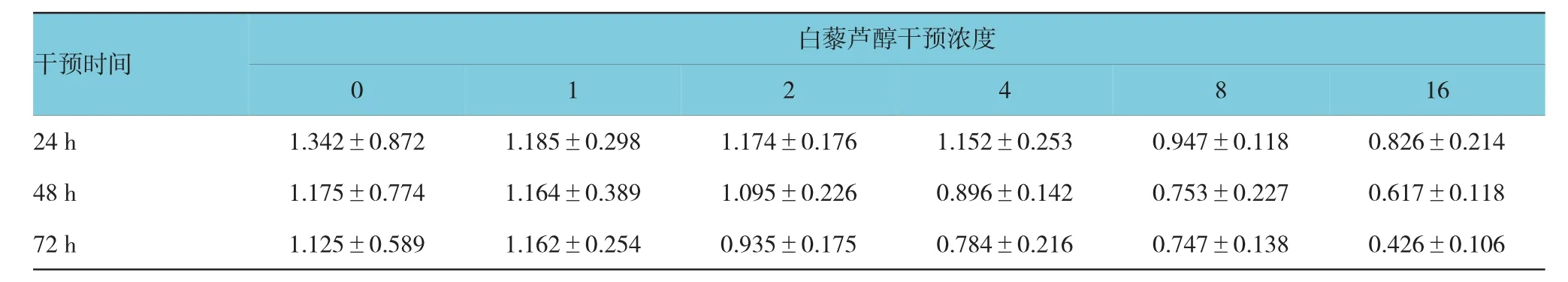
表1 白藜芦醇干预不同时间OD450值比较(mol/L,±s)
干预时间16 24 h1.342±0.8721.185±0.2981.174±0.1761.152±0.2530.947±0.1180.826±0.214 48 h1.175±0.7741.164±0.3891.095±0.2260.896±0.1420.753±0.2270.617±0.118 72 h1.125±0.5891.162±0.2540.935±0.1750.784±0.2160.747±0.1380.426±0.106白藜芦醇干预浓度0 1 2 4 8
表2 不同浓度白藜芦醇对PC-3细胞周期的影响(±s)

表2 不同浓度白藜芦醇对PC-3细胞周期的影响(±s)
注:t值指不同浓度组白藜芦醇分别与对照组比较;F值指所有处理组不同细胞周期的组内比较
组别细胞周期G0/G1t值P值St值P值G2/Mt值P值对照组60.9±7.224.8±4.714.3±6.1 1 mmol/l62.4±6.30.5440.87224.9±3.80.6150.74612.7±2.80.5320.885 2 mmol/l 4 mmol/l 8 mmol/l 16 mmol/l F值P值63.8±5.2 68.5±7.3 74.3±2.1 81.6±8.2 8.947 0.002 0.627 1.728 6.894 9.172 0.744 0.048 0.006 0.001 23.4±6.8 18.3±2.4 15.2±1.7 11.3±1.6 10.726 0.001 0.789 3.584 6.672 9.384 0.522 0.027 0.007 0.001 12.8±1.4 13.2±2.1 10.5±3.2 7.1±2.6 9.835 0.001 0.872 3.573 4.682 10.465 0.392 0.028 0.012 0.001

图2 PC-3细胞形态学观察(×200)
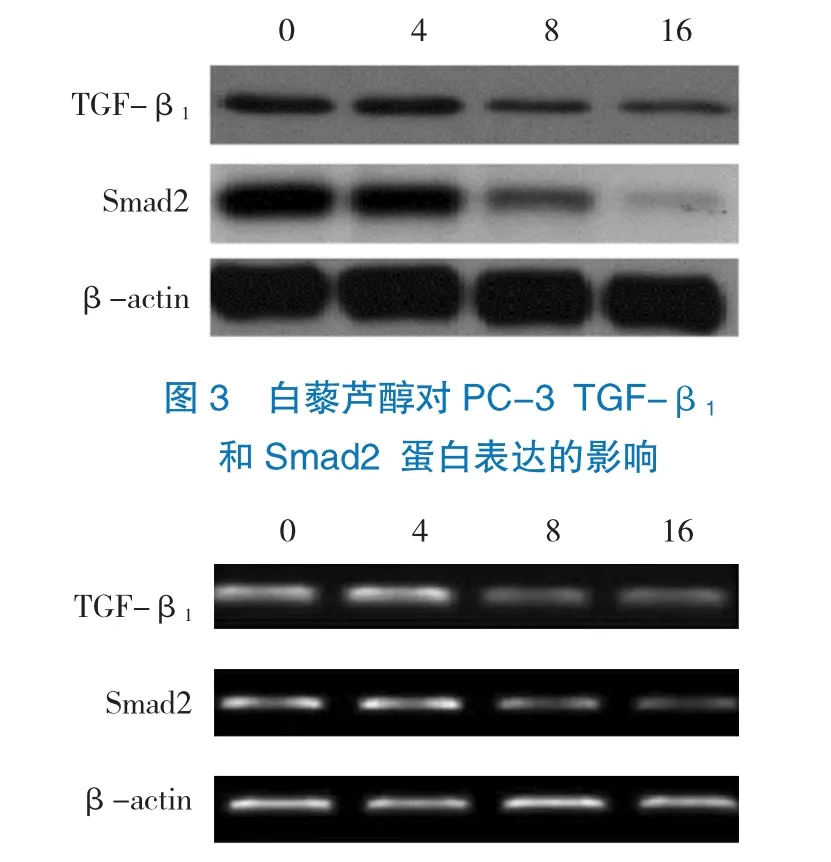
图4 白藜芦醇对PC-3 TGF-β1和Smad2 mRNA表达的影响
3 讨论
转化生长因子β1(TGF-β1)在胚胎形成、细胞生长调控、胞外基质分泌、血管生成及免疫调节等多种生理过程中发挥重要作用。动脉粥样硬化和脏器纤维化与TGF-β1表达异常密切相关,特别是TGF-β1与癌症的相关性近年来成为学者们关注的焦点[8]。Smads是一类十分重要的转录因子调节信号分子家族,其中Smad2识别和结合上游信号分子,并将其转运至细胞核内,并激活TGF-β1/Smads信号通路,因此Smad2是TGF-β1/Smads信号通路至关重要的调控分子。Smad2表达沉默会导致TGF-β1/Smads信号通路发生紊乱[9]。
TGF-β1/Smads信号通路在肿瘤不同阶段发挥不同的作用。肿瘤形成时,TGF-β1/Smads信号通路抑制肿瘤细胞生长。在该阶段,一旦参与TGF-β1/ Smads信号通路的信号分子表达异常,肿瘤细胞既能捕捉到该信息,从而“逃避”TGF-β1/Smads信号通路的抑制作用。而当肿瘤处于进展期时,TGF-β1/ Smads信号通路发挥促进肿瘤细胞生长的作用,并增强肿瘤的侵袭性和恶性程度[10]。
丁国芳等[11]研究发现,TGF-β1和Smad2在前列腺癌组织中的表达高于正常前列腺组织上皮组织,TGF-β1和Smad2基因过表达可能在HCC的发生、发展中发挥作用。李伟等[12]研究表明,TGF-β可以上调PC-3细胞血管内皮生长因子的表达,氯化锂可以增强TGF-β上调血管内皮生长因子表达的作用,前列腺癌PC-3细胞中Wnt信号通路与TGF-β信号相互激活,对前列腺癌的发生、发展有一定意义。孔丽等[13]则研究证实,TGF-β1/Smads信号转导通路被抑制,使TGF-β1介导的抗增殖信号不能正常下传,可能是前列腺癌发生的机制之一。本研究提示TGF-β1/Smad2信号通路是前列腺癌发生、发展的重要参与者,是前列腺癌治疗的潜在有效靶点。
白藜芦醇已被证实能够抑制多种人类肿瘤的生长,其主要通过抑制多种肿瘤生长因子、肿瘤代谢酶、转录调控因子及抗凋亡蛋白表达发挥肿瘤抑制作用[14]。本研究首先采用MTT实验检测白藜芦醇对前列腺癌细胞PC-3生长的影响,结果证实白藜芦醇以时间和剂量依赖效应抑制前列腺癌细胞生长,这一结果与以往研究结果一致[15]。此外,本实验结果还发现,白藜芦醇能够抑制S期肿瘤细胞比例,使多肿瘤细胞发生G0/G1期阻滞。而Western blot和RT-PCR实验表明,白藜芦醇能够降低前列腺癌细胞中TGF-β1和Smad2蛋白和mRNA表达。本结果提示,白藜芦醇能够抑制前列腺癌细胞TGF-β1/Smad2信号通路活性,且该抑制作用有浓度-时间依赖性。
总之,白藜芦醇能够抑制前列腺癌细胞生长,是其发生G0/G1期阻滞。其可能机制是白藜芦醇通过抑制TGF-β1和Smad2表达而阻断TGF-β1/Smad2信号通路,本文研究结果为前列腺癌临床治疗提供了新思路。但是,白藜芦醇抑制TGF-β1/Smad2信号通路具体作用机制仍需进行深入探讨,并需进行体
内实验验证,以便为将白藜芦醇作为预防或治疗前列腺癌的有效药物提供最为充分依据。
[1]赫捷,赵平,陈万青.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:85-87.
[2]褚志强,吴向未,杨宏强,等.原发性前列腺癌手术治疗的生存率分析及影响因素研究[J].实用医学杂志,2013,29(5):787-789.
[3]GOTZMANN J,HUBER H,THALLINGER C,et al.Hepatocytes convert to a fibroblastoid phenotype through the cooperation of TGF-beta 1 and Ha-Ras:steps towards invasiveness[J].Journal of Cell Science,2002,115(6):1189-1202.
[4]LAPCZYNSKI A,BHATIA S P,FOXENBERG R J,et al.Fragrance material review on resveratrol[J].Food&Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2008,46(11):S160-S170.
[5]MADANKUMAR A,JAYAKUMAR S,GOKULADHAS K,et al. Resveratrol modulates tongue and hepatic phaseⅠand phaseⅡconjugation activities and may contribute directly to the chemopreventive activity against experimental oral carcinogenesis[J].European Journal of Pharmacology,2013,705(20):148-155.
[6]JIN X,SUN J,MIAO X,et al.Inhibitory effect of resveratrol in combination with gemcitabine on proliferation of BXPC-3 human pancreatic cancer cells[J].Journal of International Medical Research,2013,41(4):993-1001.
[7]GALLE M,CRESPO R,KLADNIEW B R,et al.Suppression by resveratrol of the growth of A549 human lung adenocarcinoma cells and inhibition of the mevalonate pathway in culture and in vivo:potential use in cancer chemotherapy[J].Nutrition&Cancer, 2014,66(5):888-895.
[8]王芙蓉,李云霞.转化生长因子β1与肿瘤关系的研究进展[J].医学综述,2008,14(9):1318-1320.
[9]OTA K,QUINT P,RUAN M,et al.TGF-?induces Wnt10b in osteoclasts from female mice to enhance coupling to osteoblasts[J]. Endocrinology,2013,154(10):3745-3752.
[10]刘锟荣,韦宜宾,陈国忠.Wnt/β-catenin、TGF-β/Smads及RAS/ MARK信号通路与大肠癌关系的研究进展[J].广东医学,2014, 8(17):2785-2788.
[11]丁国芳,李继承,徐银峰.前列腺癌nm23H1 mRNA、TGF-β1 mRNA表达及其与肿瘤转移、生存率的相关性研究[J].分子细胞生物学报,2006,39(6):544-552.
[12]李伟,辛殿祺,郭应禄.前列腺癌PC-3细胞中Wnt信号通路与TGF-β信号通路相互调节[J].中华泌尿外科杂志,2006,27(S1): 140-141.
[13]孔丽,姚树坤,张瑞星,等.原发性前列腺癌患者血清TGF-β1、IL-12、IFNγ等细胞因子水平及临床演变的关系[J].临床肝胆病杂志,2006,22(4):247-249.
[14]付招娣,曹玉,王凯风,等.白藜芦醇对癌的化学预防作用[J]. Chinese Journal of Cancer,2004,23(8):869-873.
[15]POLO M P,CRESPO R,BRAVO M G.Resveratrol and simvastatin show a synergistic effect on a human hepatocarcinoma cell line[J].Cell Biochemistry&Function,2011,29(6):452-458.
(张蕾 编辑)
Effect of resveratrol on proliferation and TGF-β1signaling pathway on human prostate cancer cell line PC-3
Xiang-li Wang
(Xiangya Hospital,Central South University,Changsha,Hunan 410008,China)
Objective To observe the effect of resveratrol on proliferation and TGF-β1signaling pathway of human prostate cancer cell line PC-3.Methods Human prostate cancer cell line PC-3 was cultured and treated with resveratrol at different concentrations and different time points.The effect of resveratrol on PC-3 cell proliferation was studied by means of MTT.The cell cycle was detected with flow cytometry.RT-PCR and Western blot were used to detect the expressions of TGF-β1and Smad2 at mRNA and protein levels.Results The viability of Huh-7 cells treated with resveratrol was obviously decreased.Analysis of the cell cycle revealed that resveratrol induced a significant decrease in cells in the S phase and increase in cells in the G1phase.Furthermore,the expressions of TGF-β1and its downstream factor-Smad2 were inhibited at mRNA and protein levels by resveratrol in a concentration-and time-dependent manner.Conclusions Resveratrol perhaps plays inhibitory effect on PC-3 cells through inhibiting the activity of TGF-β1signaling pathway.
resveratrol;TGF-β1signaling pathway;prostate cancer
R737.25
A
10.3969/j.issn.1005-8982.2016.22.004
1005-8982(2016)22-0018-05
2016-04-05

