谷胱甘肽过氧化物酶3甲基化及蛋白表达在胃癌中的临床意义
范红云 李 超 褚茜茜 段志英 韩双双 于卫芳
(河北医科大学第一医院消化内科,河北 石家庄 050031)
谷胱甘肽过氧化物酶3甲基化及蛋白表达在胃癌中的临床意义
范红云 李 超1褚茜茜1段志英 韩双双1于卫芳1
(河北医科大学第一医院消化内科,河北 石家庄 050031)
目的 探讨血浆谷胱甘肽过氧化物酶(GPX)3基因启动子甲基化及GPX3蛋白表达在胃癌发病中的临床意义。方法 采用甲基化特异性聚合酶链反应(MSP)方法检测胃癌组和胃炎组血标本中的GPX3甲基化程度;采用免疫组化方法检测胃癌组和癌旁正常组织标本中的GPX3蛋白表达情况,分析其与临床病理特征间的关系。结果 ①胃癌组GPX3甲基化程度显著高于胃炎组(P<0.01);胃癌伴有淋巴结转移组GPX3甲基化程度显著高于无淋巴结转移组(P<0.05);胃癌组GPX3甲基化程度与患者年龄、性别和肿瘤分化程度、浸润情况、TNM分期无关(P>0.05);②胃癌组GPX3蛋白表达较癌旁正常组显著降低(P<0.01);胃癌伴有淋巴结转移组GPX3蛋白表达显著低于无淋巴结转移组(P<0.05);胃癌组GPX3蛋白表达与患者年龄、性别和肿瘤分化程度、浸润情况、TNM分期无关(P>0.05);③胃炎组GPX3蛋白表达与癌旁正常组无显著差异(P>0.05)。结论 GPX3基因启动子区高甲基化通过下调GPX3蛋白表达,参与胃癌发生和促进淋巴结转移,有潜力成为诊断胃癌、判断预后的预警分子指标和临床治疗中的基因调控靶点。
胃癌;谷胱甘肽过氧化物酶(GPX)3;甲基化;蛋白;甲基化特异性聚合酶链反应(MSP);免疫组化
2012年中国肿瘤登记年报数据中,胃癌占恶性肿瘤发病率的第二位和死亡率的第三位〔1〕。研究表明,DNA甲基化作为一种重要的表观遗传机制,通过下调抑癌基因表达在胃癌的发病过程中起重要作用。血浆谷胱甘肽过氧化物酶(GPX)3是机体抗过氧化物酶防御体系中的重要成员,能够将机体内过多的活性氧及过氧化物分解为无害的水,降低其对细胞DNA的损害〔2,3〕。本实验分析GPX3基因启动子区甲基化程度及GPX3蛋白表达情况与胃癌临床病理特征间的关系。
1 资料与方法
1.1 一般资料 2012~2014年我院消化内科患者70例分为胃癌组35例,均为普外科行胃切除手术的患者,术前均未接受过放疗或化疗,其中男21例,女14例,年龄45~80岁,平均(65.65±4.34)岁。慢性胃炎组35例,均来自消化内科和内镜中心,其中男18例,女17例,年龄35~75岁,平均(60.35±4.54)岁。两组性别及年龄无统计学差异(P>0.05)。
1.2 血标本采集 抽取全血标本后立即于液氮罐转运,然后存放于-80℃冰箱储存待进一步检测。
1.3 组织标本采集 胃癌组分别取癌灶中央非坏死区域标本及与之配对的距离癌组织5 cm以上的区域作为癌组织标本及癌旁组织标本。慢性胃炎组通过胃镜活检留取胃黏膜组织标本。入选组织标本均经病理诊断证实。
1.4 GPX3基因启动子区甲基化的测定 按照OMEGA公司DNA提取试剂盒说明书对各组血标本提取DNA,然后对所提取DNA进行亚硫酸氢盐处理,再用甲基化特异性聚合酶链反应(MSP)处理结束后,所得产物经1.5%琼脂糖凝胶电泳,待DNA条带分离后于凝胶成像系统下拍照,分析实验结果。
1.5 GPX3蛋白表达的测定 石蜡标本连续切片后分别行苏木素-伊红(HE)染色、GPX3抗体免疫组织化学染色。采用双盲法分析显微镜下观察结果〔4〕:GPX3蛋白为细胞质棕黄色为阳性,不着色为阴性。阳性判定以阳性细胞数及染色强度综合判定。阳性细胞百分比计分按视野内阳性细胞所占总细胞数的比例,<5%为0分,6%~25%为1分,26%~50%为2分,≥51%为3分;染色强度不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。每张切片随机取5个400倍视野,二者相加,≤3分为阴性,>3分为阳性。
1.6 统计学方法 应用SPSS16.0统计软件进行χ2检验。
2 结 果
2.1 胃癌组与胃炎组血标本中GPX3甲基化程度的比较 胃癌组23例甲基化(65.71%);胃炎组10例甲基化(28.57%),差异显著(χ2=9.689,P=0.002)。
2.2 GPX3甲基化与胃癌临床病理特征的关系 见表1。胃癌伴有淋巴结转移者中GPX3甲基化率明显高于无淋巴结转移者(P<0.05)。GPX3甲基化程度与患者年龄、性别和胃癌的病理分化程度、浸润情况、TNM分期无关(P>0.05)。
2.3 胃癌及癌旁正常组织标本中GPX3蛋白表达的比较 胃癌组GPX3蛋白阳性表达(13/35,37.15%)明显低于癌旁正常组(23/35,65.71%)(χ2=5.719,P=0.015)。
2.4 GPX3蛋白表达与胃癌临床病理特征的关系 GPX3蛋白表达在胃癌伴有淋巴结转移组与无淋巴结转移组间差异显著(P=0.042)。GPX3蛋白表达与患者年龄、性别和胃癌分化程度、浸润情况、TNM分期等均无关(P>0.05),见表2。

表1 GPX3甲基化阳性与胃癌临床病理特征之间的关系〔n(%)〕
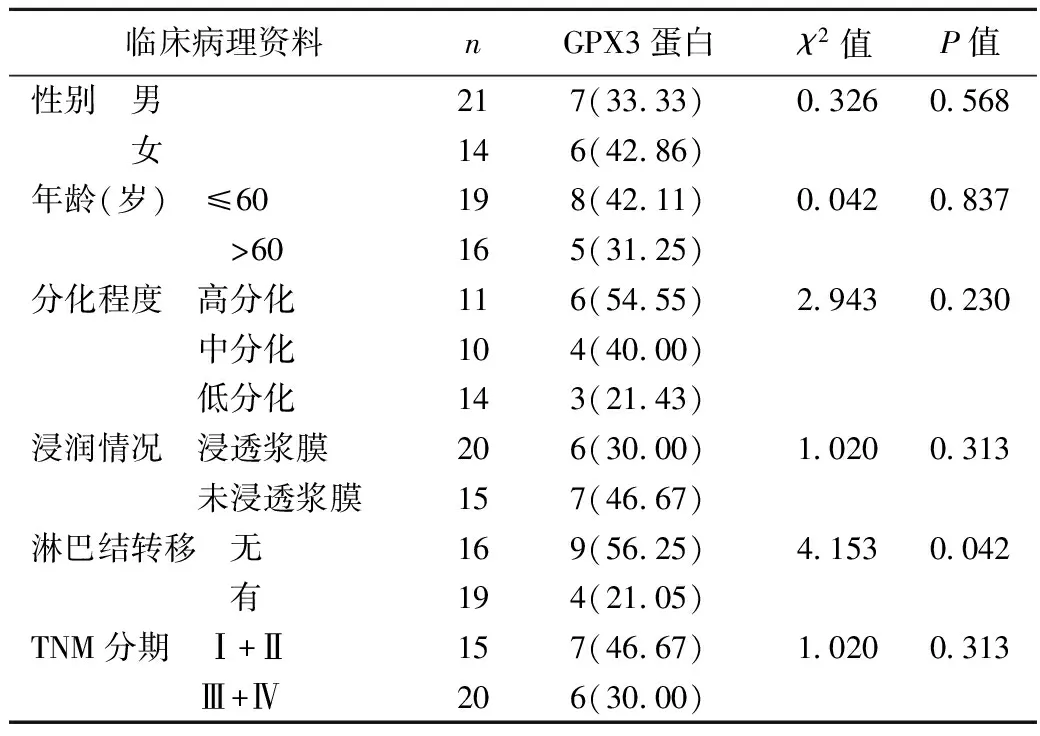
表2 GPX3蛋白表达与胃癌临床病理特征之间的关系〔n(%)〕
2.5 胃炎组及癌旁正常组中GPX3蛋白表达的比较 慢性胃炎组中GPX3蛋白阳性表达(26/35,74.29%)与癌旁正常组(23/35,65.71%)无明显差异(χ2=0.612,P=0.301)。
3 讨 论
GPX3表达异常与前列腺癌〔5〕、卵巢癌〔6〕、食管癌〔7,8〕、胃癌〔9〕、结肠癌〔10〕等多种恶性肿瘤的发生、发展存在密切联系,并提示其与GPX3基因启动子区高甲基化有关。本实验提示GPX3基因甲基化与胃癌发生存在一定的关联性。Wang等〔11〕指出,GPX3作为一个新被发现的抑癌基因,能够在体内外实验中激活P53可诱导基因(PIG)3,诱发细胞凋亡而发挥抑癌作用。据此推测,胃癌中的GPX3基因启动子区高甲基化可能通过下调该抑癌基因的表达发挥促癌作用。Peng等〔9〕研究发现,胃癌中GPX3基因启动子CpG岛呈现高甲基化,而在正常胃组织中甲基化程度明显下降,与本实验结果类似。本组结果提示GPX3启动子区的高甲基化促进了胃癌淋巴结转移,有潜力成为判断胃癌进展和预后的预警分子指标。Peng等〔9〕研究指出,胃癌GPX3的甲基化表达越高,其发生淋巴结转移的概率就越大。另据多项研究表明,多种miRNA的启动子区存在高甲基化现象,并与胃癌淋巴结转移密切相关〔12~15〕。
本文结果说明GPX3蛋白在控制胃腺体细胞恶变转化过程中发挥重要作用。推测相关机制是,GPX3基因启动子区高甲基化导致机体细胞中GPX3蛋白表达下调,其对过氧化物和活性氧自由基的清除能力随之下降,活性氧自由基的堆积加剧了对细胞DNA的损害,导致基因断裂、突变等一系列变化,促进机体细胞发生恶变〔16〕。GPX3在多种人类上皮来源恶性肿瘤中的表达降低,参与肿瘤的发病〔17,18〕。本研究结果提示GPX3蛋白在控制胃癌的淋巴结转移中发挥了一定的作用。Min等〔19〕研究指出,GPX3的缺失或低表达与胃癌淋巴结转移存在一定的相关性,与本实验结果一致。
综上,GPX3通过启动子区甲基化导致GPX3蛋白下调,使机体抗氧化能力下降,导致细胞DNA的损伤,从而促进胃癌的发生,参与胃癌的进展过程,其有潜力成为诊断胃癌、判断预后的预警分子指标,为胃癌临床治疗提供了新的基因调控靶点。
1 赫 捷,陈万青.2012中国肿瘤登记年报〔M〕.北京:军事医学科学出版社,2012;1:28-30.
2 Lin JC,Kuo WR,Hank Juo SH.Glutathione peroxidase 3 gene polymorphisms and risk of differentiated thyroid cancer 〔J〕.Surgery,2009;145(5):508-13.
3 沈 磊,贺远龙,张巍巍,等.GPX3表达与消化系肿瘤关系的研究进展〔J〕.临床与实验病理学杂志,2014;30(6):670-2.
4 邢传平,刘 斌,董 亮.免疫组织化学标记结果的判断方法〔J〕.中华病理学杂志,2001;3(4):318.
5 Agnani D,Camacho-Vanegas O,Camacho C,etal.Decreased levels of serum glutathione peroxidase 3 are associated with papillary serous ovarian cancer and disease progression〔J〕.J Ovarian Res,2011;4:18-21.
6 Falck E,Karlsson S,Carlsson J,etal.Loss of glutathione peroxidase 3 expression is correlated with epigenetic mechanisms in endometrial adenocarcinoma〔J〕.Cancer Cell Int,2010;10:46-9.
7 He Y,Wang Y,Li P,etal.Identification of GPX3 epigenetically silenced by CpG methylation in human esophageal squamous cell carcinoma〔J〕.Dig Dis Sci,2011;56(3):681-8.
8 沈 磊,贺远龙,张巍巍,等.血浆型谷胱甘肽过氧化物酶在食管鳞癌中的表达及临床意义〔J〕.世界华人消化杂志,2013;21(30):3252-7.
9 Peng DF,Hu TL,Schneider BG,etal.Silencing of glutathione peroxidase 3 through DNA hypermethylation is associated with lymph node metastasis in gastric carcinomas〔J〕.PLoS One,2012;7(10):e46214.
10 Barrett CW,Ning W,Chen X,etal.Tumor suppressor function of the plasma glutathione peroxidase GPX3 in colitis-associated carcinoma〔J〕.Cancer Res,2013;73(3):1245-55.
11 Wang HW,Katherine L,Jian HL,etal.p53-induced-gene 3 mediates cell death induced by glutathione peroxidase 3〔J〕.J Bio Chem,2012;287(20):900-2.
12 Gao C,Zhang Z,Liu W,etal.Reduced microRNA-218 expression is associated with high nuclear factor kappa B activation in gastric cancer〔J〕.Cancer,2010;116(1):41-9.
13 Takagi T,Iio A,Nakagawa Y,etal.Decreased expression of microRNA-143 and -145 in human gastric cancers〔J〕.Oncology,2009;77(1):12-21.
14 Luo H,Zhang H,Zhang Z,etal.Down regulated miR-9 and miR-433 in human gastric carcinoma〔J〕.J Exp Clin Cancer Res,2009;28(16):28-82.
15 Tsujinura M,Ichikawa D,Komatsu S,etal.Circulating microRNAs in plasma of patients with gastric cancers〔J〕.Br J Cancer,2010;102(7):1174-9.
16 Worthley DL,Whitehall VL,Buttenshaw RL,etal.DNA methylation within the normal colorectal mucosa is associated with pathway-specific predisposition to cancer〔J〕.Oncogene,2010;29(11):1653-62.
17 Chen BS,Rao X,House MG,etal.GPx3 promoter hypermethylation is a frequent event in human cancer and is associated with tumorigenesis and chemotherapy response〔J〕.Cancer Lett,2011;309:37-45.
18 Zhang X,Yang JJ,Kim SY,etal.An 8-gene signature,including methylated and down-regulated glutathione peroxidase 3,of gastric cancer〔J〕.Int J Oncol,2010;36(2):405-14.
19 Min SY,Kim Hs,Jung EJ,etal.Prognostic significance of glutathione peroxidase 1 (GPX1)down-regulation and correlation with aberrant promoter methylation in human gastric cancer〔J〕.Anticancer Res,2012;32(8):3169-75.
〔2015-01-19修回〕
(编辑 苑云杰)
于卫芳(1973-),男,硕士,主任医师,主要从事消化道肿瘤研究。
范红云(1975-),女,硕士,主治医师,主要从事胃肠病研究。
R735.3
A
1005-9202(2016)22-5634-03;
10.3969/j.issn.1005-9202.2016.22.064
1 河北医科大学第一医院内镜中心

