体外传代选择对鼠衣原体质粒缺失株培养特性的影响
, ,,,,*
(1.南华大学医学免疫学教研室/病原生物学研究所,湖南 衡阳 421001;2.南华大学附属第一医院检验科;3.南华大学病原生物学研究所; 4.Department of Microbiology and Immunology,UTHSCSA,USA)
·基础医学·
体外传代选择对鼠衣原体质粒缺失株培养特性的影响
陈超群1,任林2,陆春雪1,李忠玉3,钟光明4,吴移谋3*
(1.南华大学医学免疫学教研室/病原生物学研究所,湖南 衡阳 421001;2.南华大学附属第一医院检验科;3.南华大学病原生物学研究所; 4.Department of Microbiology and Immunology,UTHSCSA,USA)
目的探讨传代选择对鼠衣原体质粒缺失株CMUT3菌株培养特性的影响及其相应机制。方法采用“无辅助感染”和“辅助感染”交替方式体外传代培养CMUT3菌株,而后观察传代菌株和亲代感染细胞时的吸附效率以及对离心因素的依赖性,并利用下一代测序技术对传代菌株CMUT3G40和亲代CMUT3G0进行全基因组测序分析。结果传代菌株CMUT3G40在感染HeLa细胞时对离心因素依赖性降低,吸附试验表明CMUT3G40菌株对细胞的吸附能力增强;比较基因组学分析结果表明CMUT3G40菌株与亲代CMUT3G0在tc0237基因存在差异,TC0237Q117E错义突变出现于CMUT3G40菌株基因组(CMUT3G40,99.7%;CMUT3G0,0%)。结论通过体外传代培养CMUT3菌株可获得吸附能力增强的菌株,该表型与传代选择所致的TC0237Q117E密切相关。
鼠衣原体; 质粒; 体外传代; 选择压力; 下一代测序
鼠衣原体(Chlamydia muridarum,CM),与沙眼衣原体(C.trachomatis,Ct)相似,是一种严格细胞内寄生、具有独特发育周期的原核细胞型微生物,归属于衣原体科中的衣原体属,在宿主细胞内增殖可观察到原体(elementary body,EB)和始体两种不同形态。CM的自然宿主为鼠类,可经呼吸道、消化道和生殖道等途径感染宿主产生多种疾病;CM不感染人类,不引发任何已知的人类疾病。CM因其基因组与沙眼衣原体D血清型同源性高,同时小鼠生殖道CM感染模型可造成输卵管积水等病变,这与女性生殖道Ct感染所引起的疾病相似,因而在衣原体学研究领域CM已广泛应用于病原性衣原体致病机制和疫苗开发研究中[1-3]。
衣原体全基因组测序和注释工作发现多种衣原体拥有一个大小为7.5 kb的质粒[4-6],质粒关联多种表型,如糖原聚积、调控染色体上多个基因的表达,此外质粒也是衣原体的一种重要毒力因子[4,7];在自然状况下,衣原体菌株丢失质粒的情形比较少见,若质粒缺失则表现为毒力减弱,可发展为衣原体减毒活疫苗:沙眼衣原体A血清型质粒缺失菌株感染非人灵长类动物恒河猴结膜上皮细胞后并不导致疾病而可诱导宿主产生保护性免疫[8],CM质粒缺失株生殖道感染实验小鼠并未诱导输卵管积水等病理变化[9]。与质粒携带菌株相比,CM质粒缺失株在生物学性状上表现为包涵体内糖原聚积障碍、糖原合酶表达或分泌水平下降[9-11];为进一步认识质粒缺失菌株对外环境的适应情形,本研究基于巴斯德选择(Pasteurian selection)[12]采用“无辅助感染”和“辅助感染”交替方式对CMUT3菌株进行体外传代培养,比较传代菌株和亲代的培养特性变化,借助下一代测序(next generation sequencing,NGS)技术来探寻与表型相关联的基因型。
1 材料与方法
1.1主要试剂和材料
1.1.1 衣原体菌株和细胞 CM质粒携带菌株由美国得州大学圣安东尼奥健康科学中心(UTHSCSA)钟光明教授实验室传代保存;质粒缺失株CMUT3菌株,系采用新生霉素处理CM、结合噬斑形成实验和以质粒基因编码蛋白-3(plasmid gene protein 3,Pgp3)为检测对象的间接免疫荧光法(indirect immunofluorescence assay,IFA)筛选与鉴定[11]。HeLa细胞,购自ATCC。
1.1.2 主要试剂 DMEM培养基购自Sigma公司,胎牛血清(fetal bovine serum,FBS)购自Gemini Bio公司,放线菌酮购自Sigma-Aldrich公司;兔抗CM多克隆抗体(编号为#1064)由钟光明教授实验室制备并保存;Cy2标记的羊抗兔IgG二抗购自Jackson ImmunoResearch公司,蛋白酶购自Life technologies公司,QIAamp DNA抽提试剂盒购自QIAGEN公司。
1.1.3 主要仪器 Olympus AX-70荧光显微镜,Optima L-100 XP超速离心机。
1.2方法
1.2.1 CMUT3菌株的体外传代培养 参考文献[13]进行,第一代采用“无辅助感染”方法,DMEM培养基洗涤24孔板中的单层HeLa细胞,加入CUMT3原代(generation 0,以CMUT3G0表示)感染液,每孔200 μL,37 ℃放置2 h后吸弃感染液,加入1 mL衣原体培养液(DMEM培养基,10%FBS,2 mg/L放线菌酮),37 ℃、5% CO2培养箱培养24~28 h,收集感染细胞于含玻璃珠和100 μL SPG缓冲液的离心管,振荡裂解细胞,此即传代的第一代(以CMUT3G1表示)。随后采用“辅助感染”方法进行下一次感染,DMEM培养基洗涤HeLa细胞,每孔加入0.5 mL含30 mg/L DEAE-葡聚糖的DMEM培养基,37 ℃放置10 min预处理HeLa细胞后加入CMUT3G1感染液200 μL,37 ℃放置30 min,补加1 mL DMEM培养基后室温1000 r/min离心1 h,然后弃去接种液后加入1 mL衣原体培养液,培养24~28 h后收集感染细胞,此即传代的第二代(以CMUT3G2表示)。第三代的感染方法与第一代相同,第四代的感染方法同第二代,依此类推,按上述“无辅助感染”和“辅助感染”交替方式连续传代培养至第40代,随后通过噬斑形成实验分离得到CMUT3G40的单个噬斑,扩大培养后大规模感染HeLa细胞,密度梯度离心法分离纯化EB。
1.2.2 离心因素对CM培养生长特性的影响分析 预冷DMEM培养基稀释CMUT3G40、CMUT3G0和CMG0的EB,DMEM培养基洗涤24孔板(放置有灭菌的圆形盖玻片)的单层HeLa细胞,每孔加200 μL EB稀释液(每份样品设置复孔,分别加样于两块培养板内),加样结束后培养板转移至37 ℃培养箱,采用两种条件进行后续试验:其一“无辅助感染”条件,37 ℃放置2 h后吸弃感染液,每孔加入1 mL衣原体培养液,CO2培养箱培养24 h;其二离心“辅助感染”条件,培养板于37 ℃放置1 h,每孔补加DMEM培养基1 mL后室温1000 r/min离心1 h,弃去孔内感染液,每孔加入衣原体培养液继续培养24 h。然后采用4%多聚甲醛固定和0.1% Trixton-100透膜打孔处理,洗涤后用4% BSA封闭,兔抗CM一抗37 ℃孵育1 h;Cy2标记的羊抗兔IgG二抗,Hoechst标记细胞核,37 ℃孵育1 h进行免疫荧光检测,荧光显微镜下进行包涵体计数,每张盖玻片随机取5个视野计数,根据公式推算衣原体的数量,以包涵体形成单位(inclusion forming unit,IFU)表示(IFU/mL=5个视野的平均包涵体数目×视野校正因子×稀释倍数),进一步计算IFU比值(即同一菌株离心“辅助感染”条件下的IFU平均值对“无辅助感染”条件下IFU平均值的比例);实验重复五次,IFU比值以均数±标准差表示。
1.2.3 吸附试验 CMUT3G40和CMUT3G0的EB感染24孔板中单层HeLa细胞,参考文献[13]进行:预冷DMEM培养基对EB进行适当稀释以确保CMUT3G40和CMUT3G0的EB量(IFU数值)相当,预冷DMEM培养基洗涤单层HeLa细胞,每孔加入EB稀释液200 μL,培养板置于4 ℃孵育1 h,随后吸弃衣原体感染液,预冷DMEM培养基充分洗涤细胞,按前述方法进行IFA,荧光显微镜观察计数EB数量,每张盖玻片随机选取5个视野计数,计数每个视野的EB和细胞数量,换算为视野中EB数量对细胞数量的比例。实验重复三次(实验结果以均值±标准差表示)。
1.2.4 CM基因组DNA的提取 将CMUT3G40、CMUT3G0和CMG0的EB感染细胞后扩大培养,大规模感染培养于6孔板的HeLa 细胞,按前述“辅助感染”方法采用DEAE-葡聚糖预处理单层HeLa细胞和室温1000 r/min离心1 h的方法进行衣原体感染,离心结束后吸弃感染液,加入4 mL衣原体培养液后继续培养24~28 h,PBS洗涤细胞后胰蛋白酶消化并收获感染HeLa细胞,4 ℃下500×g离心10 min收集细胞沉淀,PBS重悬,冰上超声裂菌,裂解物4 ℃下500×g 离心10 min去除较大的细胞残骸,上清液于4℃下14 000 r/min离心30 min,细胞沉淀物重悬于PBS中,再次超声裂菌,加入RNaseA和 DNaseⅠ后于37 ℃孵育1 h以去除宿主细胞DNA和RNA,转移上清至超速离心管,密度梯度离心法分离纯化EB,PBS洗涤后EB置于含100 mg/L 蛋白酶K的EB裂解缓冲液 (10 mmol/L Tris-HCl,pH 8.0,1 mmmol/L EDTA,0.1% TritonX-100,0.5% SDS)中50 ℃孵育过夜,参考操作说明,QIAamp DNA抽提试剂盒提取CM基因组DNA,4 ℃保存备用。
1.2.5 基因组测序、注释和生物信息学分析 采用Illumina Hiseq2000测序技术平台完成CMUT3G40、CMUT3G0和CMG0的基因组深度测序,由UTHSCSA格里希儿童癌症研究中心(GCCRI)基因组测序小组完成;其实验步骤如下:使用Covaris S220超声波破碎仪超声打断基因组DNA而形成DNA片段,随后采用TruSeq DNA样品制备试剂盒构建 DNA-Seq 测序文库,DNA-Seq测序文库在Illumina Hiseq2000平台采用50 bp的单端测序模块进行测序,测序得到的原始数据经过CASAVA程序分用(demultiplexing)后,序列读取信息采用FASTQ格式输出,利用BWA-MEM计算程序[14]与CM染色体基因组参考序列(GenBank accession No.NC_002620.2)和质粒基因序列(NC_002182.1)进行比对分析,此时产生的SAM(Sequence alignment map)文件转换成BAM(Binary aligment map)格式,利用Samtools[15]排序。插入和缺失(indels)使用默认参数的基因组分析工具包(Genome analysis toolkit)[16]进行重新排列。随后参考文献方法对所有突变及对应的基因、蛋白进行数据处理与分析[13]。
1.3统计方法采用Kruskal-Wallis检验方法进行检验,P<0.05表示差异有统计学意义。
2 结 果
2.1离心因素对CM体外培养的影响CMUT3G0菌株感染宿主细胞时在离心“辅助感染”条件下较“无辅助感染”条件形成较多包涵体,IFU比值在70左右,与质粒携带菌株CMG0的 IFU比值(40左右) 比较,二者差异有统计学意义(图1)。传代菌株CMUT3G40在离心“辅助感染”条件下包涵体形成情形与“无辅助感染”条件下差距不大,IFU比值在6左右,与CMG0菌株或CMUT3G0菌株的IFU比值比较,差异有统计学意义(图1)。
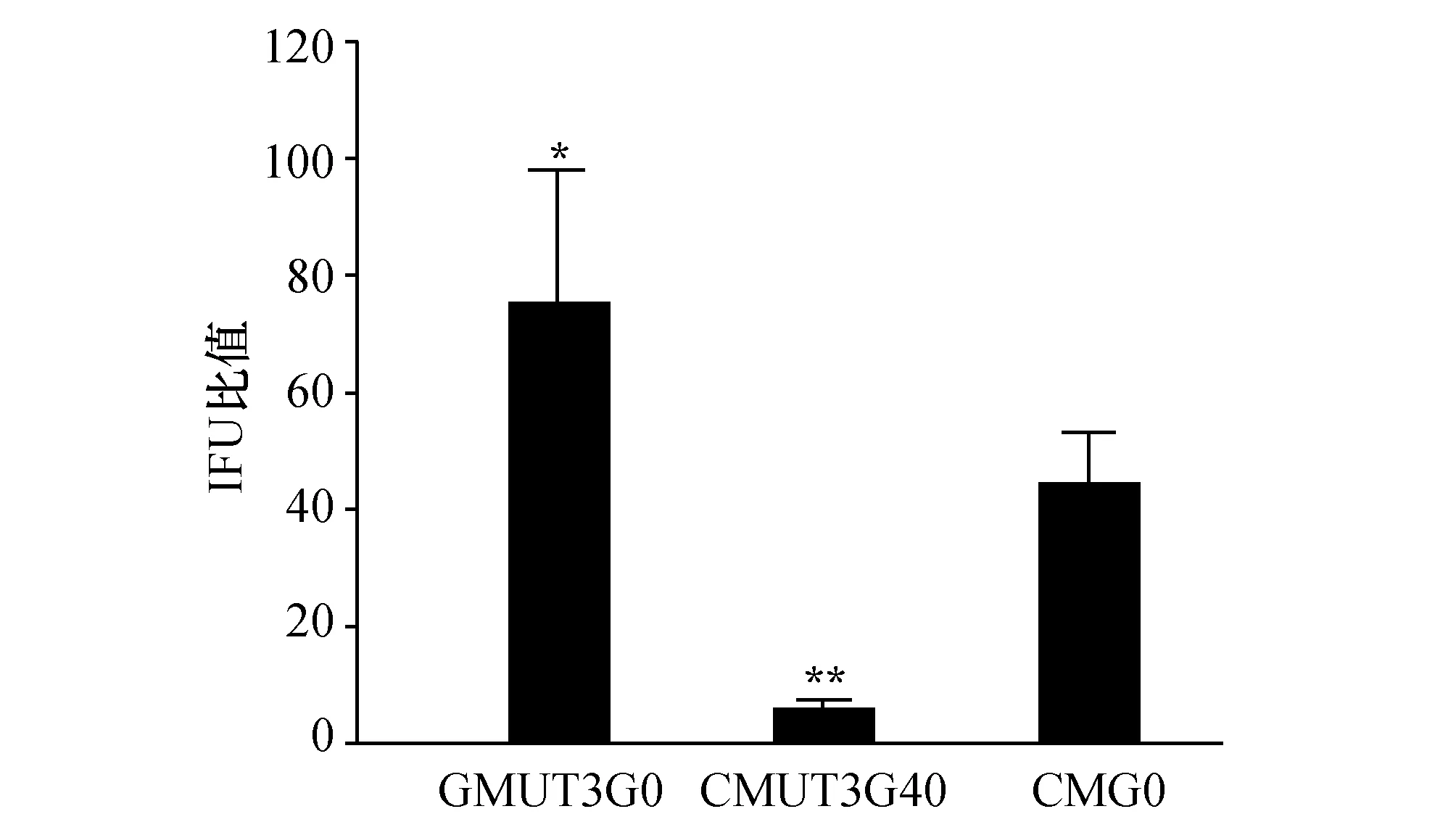
图1 离心因素对CM体外培养的影响 CMUT3G0与CMG0相比,*:P<0.05;CMUT3G40与CMG0或CMUT3G0比较,**:P<0.01
2.2吸附情况分析比较CMUT3G40菌株和CMUT3G0菌株等量EB对HeLa细胞的吸附能力,EB与HeLa细胞在4 ℃条件下孵育1 h后,HeLa细胞表面有较多CMUT3G40的EB,与CMUT3G0比较差异有统计学意义(图2),提示传代菌株CMUT3G40对HeLa细胞有较好的吸附能力。
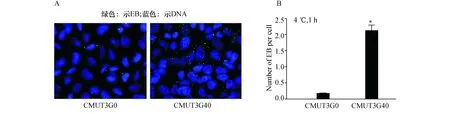
图2 CMUT3对HeLa细胞的吸附力分析 A:IFA检测CMUT3对HeLa细胞的吸附情况(×1000);B:统计学分析(与CMUT3G0比较,*:P<0.01)
2.3全基因组测序结果分析以CM染色体基因组参考序列(GenBank accession No.NC_002620.2)和质粒基因序列(NC_002182.1)为参照,质粒携带菌株CMG0的质粒基因序列与参考质粒基因序列完全一致,染色体基因也基本一致(tc0412基因在CMG0中存在多种突变类型)。与CMG0比较,质粒缺失株CMUT3G0表现为质粒基因缺失,染色体基因tc0412的主要类型为“-472842 T”插入突变(频率为96%)。比较基因组学分析传代菌株CMUT3G40和亲代CMUT3G0,二者的差别在于染色体基因tc0237,在CMUT3G40的基因组中tc0237基因存在点突变,即第277313位碱基由“G”变成“C”,相对应的氨基酸由TC0237的117位谷氨酰胺(Q)突变为谷氨酸(E),而TC0237Q117E的突变现象并未发生于CMUT3G0(表1)。
表1质粒缺失株CMUT3在选择压力的核苷酸突变
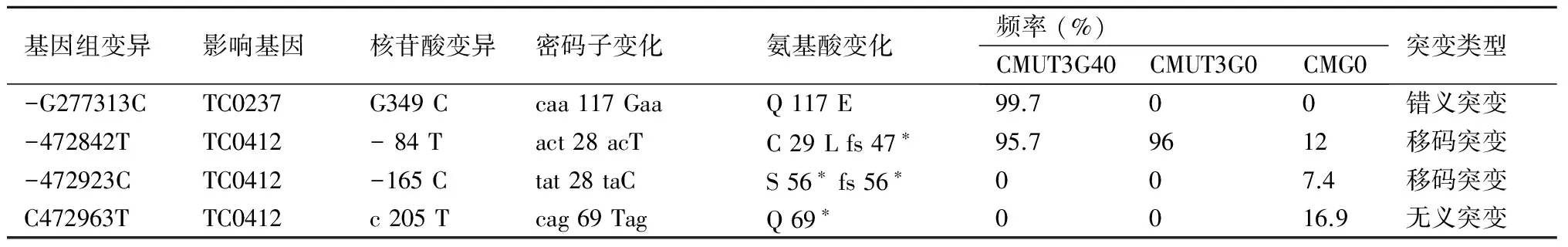
基因组变异影响基因核苷酸变异密码子变化氨基酸变化频率(%)CMUT3G40CMUT3G0CMG0突变类型-G277313CTC0237G349Ccaa117GaaQ117E99.700错义突变-472842TTC0412-84Tact28acTC29Lfs47∗95.79612移码突变-472923CTC0412-165Ctat28taCS56∗fs56∗007.4移码突变C472963TTC0412c205Tcag69TagQ69∗0016.9无义突变
fs:移码突变,*:终止信号
3 讨 论
衣原体缺乏主动穿入宿主细胞的能力,在体外培养过程离心通过促使衣原体与细胞接触而有利于衣原体进入细胞,DEAE-葡聚糖可通过改变细胞表面电荷而促进衣原体与宿主细胞更好地接触,从而提高其感染率;多年来,离心和DEAE-葡聚糖预处理宿主细胞这两种“辅助感染”手段一直被用来最大限度地提高衣原体的感染率,并借此传代培养并保存衣原体菌种。上述培养方式,除了标准化的养分供应及宿主细胞来源差异,不存在其他的选择压力,因此各实验室保存的衣原体菌株基因组相对稳定;但突变总是存在的,并随着时间的推移而累积[17],探寻这些基因突变及与之相关联的表型,不仅可规范不同实验室的标准菌株,使各实验室的实验结果具有可比性,而且可能为深入研究衣原体生物学特性奠定基础。
设置选择压力,可有效关联基因突变与表型改变的关系。沙眼衣原体D血清型阴道感染C3H/HeJ小鼠后,部分小鼠在感染后49天左右才能终止排菌,部分小鼠却在感染后23天左右完全清除衣原体,分离培养上述两种不同表型的Ct(分别命名为D-LC和D-EC),研究发现上述表型与ct153基因的移码突变有关[18],以上结果表明Ct在体内培养过程中,某些基因可以发生突变,这种发生突变的衣原体菌株可以被累积并被分离培养出来。
本研究采用“无辅助感染”和“辅助感染”交替方式对CMUT3菌株进行体外传代培养,这种人为因素造成的选择压力可促进高吸附力衣原体菌株的富集及分离。实验室新分离的质粒缺失株CMUT3菌株在体外培养过程中明显依赖于离心“辅助感染”因素,在离心条件下CMUT3菌株易与宿主细胞接触,进而感染宿主细胞形成较多包涵体;传代菌株CMUT3G40对离心因素的依赖程度显著降低,同时对HeLa细胞的吸附能力显著提高;这一表型变化对CMUT3菌株而言意义重要,作为候选疫苗,吸附能力增强的CMUT3菌株能更好地模拟自然条件下CM菌株感染宿主细胞的情形;然而吸附能力改变这一表型是否涉及基因型的改变需要进一步认识。全基因组测序及分析为揭示表型-基因型关联提供可能,通过NGS技术对CMG0、CMUT3G0和CMUT3G40菌株进行全基因组测序,比较基因组学分析表明,在CMUT3G40菌株中,存在着TC0237Q117E的突变,而在CMUT3G0以及CMG0菌株不存在TC0237Q117E突变类型。
TC0237蛋白由159个氨基酸组成,含一个未知功能结构域-720(DUF720)的基序,这一基序也见于邻近的TC0236蛋白(172 aa)和TC0235蛋白(170 aa)中,这三种蛋白质是同源的、由同一个操纵子编码。TC0237、TC0236和TC0235在衣原体中高度保守,在沙眼衣原体D血清型与之对应的同源物是CT849、CT848和CT847。已有研究[19]表明TC0236Q119K置换突变可增强CM在细胞培养中的感染力和在小鼠下生殖道组织中的感染性,但目前还不清楚这是否有助于致病性的提高。结合本实验结果,TC0237或TC0236蛋白可能参与了CM与宿主细胞的相互作用,其中某些位点的突变如TC0237Q117E可增强CMUT3菌株对宿主细胞的吸附能力。对比分析TC0237/TC0237Q117E蛋白的空间构象,可为宿主细胞中对应靶标分子的探寻提供依据从而进一步明确CM的粘附机制。
[1] Farris CM,Morrison RP.Vaccination against Chlamydia genital infection utilizing the murine C.muridarum model[J].Infect Immun,2011,79(3):986-996.
[2] Li Z,Lu C,Peng B,et al.Induction of protective immunity against Chlamydia muridarum intravaginal infection with a chlamydial glycogen phosphorylase[J].PLoS One,2012,7(3):e32997.
[3] Chen J,Yang Z,Sun X,et al.Intrauterine infection with plasmid-free Chlamydia muridarum reveals a critical role of the plasmid in chlamydial ascension and establishes a model for evaluating plasmid-independent pathogenicity[J].Infect Immun,2015,83(6):2583-2592.
[4] Rockey DD.Unraveling the basic biology and clinical significance of the chlamydial plasmid[J].J Exp Med,2011,208(11):2159-2162.
[6] Carlson JH,Whitmire WM,Crane DD,et al.The Chlamydia trachomatis plasmid is a transcriptional regulator of chromosomal genes and a virulence factor[J].Infect Immun,2008,76(6):2273-2283.
[7] Song L,Carlson JH,Whitmire WM,et al.Chlamydia trachomatis plasmid-encoded Pgp4 is a transcriptional regulator of virulence-associated genes[J].Infect Immun,2013,81(3):636-644.
[8] Kari L,Whitmire WM,Olivares-Zavaleta N,et al.A live-attenuated chlamydial vaccine protects against trachoma in nonhuman primates[J].J Exp Med,2011,208(11):2217-2223.
[9] Lei L,Chen J,Hou S,et al.Reduced live organism recovery and lack of hydrosalpinx in mice infected with plasmid-free Chlamydia muridarum[J].Infect Immun,2014,82(3):983-992.
[10] O’Connell CM,Nicks KM.A plasmid-cured Chlamydia muridarum strain displays altered plaque morphology and reduced infectivity in cell culture[J].Microbiology,2006,152(Pt 6):1601-1607.
[11] Chen C,Zhong G,Ren L,et al.Identification of plasmid-free Chlamydia muridarum organisms using a Pgp3 detection-based immunofluorescence assay[J].J Microbiol Biotechnol,2015,25(10):1621-1628.
[12] Hanley KA.The double-edged sword:how evolution can make or break a live-attenuated virus vaccine[J].Evolution (N Y),2011,4(4):635-643.
[13] Chen C,Zhou Z,Conrad T,et al.In vitro passage selects for Chlamydia muridarum with enhanced infectivity in cultured cells but attenuated pathogenicity in mouse upper genital tract[J].Infect Immun,2015,83(5):1881-1892.
[14] Li H,Durbin R.Fast and accurate short read alignment with Burrows-Wheeler transform[J].Bioinformatics,2009,25(14):1754-1760.
[15] Li H,Handsaker B,Wysoker A,et al.The sequence alignment/map format and SAMtools[J].Bioinformatics,2009,25(16):2078-2079.
[16] DePristo MA,Banks E,Poplin R,et al.A framework for variation discovery and genotyping using next-generation DNA sequencing data[J].Nat Genet,2011,43(5):491-498.
[17] Ramsey KH,Sigar IM,Schripsema JH,et al.Strain and virulence diversity in the mouse pathogen Chlamydia muridarum[J].Infect Immun,2009,77(8):3284-3293.
[18] Sturdevant GL,Kari L,Gardner DJ,et al.Frameshift mutations in a single novel virulence factor alter the in vivo pathogenicity of Chlamydia trachomatis for the female murine genital tract[J].Infect Immun,2010,78(9):3660-3668.
[19] Russell M,Darville T,Chandra-Kuntal K,et al.Infectivity acts as in vivo selection for maintenance of the chlamydial cryptic plasmid[J].Infect Immun,2011,79(1):98-107.
EffectofInvitroPassagewithSelectionPressureonFitnessofPlasmid-freeChlamydiaMuridarumStrainCMUT3
CHEN Chaoqun,REN Lin,LU Chunxue,et al
(DepartmentofMedicalImmunology,InstituteofPathogenicBiology,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo unravel the effect of passage selection pressure on fitness of plasmid-free Chlamydia muridarum strain CMUT3 and uncover the correlation between genetic and phenotypic signatures.MethodsCMUT3 organisms were in vitro passaged for 40 generations under the alternating unassisted/assisted-infection cycle conditions and the infectivity of initial and final generation organisms in cell culture was measured by comparing their attachment efficiency phenotype in the presence or absence of centrifugation.Next-generation sequencing technology was then used to sequence the genomes of passaged CMUT3G40 and the parental CMUT3G0.ResultsPassaged CMUT3G40 organisms became less dependent on centrifugation and more efficient for infecting HeLa cells in the absence of centrifugation compared to the parental CMUT3G0.Comparative genomes analysis of CMUT3G40 and CMUT3G0 revealed that a G to C substitution at position 277313,resulting in a glutamine to glutamic acid amino acid change in the protein product of TC0237 (99.7% in CMUT3G40 versus 0% in CMUT3G0 genomes).ConclusionThe TC0237Q117E missense mutation under in vitro passage selection pressure can be attributed to an in vitro attachment enhancement phenotype of plasmid-free C.muridarum CMUT3 organisms.
Chlamydia muridarum; plasmid; in vitro passage; selection pressure; next generation sequencing
10.15972/j.cnki.43-1509/r.2016.04.007
2016-03-20;
2016-06-13
国家自然科学基金(81072417).
*通讯作者,E-mail:yimouwu@sina.com.
R374.3
A
蒋湘莲)

