1,25-二羟维生素D3对棕榈酸诱导巨噬细胞炎症因子表达的影响
, ,, , ,, ,*
(1.南华大学医学院诊断学教研室,湖南 衡阳 421001;2.南华大学心血管疾病研究所)
·基础医学·
1,25-二羟维生素D3对棕榈酸诱导巨噬细胞炎症因子表达的影响
陈雯1,朱肖2,冯聚玲1,李熠1,游咏1,桂庆军1,尹凯1,2*
(1.南华大学医学院诊断学教研室,湖南 衡阳 421001;2.南华大学心血管疾病研究所)
目的研究1,25-二羟维生素D3(1,25(OH)2D3)对棕榈酸(PMA)诱导THP-1巨噬细胞炎症因子表达的影响及其机制。方法用1,25(OH)2D3(10 nmol/L)和/或PMA(250 μmol/L)处理THP-1巨噬细胞6 h,采用荧光定量PCR和酶联免疫吸附法(ELISA)法检测肿瘤坏死因子α(TNFα)、白细胞介素(IL)-1β、IL-6和IL-10的表达水平;用1,25(OH)2D3和/或PMA处理THP-1巨噬细胞60 min,采用免疫印迹(Western-blot)法检测AMPKα1和磷酸化AMPKα1(p-AMPKα1)水平。结果1,25(OH)2D3(10 μmol/L))明显抑制PMA(250 μmol/L)作用下THP-1巨噬细胞TNFα、IL-1β和IL-6的表达,并上调IL-10的表达;1,25(OH)2D3显著上调THP-1巨噬细胞AMPKα1的磷酸化水平。结论1,25(OH)2D3抑制PMA诱导的THP-1巨噬细胞炎症因子表达,该效应可能与其激活AMPKα1有关。
1,25-二羟维生素D3; 棕榈酸; 巨噬细胞; 炎症反应
维生素D(Vitamin D,VD)是一种脂溶性维生素,主要由皮肤合成和食物摄取。近来研究发现,VD不仅参与调节体内钙磷代谢,其水平还与多种慢性炎症疾病,如肥胖、2型糖尿病和动脉粥样硬化(Atherosclerosis,As)等的发生呈显著负相关,提示VD可能对体内代谢性因素引起的慢性炎症具有重要的调节作用[1]。VD进入血液后,经肝脏25-羟化酶和肾脏共同作用转化为具有活性的1,25-二羟维生素D3(1,25-dihydroxyvitamin D3,1,25(OH)2D3)。研究报道1,25(OH)2D3能够抑制脂多糖(LPS)诱导的急性炎症反应[2]。本实验组前期发现,1,25(OH)2D3能够调节THP-1巨噬细胞源性泡沫细胞胆固醇流出,并促进IL-4诱导的巨噬细胞M2型极化[3]。血清游离脂肪酸(Free fat acid,FFA)水平升高是肥胖和2型糖尿病的主要脂质代谢紊乱特征,然而1,25(OH)2D3是否调节FFA诱导的巨噬细胞炎症尚不明确。本研究拟探讨1,25(OH)2D3对棕榈酸(PMA)诱导的THP-1巨噬细胞炎症因子表达的影响和机制,为进一步研究VD与慢性代谢性疾病的关系提供理论依据。
1 材料与方法
1.1主要试剂棕榈酸购自Sigma公司;1,25(OH)2D3购自美国Peprotech公司;人单核细胞株(THP-1)购自中科院上海细胞生物所细胞中心;RPMI-1640培养基购自美国Gibco公司;胎牛血清和小牛血清购自杭州四季清生物工程材料有限公司;兔抗人AMPKα1单克隆抗体和兔抗人AMPKα1 (phospho T172)多克隆抗体购自ABCam公司;小鼠抗人GAPDH单克隆抗体购自康成生物科技公司;辣根过氧化物酶标记的羊抗小鼠二抗购自武汉博士德公司;TNFα、IL-1β、IL-6和IL-10 ELISA试剂盒购自R&D Systems公司;引物均由上海生物工程公司合成;其他试剂均为进口或国产分析纯。
1.2细胞培养人单核细胞株(THP-1)用含10%胎牛血清的RPMI-1640培养液,在37 ℃、5%CO2培养箱中静置培养。培养液中加10 mmol/L的羟乙基哌秦乙硫磺酸(HEPES)和青霉素、链霉素各1.0×105U/L。在每次实验前用160 nmol/L佛波酯(PMA)孵育THP-1细胞12 h,使其诱导分化成巨噬细胞。
1.3实时定量PCR 将1 μg总RNA用逆转录试剂盒(Fermentas)反转录成20 μL cDNA。采用应用生物系统7900HT(Applied Biosystems 7900HT Fast Real-Time PCR System)进行实时定量PCR,试剂盒为FINNZYMES公司的DyNAmoTMSYBR®Green qPCR Kits。扩增混合体系包括:去离子水13.5 μL,Master Mix 15 μL,cDNA 1μL,Primer 0.5 μL,共30 μL。溶解曲线分析表明PCR反应产物为单独的双链DNA。用ΔΔCt值法,以GAPDH表达为内参定量其它基因的表达。人TNFα引物序列为:上游 5′-CAGAGGGAATTCC CCAG-3′,下游:5′-CCTTGGTCTGGTAGGAGACG-3′;人IL-1β引物序列为:上游 5′-ATGGCACAAGTACCTAAGCTCGC-3′,下游:5′-ACACAAATTGCATGGTGAAGTC AGTT-3′;人IL-6引物序列为:上游 5′-ATGAACTCCTTCTCCACAAGCGC-3′,下游:5′-GAAGAGCCCTCAGGCTGGACTG-3′;人IL-10引物序列为:上游 5′-GACTCCAA GAGA AAGGCATCTAC-3′,下游:5′-CCCTGATGTCTCAGTTTCGTATC-3′;人GAPDH引物序列:上游 5′-GGTGTGAACCATGAGAAGTATGA-3′,下游 5′-GAGTCC TTCCACGATACCAAAG-3′。
1.4 ELISA法检测炎症因子表达THP-1细胞以5×104个/孔接种于96孔板,以含10%的胎牛血清(FCS)培养,诱导分化为巨噬细胞。按不同处理因素进行处理,处理前加无血清培养基,处理后收集培养基,存储于-20 ℃冰箱备用。按说明书方法,将100 μL样品和标准品加入板孔,盖上封板膜,室温孵育1~2 h。扣去孔内液体,重复洗板3次。加入50~100 μL生物素标记抗体,孵育1~2 h。扣去孔内液体,又重复洗板3次。加入抗生物素蛋白链菌素-HRP,室温孵育30 min。重复洗板3次后,加入显色剂,室温孵育10~20 min。终止反应后,用450 nm波长读值。
1.5 Western-blot技术检测AMPKα1和p-AMPKα1表达将收集好的细胞进行裂解,于4 ℃离心10 min,弃除沉淀,用BCA法进行蛋白质定量。上样缓冲液调各组蛋白量一致,经SDS-聚丙烯酰胺凝胶(AnyKD),100 mV电泳2 h后转移(4 ℃,100 mA,2 h)至PVDF膜上,丽春红染色观察转移效果,并确定蛋白分子量标准的位置。用含5%脱脂奶粉的TBST封闭液封闭2 h,按1∶500加入兔抗人AMPKα1或p-AMPKα1或GAPDH(1∶1000)一抗,4 ℃培育过夜,TBST洗三次,1∶1000 加入辣根过氧化物酶标记二抗,室温培育1 h,TBST洗三次,用Western blot免疫印迹荧光检测试剂盒激发荧光,结果用Labwork凝胶图像分析系统获取各条带的光密度值(OD值)。
1.6统计学处理实验所得数据采用均数±标准差表示,两组间比较采用方差分析及t检验,P<0.05为差异有显著性意义。
2 结 果
2.1 1,25(OH)2D3抑制PMA诱导THP-1巨噬细胞炎症因子的表达用1,25(OH)2D3(10 nmol/L)和/或PMA(250 μmol/L)处理THP-1巨噬细胞6 h,采用荧光定量PCR和ELISA法检测TNFα、IL-1β、IL-6和IL-10的表达水平。如图1和图2所示,1,25(OH)2D3(10 nmol/L)显著抑制PMA(250 μmol/L)作用下THP-1巨噬细胞TNFα、IL-1β和IL-6的表达,并上调IL-10的表达水平。
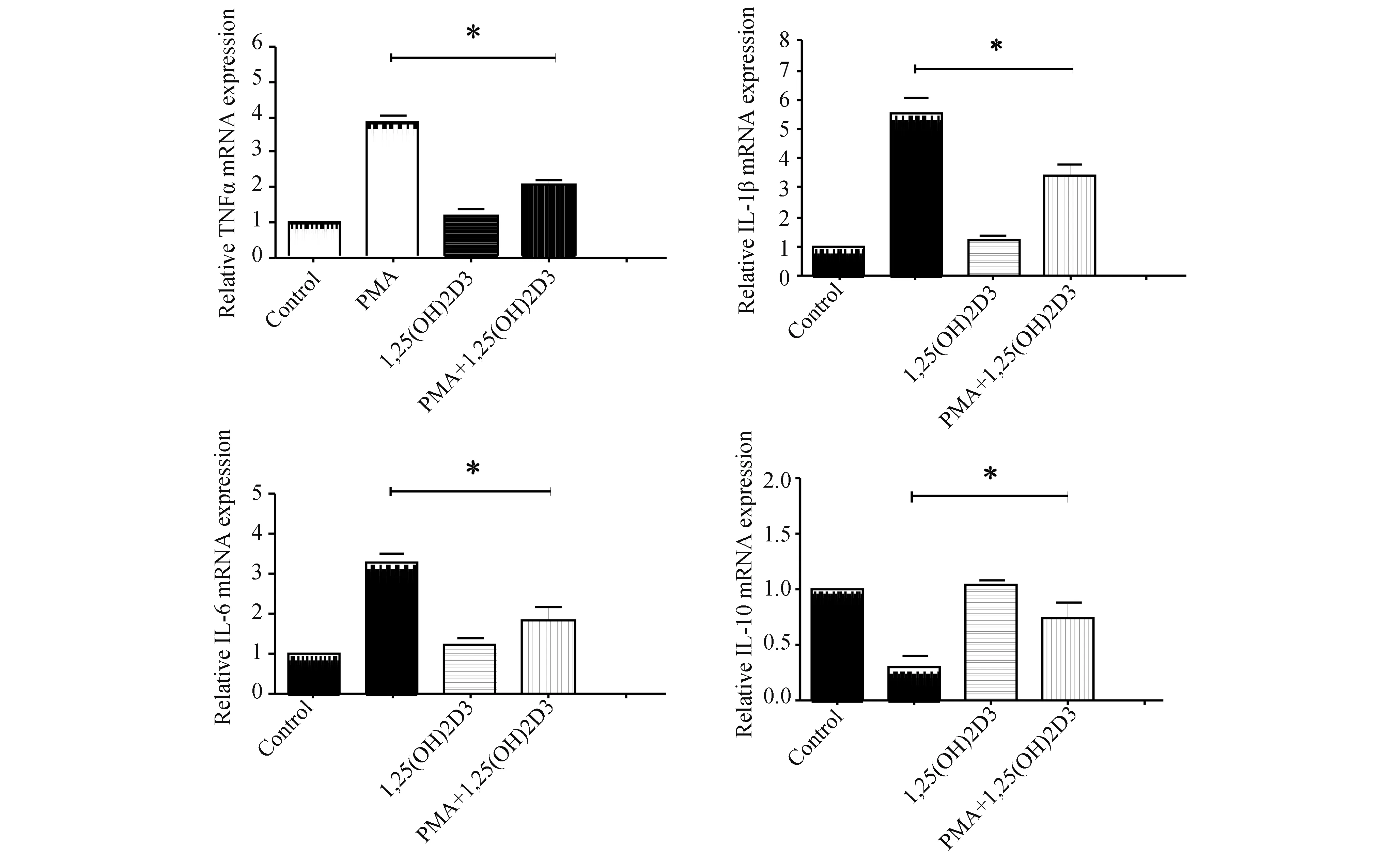
图1 1,25(OH)2D3对PMA作用下THP-1巨噬细胞炎症因子mRNA表达的影响(n=3) 荧光定量PCR法检测TNFα(左上图)、IL-1β(右上图)、IL-6(左下图)和IL-10(右下图)mRNA的表达(1,25(OH)2D3+PMA 与PMA组比较,*:P<0.05)
2.2 1,25(OH)2D3上调PMA作用下THP-1巨噬细胞AMPKα1磷酸化用1,25(OH)2D3处理THP-1巨噬细胞不同时间(0,15,30,60,120 min),采用Western-blot检测AMPKα1和磷酸化AMPKα1的表达,如图3所示,1,25(OH)2D3上调THP-1巨噬细胞磷酸化AMPKα1水平。选择60 min为时间点,如图4所示,PMA下调THP-1巨噬细胞AMPKα1磷酸化,而1,25(OH)2D3显著上调PMA(250 μmol/L)作用下THP-1巨噬细胞AMPKα1磷酸化水平。
3 讨 论
流行病学调查显示,我国超过90%以上的人群存在VD缺乏(参照美国内分泌学会指南,血清25-羟胆钙化醇(25(OH)D3)含量低于20 ng/mL为VD缺乏,低于30 ng/mL为VD不足),提示VD缺乏是我国重要的健康问题[4]。除了参与钙磷代谢,VD缺乏与多种慢性炎症疾病密切相关,然而VD与上述疾病是否存在直接因果关系尚不明确[1]。1,25(OH)2D3是VD在体内的活性成分,通过与维生素D受体(VDR)结合,启动胞内机制发挥调节免疫功能、抑制炎症和抗氧化等作用[5]。在前期研究中,发现VD能够显著促进As斑块巨噬细胞向抗炎M2型极化,从而抑制As的发生发展[3]。在本研究中,发现1,25(OH)2D3能够抑制PMA诱导的巨噬细胞炎症反应,这进一步为VD与肥胖/2型糖尿病相关提供了直接的实验证据。
近来研究发现,细胞代谢在调节巨噬细胞免疫/炎症过程中起着关键作用[6]。在FFA、游离胆固醇等促炎因素作用下,巨噬细胞脂肪酸氧化(Fatty Acid Oxidation,FAO)水平明显下降,有氧糖酵解(Aerobic Glycolysis,AG)活性显著增加,导致细胞呈促炎状态,表现为促炎因子TNFα、IL-1β和IL-6的上调及抗炎因子IL-10的下调[7-8]。5′单磷酸腺苷活化蛋白激酶(AMP-activated Protein Kinase,AMPK)是维持细胞代谢平衡的关键蛋白酶,由α、β和γ 3个亚基组成的异源三聚体蛋白,其中α亚单位起催化作用,β和γ亚单位起稳定作用[9]。研究证实,肥胖状态下ATM的AMPK活性受到显著抑制,细胞FAO水平明显下降,AG活性显著增加,因此调节AMPK活性成为改善胰岛素抵抗和2型糖尿病新的靶点[10]。Li等[11]最近报道VD能够通过激活AMPK/mTOR信号增强二甲双胍对前列腺癌细胞的抑制作用[11]。VD能够通过激活自噬介导的AMPK信号减轻鱼藤酮引起的神经损伤[5]。在本研究中,发现PMA能够下调AMPKα1的磷酸化水平,而VD能够显著上调PMA作用下THP-1巨噬细胞AMPKα1的磷酸化水平,提示AMPKα1活化可能参与了VD对PMA诱导巨噬细胞促炎/抗炎因子表达的调节作用。然而,VD抑制PMA诱导的巨噬细胞炎症反应是否通过调节细胞FAO/AG,将在后续实验中进一步证实。
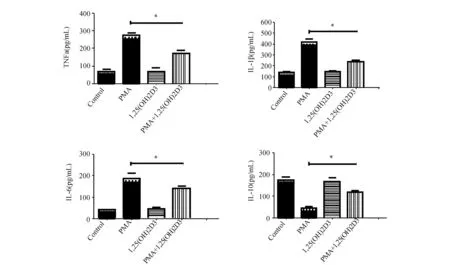
图2 1,25(OH)2D3对PMA作用下THP-1巨噬细胞炎症因子表达的影响(n=3) ELISA法检测TNFα(左上图)、IL-1β(右上图)、IL-6(左下图)和IL-10(右下图)的表达(1,25(OH)2D3+PMA与PMA组比较,*:P<0.05)
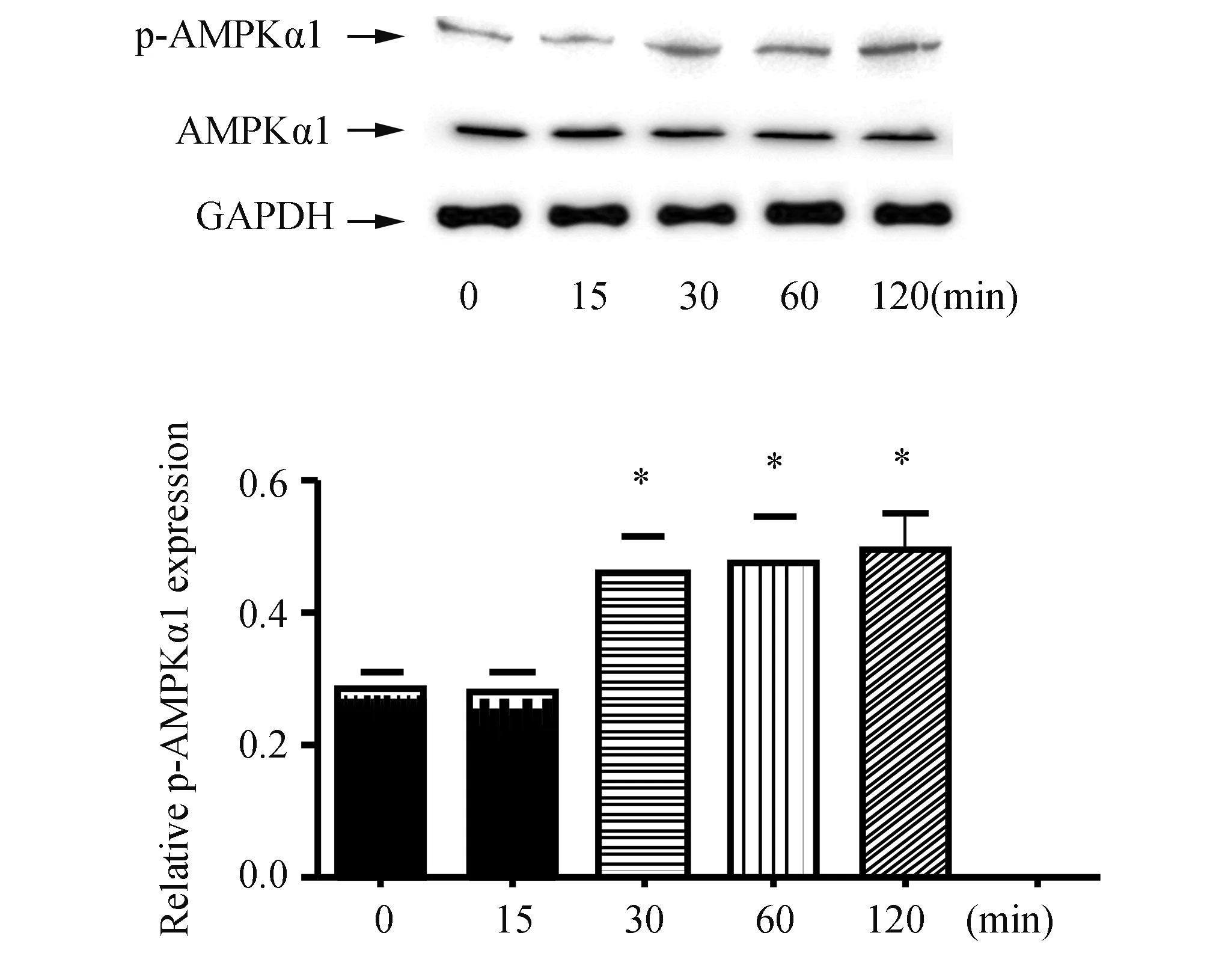
图3 1,25(OH)2D3对THP-1巨噬细胞AMPKα1和p-AMPKα1表达的影响(n=3) Western blot法检测AMPKα1和p-AMPKα1表达(与0 min组比较,*:P<0.05)
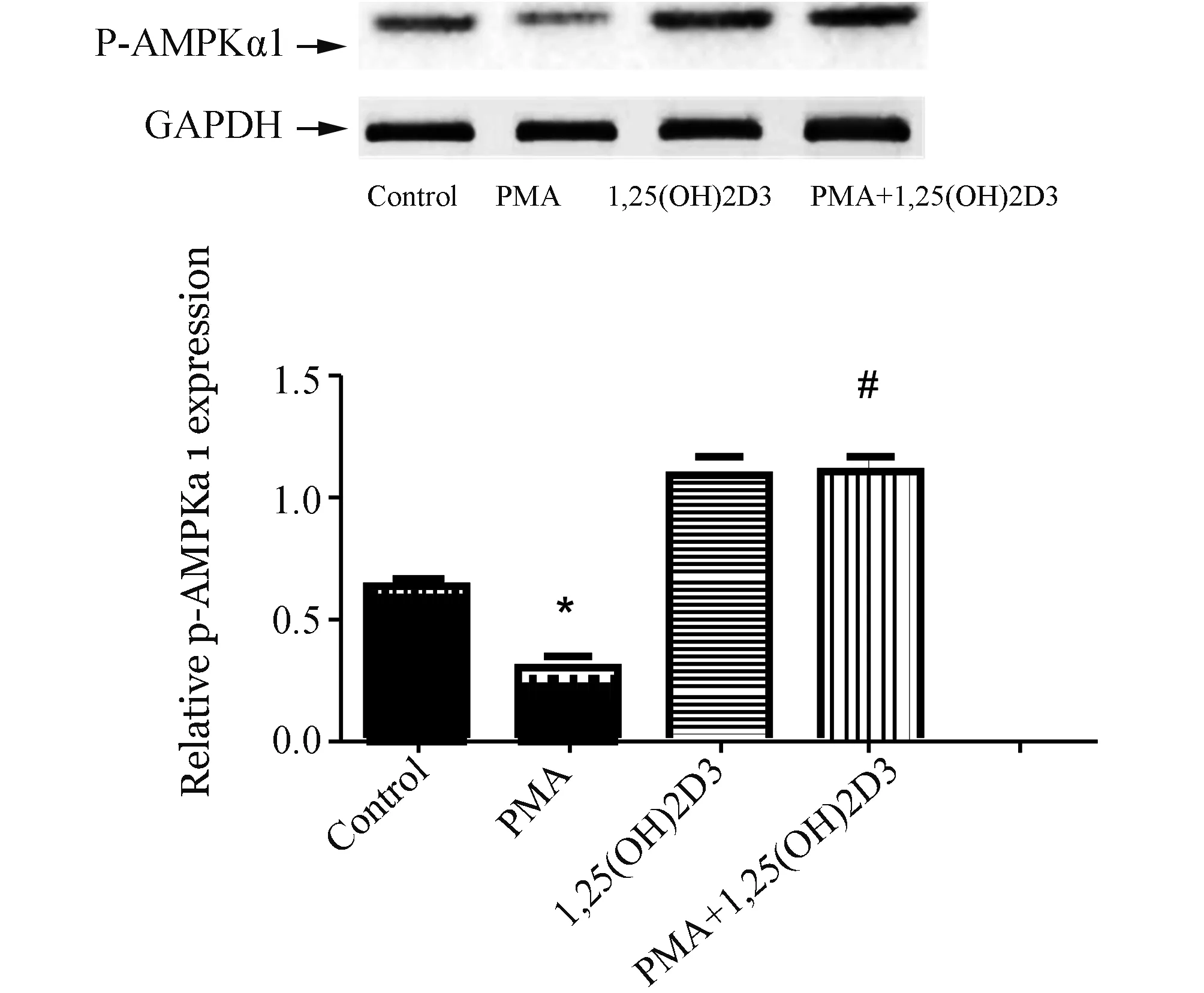
图4 1,25(OH)2D3对PMA作用下THP-1巨噬细胞AMPKα1和p-AMPKα1表达的影响(n=3) Western blot法检测AMPKα1和p-AMPKα1表达(与control组比较,*:P<0.05;与PMA组比较,#:P<0.05)
综上,本实验证实VD抑制PMA诱导的巨噬细胞炎症因子表达,并激活THP-1巨噬细胞AMPKα1磷酸化水平,这将为肥胖和2型糖尿病的防治提供一种新的思路。
[1] Yin K,Agrawal DK.Vitamin D and inflammatory diseases[J].J Inflamm Res,2014,29(7):69-87.
[2] Karkeni E,Marcotorchino J,Tourniaire F,et al.Vitamin D limits chemokine expression in adipocytes and macrophage migration in vitro and in male mice[J].Endocrinology,2015,156(5):1782-1793.
[3] Yin K,You Y,Swier V,et al.Vitamin D protects against atherosclerosis via regulation of cholesterol efflux and macrophage polarization in hypercholesterolemic swine[J].Arterioscler Thromb Vasc Biol,2015,35 (11):2432-2442.
[4] Yu S,Fang H,Han J,et al.The high prevalence of hypovitaminosis D in China:a multicenter vitamin D status survey[J].Medicine (Baltimore),2015,94(8):e585.
[5] Karkeni E,Marcotorchino J,Tourniaire F,et al.Vitamin D limits chemokine expression in adipocytes and macrophage migration in vitro and in male mice[J].Endocrinology,2015,156(5):1782-1793.
[6] Oishi Y,Manabe I.Integrated regulation of the cellular metabolism and function of immune cells in adipose tissue[J].Clin Exp Pharmacol Physiol,2016,43(3):294-303.
[7] Alvarez-Curto E,Milligan G.Metabolism meets immunity:The role of free fatty acid receptors in the immune system[J].Biochem Pharmacol,2016,19.
[8] Lu J,Chen X,Zhang Y,et al.Astragalus polysaccharide induces anti-inflammatory effects dependent on AMPK activity in palmitate-treated RAW264.7 cells[J].Int J Mol Med,2013,31 (6):1463-1470.
[9] Steinberg GR,Schertzer JD.AMPK promotes macrophage fatty acid oxidative metabolism to mitigate inflammation:implications for diabetes and cardiovascular disease[J].Immunol Cell Biol,2014,92(4):340-345.
[10] Ruderman NB,Carling D,Prentki M,et al.AMPK,insulin resistance,and the metabolic syndrome[J].J Clin Invest,2013,123(7):2764-2772.
[11] Li HX,Gao JM,Liang JQ,et al.Vitamin D3 potentiates the growth inhibitory effects of metformin in DU145 human prostate cancer cells mediated by AMPK/mTOR signalling pathway[J].Clin Exp Pharmacol Physiol,2015,42(6):711-717.
1,25-dihydroxyvitaminD3SuppressesPalmiticAcid-inducedInflammatoryCytokinesExpressionintheTHP-1Macrophage
CHEN Wen,ZHU Xiao,FENG Juling,et al
(ResearchLabofTranslationalMedicine,MedicalSchool,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo investigate the effect and mechanism of 1,25-dihydroxyvitamin D(1,25(OH)2D3) on palmitic acid(PMA)-induced inflammatory cytokines expression in THP-1 macrophage.MethodsThe THP-1 macrophages were cultured and incubated with 1,25(OH)2D3(10 nmol/L) and/or PMA(250 μmol/L) for 6h.The RT-PCR and ELISA technology were used to detect mRNA and protein expression of inflammatory cytokines including TNFα,IL-1β,IL-6 and IL-10 in different groups.The THP-1 macrophages were treated with 1,25(OH)2D3and/or PMA for 60min.The westernblot technology was used to detect the expression of AMPKα1 and AMPKα1 phosphorylation.Results1,25(OH)2D3obviously abolished the effect of PMA on the expression of inflammatory cytokines including TNFα,IL-1β,IL-6 and increased the expression of IL-10 in THP-1 macrophages.1,25(OH)2D3significantly promoted the phosphorylation of AMPKα1 in THP-1 macrophages.Conclusion1,25(OH)2D3can suppress PMA-induced inflammatory cytokines expression in THP-1 macrophages via regulation of AMPKα1 phosphorylation.
1,25-dihydroxyvitamin D; palmitic acid; macrophage; inflammation
10.15972/j.cnki.43-1509/r.2016.04.008
2016-04-09;
2016-06-28
国家自然科学基金资助项目(81100213,81470569);南华大学博士启动基金(2015XQD49);南华大学留学归国人员启动基金(2015XQD55).
*通讯作者,E-mail:kaiyinby@hotmail.com.
R363
A
蒋湘莲)

