紫苏种子脂肪酸代谢及关键酶基因调控油脂合成规律的研究
王计平 张玲慧 赵 静 王彦尊 李润植
(山西农业大学农学院,太谷 030801)
紫苏种子脂肪酸代谢及关键酶基因调控油脂合成规律的研究
王计平 张玲慧 赵 静 王彦尊 李润植
(山西农业大学农学院,太谷 030801)
为了研究种子油脂及脂肪酸生物合成机制,特别是α-亚麻酸的高水平积累,采用气相色谱法分析7个紫苏品种的成熟种子及晋苏1号种子不同发育时期脂肪酸组成、含量及其动态变化;实时荧光定量PCR检测TAG生物合成关键酶基因在紫苏不同组织及种子发育不同时期的表达特性,分析基因表达与脂肪酸及α-亚麻酸合成积累之间的关系。结果表明,紫苏种子中不饱和脂肪酸(18∶1,18∶2,18∶3)含量占总脂肪酸90%以上,种子发育过程中,总脂肪酸含量随着鲜重增加而不断增加,种子形态也经历由多水透明状转变为乳白色或深紫色最后成为褐色;随着种子不断发育,亚油酸含量逐渐降低,而α-亚麻酸含量不断增加,到种子成熟时达总脂肪酸质量的60%以上。晋苏1号作为高含α-亚麻酸的优质品种,α-亚麻酸含量达456.6 mg/g,亚麻酸与亚油酸之比为9∶1。Real-time PCR 分析结果显示PfDGAT1和PfPDAT在紫苏茎和根系中的表达量均很低,而在叶片和种子中高量表达,在种子发育不同时期,PfDGAT1表达量呈先升高后降低的趋势,开花后30 d,表达量最高。PfDGAT1基因超量表达之后紧接着α-亚麻酸和总油脂快速积累,表明PfDGAT1在紫苏α-亚麻酸和总油脂积累过程中起关键作用。
紫苏 种子油脂 脂肪酸 二酰甘油酰基转移酶基因(DGAT1) 磷脂二酰甘油酰基转移酶(PDAT)
紫苏(PerillafrutescensL.)是唇形科紫苏属一年生草本植物,有较强的适应性,可药食两用,广泛分布于东亚各国,在我国已有2 000多年的栽培历史。紫苏籽出油率高达45%~55%,含有丰富的不饱和脂肪酸,占总脂肪酸含量的90%以上,其中α-亚麻酸质量分数达55%~65%,α-亚麻酸是人体组织细胞必需的脂肪酸,在体内参与磷脂的合成和代谢。更为重要的是,α-亚麻酸在人体细胞组织内可进一步合成人体必需的2种生命活性因子,即二十二碳六烯酸(22∶6 n-3,DHA)和二十碳五烯酸(20∶5 n-3, EPA)。因此,开发基于植物源的α-亚麻酸营养保健医疗产品,越来越引起国内外学术界和产业界的高度关注。作为一种营养保健食用油,紫苏籽油具有降血压、降低胆固醇、促进视网膜发育、提高记忆力、增强免疫力、延缓衰老、预防老年痴呆等功效[1-2]。目前,关于植物种子脂肪酸合成积累机制及代谢工程的研究已成为当今植物油脂化学与分子生物学,生物技术和油料作物遗传育种研究的重点领域[3-7],但有关紫苏α-亚麻酸生物合成积累及调控机制的研究相对较少。本试验通过研究控制紫苏种子α-亚麻酸合成及积累的关键酶基因,即选择性转移α-亚麻酸于三酰基甘油脂(TAG)分子中的二酰甘油酰基转移酶(DGAT1)和磷脂二酰甘油酰基转移酶(PDAT)的表达特性,结合紫苏种子含油率及脂肪酸成分变化,揭示油脂合成关键酶基因表达对油脂合成的影响。
1 材料与方法
1.1 主要仪器设备
Agilent 7890A气相色谱仪:美国安捷伦科技公司;Applied Biosystems 7500 Fast Real-Time PCR System(实时荧光定量PCR仪):美国应用生物系统公司。
1.2 供试材料
试验所用材料由山西省农业科学院棉花研究所提供,紫苏品种为中北2号、晋苏1号、Y-早、Y-7、Y-4、Y-2、白苏。
1.3 试验方法
1.3.1 脂肪酸提取
选取紫苏7个品种的成熟种子及于盛花期标记始开花朵,开花后10、20、30、40 d,分别取发育中的蒴果(四棱种)15粒于EP管中,立即放入液氮中速冻(-80 ℃保存),每次取材3次重复。样品经真空冷冻干燥过夜,称取冻干种子样品(8~12 mg)置于干燥玻璃试管中。加入Tri17∶0(用于内对照),每mg干样品加10 μg Tri17∶0(即每mg样品加1 μL 10 mg/mL Tri17∶0溶液),在玻璃试管内小心研磨。加入1 mL氯仿∶甲醇(2∶1)溶液,用玻璃棒搅拌几分钟后静置,加0.9% KCl 0.5 mL搅拌后再加入1 mL氯仿,混匀,离心,使其分层。用玻璃吸管将底部氯仿相吸出,并移至另一个新的玻璃管。将含有氯仿相的试管置于室温下自然蒸发(留下10~20 μL即可)。向上述试管中加入0.5 mL甲醇钠(含BHT),混匀后置于摇床上震荡20~45 min。之后加入0.5 mL异辛烷,混匀后,离心,使溶液分层,再加入0.9% KCl 1 mL,混匀,再离心至分层。吸取上层(含有脂肪酸甲酯),放入GC小瓶保存待测。
1.3.2 脂肪酸成分测定
通过安捷伦7890A气相色谱仪进行分析,条件为VF-23MS毛细管柱30 m×0.25 mm×0.25 μm。进样口温度为260 ℃,载气为高纯氮气,分流比30∶1,进样体积1 μL,恒压22 psi。程序升温:初温为110 ℃,保持3 min,以4 ℃/min升至220 ℃,保持15 min。FID检测器温度为260 ℃,尾吹气N245 mL/min,空气450 mL/min,氢气40 mL/min。用安捷伦软件进行分析,各种脂肪酸的鉴定通过标样保留时间确认,同样条件下平行测定3次。
1.3.3 实时荧光定量PCR检测
通过脂肪酸组分及含量测定优选品种晋苏1号,取其根、茎、叶、花,并于盛花期标记始开花朵,10、20、30、40 d后取发育中的蒴果(四棱种),每次取材分3次重复。RNA提取及第一链cDNA的合成分别按照TIAN Gen Biotech公司TRIZOL及FastQuant cDNA第一链合成试剂盒说明书进行。
实时荧光定量PCR引物分别为:PfDGAT1F:5’-TGGTGGAATGCGAGGACA-3’/PfDGAT1R:5’-GACACAAGAAACGCGATCAA-3’,PfPDATF:5’-GGCATTCCAACTGAAAGAGC-3’/PfPDATR:5’-GTTTTTCCACGCCACCCT-3’,18S rRNAF:5’-CGGCTACCACATCCAAGGAA-3’/18S rRNAF:5’-GCTGGAATTACCGCGGCT-3’。反应体系为:SYBR Premix EX TaqⅡ(Tli RnaseH Plus)(2×) 5 μL,10 μmol/L引物对各0.4 μL,模板cDNA 1 μL,ROX Reference Dye(50×) 0.2 μL,无菌纯水补足10 μL;反应条件为:95 ℃ 3 min,30个循环(95 ℃ 30 s;60 ℃ 30 s;72 ℃ 20 s),10 ℃保温。所用引物均由生工生物工程(上海)有限公司合成。
2 结果与分析
2.1 不同品种紫苏成熟种子中脂肪酸组分分析
通过气相色谱仪对7个不同品种紫苏种子脂肪酸组成进行分析,结果表明:紫苏籽油中含有棕榈酸(C16∶0)、棕榈一烯酸(C16∶1)、硬脂酸(C18∶0)、油酸(C18∶1)、亚油酸(C18∶2)、亚麻酸(C18∶3)、花生酸(C20∶0)、花生一烯酸(C20∶1)(表1)。其中,棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸含量较高,而棕榈一烯酸、花生酸、花生一烯酸为微量脂肪酸(质量分数,<1%)。饱和脂肪酸棕榈酸和硬脂酸的含量明显较低,在总脂肪酸中分别占6%~7%和2%~3%。7个品种中晋苏1号亚麻酸含量最高,占总脂肪酸质量的60.7%,达到456.6 mg/g,亚麻酸与亚油酸的比值为9∶1,其中不饱和脂肪酸占总脂肪酸的91%,7个品种总不饱和脂肪酸均达到90%以上(图1),上述结果与已有研究结果一致[8-10]。
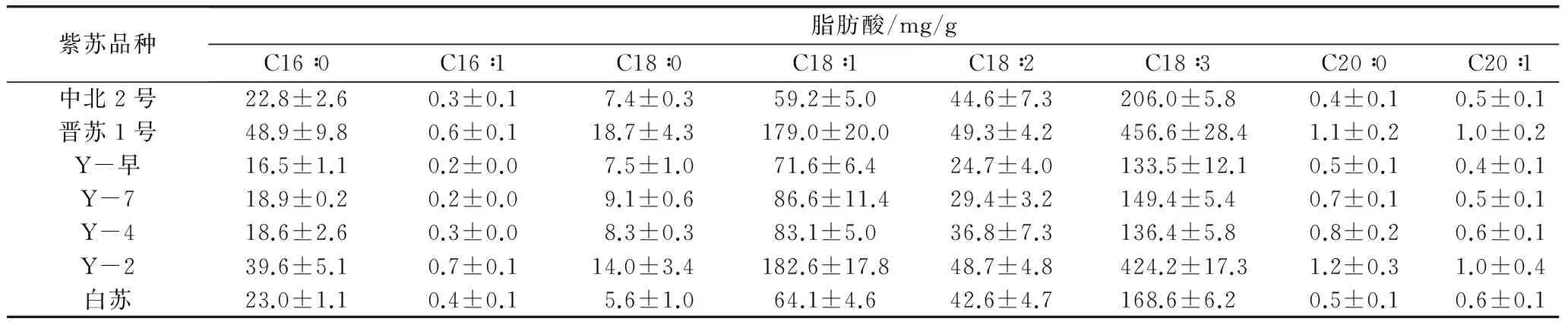
表1 不同品种紫苏成熟种子脂肪酸组成及含量测定结果
2.2 紫苏种子发育过程中脂肪酸组分分析
晋苏1号果实发育初期4个果实晶莹剔透,小如针尖;中期果实膨大,由透明状转向半透明或乳白色,通常同一基座上的4个果实发育大小不一;后期果实达到最大,为褐色,表皮有褐色网纹突出;末期果实不再增大,表皮的网纹变淡,果实全褐。在种子发育过程中定期取样,通过气相色谱进行脂肪酸组分分析(图2)。结果表明,种子发育前期,随着时间的推移,种子鲜重逐渐增大,到开花后30 d达到最大,然后呈现下降趋势。而脂肪酸含量从开花后10 d开始缓慢增加,开花后30 d以后,种子鲜重降低的同时脂肪酸总量的积累迅速增大。
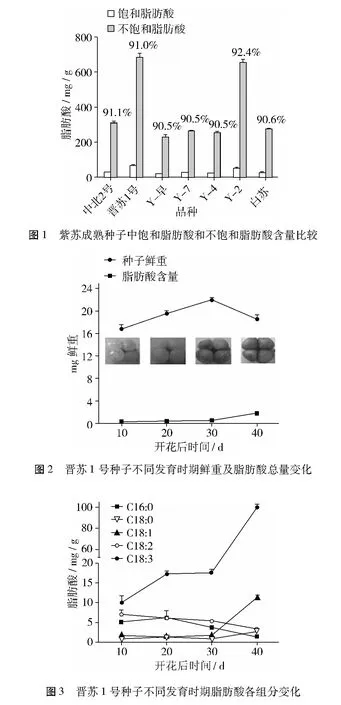
在种子发育过程中,脂肪酸积累量不断增加,5种主要脂肪酸含量也在发生变化(图3),每克种子中棕榈酸(C16∶0)和亚油酸(C18∶2)的含量逐渐降低,硬脂酸(C18∶0)呈缓慢上升趋势,油酸(C18∶1)开始增加缓慢,到了后期增加较快,变化趋势与α-亚麻酸(C18∶3)类似。α-亚麻酸含量整体呈上升趋势,开花后10 d种子中α-亚麻酸含量占总脂肪酸质量的40%,20 d的种子中 α-亚麻酸质量占53%,到开花后40 d时,平均每克鲜种子中α-亚麻酸质量达100.1 mg,占总脂肪酸质量的84%。
2.3 调控脂肪酸代谢关键酶时空表达分析
PfDGAT1在紫苏不同组织的表达情况如图4显示,PfDGAT1在种子形成后期(开花后30 d)表达量最高,是叶片表达量的4.3倍,在花中表达量相对下调了1.1倍,该基因在紫苏茎和根系中的表达量很低,分别是叶片表达量的0.32倍和0.53倍,说明种子是TAG合成的主要场所,PfDGAT1在紫苏种子总油脂积累过程中行使重要功能。在种子发育过程中,PfDGAT1基因表达量呈现先升高后降低的趋势。
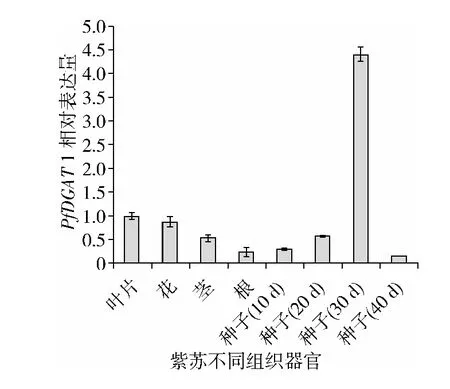
图4 晋苏1号不同组织器官PfDGAT1相对表达量的变化
根据图5结果分析,紫苏不同组织器官中PfPDAT基因表达量存在差异。在不同组织中表达量
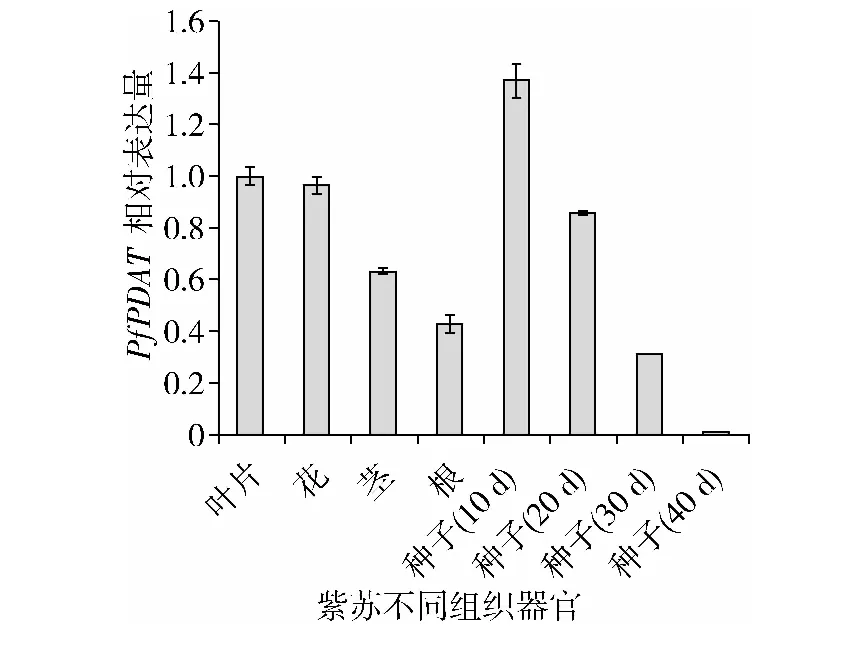
图5 晋苏1号不同组织器官PfPDAT相对表达量的变化
以叶片最高,茎和根系中表达量比较低,种子发育初期(开花后10 d)表达量最高,是叶片表达量的1.4倍,随着种子逐渐成熟,PfPDAT基因呈下调表达,到开花后40 d,该基因表达量仅为种子发育初期的0.006倍。
3 讨论与结论
通过气相色谱分析得出紫苏种子中主要含有棕榈酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1)、亚油酸(C18∶2)、亚麻酸(C18∶3)5种脂肪酸,其中不饱和脂肪酸含量高,占总脂肪酸的90.5%~92.4%。晋苏1号α-亚麻酸含量高,可达到456.6 mg/g,亚麻酸与亚油酸之比为9∶1,是高含α-亚麻酸的优质品种。紫苏种子发育过程中各脂肪酸组分随着种子发育呈现一定变化规律,饱和脂肪酸如棕榈酸、硬脂酸含量较为稳定,不饱和脂肪酸如油酸含量随着种子发育,前期积累量增长缓慢,后期显著增加,而α-亚麻酸含量不断增加直至种子成熟,亚油酸含量呈连续下降趋势,这可能与种子发育过程中大量亚油酸向 α-亚麻酸快速转化积累有关,而亚麻酸含量的增加抑制了亚油酸的合成,从而导致ALA与LA之间的比例差距加大[11]。从总体来看,脂肪酸累积过程较长,在进入开花期后需要30~40 d才能完成。本试验研究发现随着种子的发育,种子鲜重呈先升高后降低的趋势,开花后30 d达到最大,种子形态也由多水透明状转变为乳白或深紫色最后变成褐色,同时种子逐渐变得硬实,脂肪酸的积累量迅速增加,到种子发育后期脂肪酸含量达到最大。
α-亚麻酸等脂肪酸合成后,经一系列酶促反应,最终转入甘油-3-磷酸分子(glycerol-3 phosphate, G3P)而生成三酰基甘油(TAG),贮存于油体中。研究表明,PDAT 和DGAT1 是控制模式植物拟南芥种子油合成积累的关键酶[12-13]。王安可[14]在棉花中的研究发现在油脂储存的主要器官种子中DGAT1表达量较高。Wang等[15]提取开花后10、20和30 d的大豆豆荚RNA,检测了GmDGAT1基因的表达情况,发现随着豆荚的发育表达量递增,且在30 d时,基因的表达量达到最高。蓖麻种子中的DGAT1的表达量是从种子发育开始逐渐上升,在中期达到最大[16]。有研究报道PDAT 能选择性积累羟化脂肪酸[17]。本研究对紫苏不同器官及种子发育不同时期PfDGAT1及PfPDAT基因表达特性进行分析,结果表明,二者在种子中均大量表达,PfDGAT1表达量呈现先升高后降低的趋势,在开花后30 d,表达量最高,紧接PfDGAT1基因高峰表达期的是α-亚麻酸和总油脂快速积累期。这表明PfDGAT1在紫苏α-亚麻酸和总油脂积累过程中行使重要功能。
[1]Lee J E, SEong J E, Hong S H, et al. Inhibitory effect of perilla oil on hepatic lipid accumulation in the apoE knock-out mice fed high cholesterol diet[J]. Proceedings of the Nutrition Society, 2011, 70(4) : 142
[2]Chang H H, Chen C S, Lin J Y. Dietary perilla oil lowers serum lipids and ovalbumin-specific lgG1, but increases total lgE levels in ovalbumin-challenged mice[J]. Food and Chemical Toxicology, 2009, 47(4) : 848-850
[3]岳爱琴,李润植.新型可再生工业用油脂的代谢工程[J].中国生物化学与分子生物学报, 2009, 25(6) : 501-509
[4]Li R Z, Yu K S, Hatanaka T, et al. Vernonia DGATs increase accumulation of epoxy fatty acids in oil[J]. Plant Biotechnology Journal, 2010, 8 : 184-195
[5]Clemente T E, Cahoon E B. Soybean oil: genetic approaches for modification of functionality and total content[J]. Plant Physiology, 2009, 151 : 1030-1040
[6]Durrentt T P, Benning C, Ohlrogge J. Plant triacylglycerols as feedstocks for the production of biofuels[J]. The Plant Journal, 2008, 54 : 293-601
[7]Dyer J M, Mullen R T. Engineering plant oils as high-value industrial feedstocks for biorefining: the need for underpinning cell biology research[J]. Physiologia Plantarum, 2008, 132 :11-22
[8]张志军,孙子文,李会珍,等.不同品种紫苏种子营养成分及脂肪酸组分分析[J].中国粮油学报, 2012, 27(8) :57-59
[9]张洪,黄建韶,赵东海.紫苏营养成分的研究[J].湖南文理学院学报:自然科学版, 2006, 18(1) : 49-51
[10]Longvah T, Deosthale Y G, Uday Kumar P. Nutritional and short term toxicological evaluation of Perilla seed oil[J]. Food Chemistry, 2000, 70 : 13-16
[11]Ichihara K, Suda Y. Lipid biosynthesis in developing perilla seeds[J]. Phytochemistry, 2003, 63 : 139-143
[12]Zhang M, Fan J, Taylor D C, et al. DGAT1 and PDAT1 Acyltransferases have overlapping functions in Arabidopsis triacylglycerol biosynthesis and are essential for normal pollen and seed development[J]. Plant Cell, 2009, 21:3885-3901
[13]Shockey J M, Gidda S K, Chapital D C, et al. Tung tree DGAT1 and DGAT2 have nonredundant functions in triacylglycerol biosynthesis and are localized to different subdomains of the endoplasmic reticulum[J]. Plant Cell, 2006,18:2294-2313
[14]王安可.VgDGAT1基因在棉花中的遗传转化和表达研究[D].杭州: 浙江大学, 2013
[15]Wang H W, Zhang J S, Gai J Y, et al. Cloning and comparative analysis of the gene encoding diacylglycerol acyltransferase from wild type and cultivated soybean[J]. Theoretical and Applied Genetics, 2006, 112(6) : 1086-1097
[16]He X H, Turner C, Chen G Q, et al. Cloning and characterization of a cDNA encoding diacylglycerol acyltransferase from castor bean[J]. Lipids, 2004, 39(4) : 311-318
[17]van Erp H, Bate P G, Burgal J, et al. Castor phospholipid: diacylglycerol acyltransferase facilitates efficient metabolism of hydroxyl fatty acid in transgenic Arabidopsis[J]. Plant Physiology, 2011, 155(2) : 683-693.
Regulation of Controlling Oil Synthesis by Fatty Acid Metabolism of Perilla Seed and Key Enzyme Gene
Wang Jiping Zhang Linghui Zhao Jing Wang Yanzun Li Runzhi
(College of Agronomy, Shanxi Agricultural University, Taigu 030801)
In order to study the biosynthesis mechanism of grease and fatty acids in seeds, especially the high-level accumulation of α- linolenic acid, this paper adopted gas chromatography method to analyze composition, content and dynamic change of fatty acid in the mature seeds of seven perrila varieties and Jinsu No. 1 seed at different development stages; the developing seeds so as to investigate physiological-biochemical features of perilla seed oil and fatty acid biosynthesis. Expression pattern of key genes in fatty acid metabolism was analyzed. The results showed that unsaturated fatty acids (18∶1, 18∶2, 18∶3) made up 90% of total seed oil in perilla. Following seed developing, seed fresh weight and total fatty acid content were increased, and seed morphology was also changed from aqueous and transparent forms to milky white or dark purple and finally brown matured seeds. During seed development and maturation, linoleic (18∶2) content was gradually reduced while the level of α-linolenic acid (18∶3) was correspondingly increased up to more than 60% of the total fatty acids in the mature seeds. Of seven perilla varieties tested, variety Jinsu1 contained the highest level of α-linolenic acid (456.6 mg/g). The ratio of α-linolenic acid to linoleic acid is 9∶1. Real-time PCR analysis showed that small expression ofPfDGAT1 andPfPDATwas in root and stems while large expression of the genes was in leaves and seeds. Following seed development,PfDGAT1 expression increased slowly at the earlier stages, and then increased vastly at mid stages and reduced slowly at late stages, with the peak expression level in the seed at 30 days after flowering. ThePfDGAT1 highly expression stage was just ahead of the high accumulation stage of α-linolenic acid and total oil in seed development, indicating thatPfDGAT1 function importantly in perilla seed oil and α-linolenic acid accumulation.
PerillafrutescensL., seed oil, fatty acid, diacylglycerol acyltransferase enzyme (DGAT1), phospholipids diacylglycerol acyltransferase (PDAT)
S565.8
A
1003-0174(2016)03-0091-05
时间:2015-12-28 17:06:54
网络出版地址:http://www.cnki.net/kcms/detail/11.2864.TS.20151228.1706.002.html
国家青年科学基金(31201266)
2014-12-26
王计平,女,1974年出生,博士,副教授,植物生理与分子生物学
李润植,男,1959年出生,博士,教授,植物分子遗传与基因工程

