果蝇天然免疫与寄生蜂毒液蛋白对其调控研究进展
杨 磊,方 琦,黄 佳,叶恭银
(浙江大学昆虫科学研究所农业部农业昆虫学重点实验室,浙江杭州 310058)
果蝇天然免疫与寄生蜂毒液蛋白对其调控研究进展
杨 磊,方 琦,黄 佳,叶恭银*
(浙江大学昆虫科学研究所农业部农业昆虫学重点实验室,浙江杭州 310058)
寄生蜂与寄主昆虫间互作一直是昆虫免疫学与寄生学的研究重点。模式昆虫果蝇主要依赖其天然免疫系统来成功抵御外来生物入侵。寄生蜂寄生果蝇后,可激活寄主的免疫系统,包括细胞免疫和体液免疫。果蝇细胞免疫包括血细胞的增殖、分化、迁移与黏附并最终形成包囊。体液免疫则涉及免疫信号通路的激活和抗菌肽的产生。此外,黑化反应和活性氧的产生在果蝇体液免疫中也发挥重要作用。通过长期协同进化,寄生蜂亦已形成用以攻克果蝇天然免疫防御系统的策略。相关研究主要集中于果蝇幼虫内寄生蜂,而有关其蛹期和外寄生蜂的相关研究则尚无报道。果蝇幼虫寄生蜂调控寄主天然免疫因子主要包括毒液、类病毒颗粒和畸形细胞等,其中有关毒液蛋白组分及功能组成的研究已较深入。对果蝇寄生蜂毒液蛋白组分进行鉴定与功能研究将有助于深入揭示寄生蜂与寄主间互作机理,并为发展新型害虫绿色防控技术提供依据。
果蝇;寄生蜂;免疫反应;毒液蛋白
昆虫和其他无脊椎动物缺乏获得性免疫反应,但在长期抵御病原物入侵的过程中进化出多重天然免疫系统[1]。果蝇作为农业上的重要害虫,被广泛用于各方面的研究,其中包括天然免疫反应。果蝇的天然免疫反应分为细胞免疫(cellular innate immunity response)和体液免疫(humoral innate immunity response),二者协同作用以抵御外来生物入侵[1-2](图1)。其中细胞免疫包括血细胞的延展(spreading)、吞噬(phagocytosis)、包囊(encapsulation)等,而体液免疫则涉及血淋巴黑化(melanization)、抗菌肽(antimicrobial peptides)合成等[3]。
寄生蜂作为膜翅目昆虫中的一大类群,在害虫生物防治中发挥着重要作用。寄生蜂与寄主昆虫间互作一直是昆虫免疫学与寄生学的研究重点。寄生蜂产卵于寄主体内(内寄生蜂,endoparasitoid)或体表(外寄生蜂,ectoparasitoid)及其后代于寄主体内或体表成功发育的过程中,其雌成蜂、胚胎或幼虫可携带或分泌多种寄生活性因子,包括多分DNA病毒(polydnavirus,PDV)、毒液(venom)、类病毒颗粒(virus like particles,VLPs)、畸形细胞(teratocyte)等[4]。其中寄生蜂毒液在抑制寄主天然免疫反应过程中发挥着极其重要的作用。近年来,有关不同寄主昆虫的寄生蜂毒液蛋白鉴定与功能分析虽已取得较大进展,但有关模式昆虫果蝇寄生蜂的毒液蛋白在该领域的研究尚处起步阶段。果蝇作为重要的模式昆虫及水果害虫,深入研究其与寄生蜂间的相互作用,尤其以寄生蜂毒液与寄主果蝇天然免疫反应间的相互作用为研究重点,将有助于阐明寄生蜂与寄主昆虫间互作的生理与分子机理。本文结合相关领域的国内外研究进展,就果蝇天然免疫与寄生蜂毒液蛋白对其调控的进展作一简单综述,这将为利用寄生性天敌对植物害虫进行生物防治提供理论依据与支撑。
1 果蝇天然免疫反应
1.1细胞免疫
果蝇细胞免疫主要发生于果蝇血腔内,由其血细胞介导完成,其血细胞主要类型包括:浆血细胞(plasmatocytes)、薄层细胞(lamellocytes)和晶细胞(crystal cell)3种[5],这与其他类型昆虫如鳞翅目昆虫等存在显著差异。不同类型的3种血细胞行使不同的生物学功能,并在果蝇细胞免疫反应中扮演不同角色。其中,浆血细胞主要起吞噬作用,薄层细胞可对大颗粒外源物进行包囊,而晶细胞则与黑化作用相关[3]。当寄生蜂产卵于果蝇幼虫体内,果蝇血细胞可迅速对其进行非我识别并激活细胞免疫反应[6]。果蝇细胞免疫反应的激活主要涉及3个部分。首先,寄生蜂的卵诱导浆血细胞增殖和薄层细胞分化;其次,浆血细胞向卵迁移并在卵表面延展;最后,薄层细胞对卵进行包囊[7]。
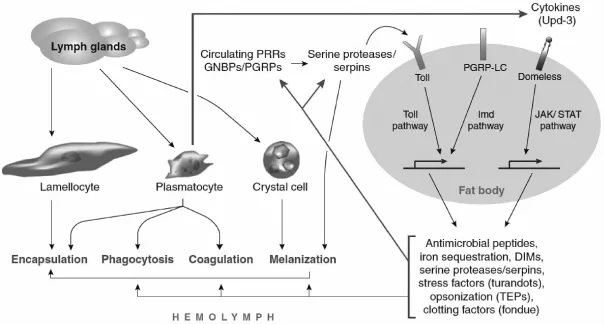
图1 果蝇天然免疫反应
1.2体液免疫
除细胞免疫外,果蝇还具有多重体液免疫系统,并在其天然免疫过程中发挥重要作用。果蝇体液免疫反应主要涉及抗菌肽(antimicrobial peptide,AMPs)的诱导、表达合成与分泌,由蛋白水解酶所介导的黑化级联反应,活性氧分子(reactive oxygen species,ROS)和一氧化氮(NO)所介导的信号通路与效应分子合成及释放等过程[8-10]。寄生蜂寄生果蝇后,会迅速激活果蝇体内的Toll信号通路和免疫缺陷(IMD)信号通路,从而上调效应分子抗菌肽基因的表达[11]。寄生蜂寄生果蝇后,能诱导果蝇体内合成并分泌的抗菌肽主要包括:Diptericin、Drosomycin、Cecropin、Metchnikowin、Defensin等[12]。此外,在果蝇体液免疫反应中扮演重要角色的血淋巴黑化反应亦会被寄生蜂卵所激活。当进入果蝇血腔的寄生蜂卵被包囊后,晶细胞释放酚氧化酶原(prophenoloxidase,PPO),激活黑化级联反应并产生黑色素沉积于卵表面,最终导致卵死亡[9]。最近有研究表明,果蝇肠道所产生的ROS和NO在抵御果蝇寄生蜂入侵过程中也发挥着重要作用[10]。
2 果蝇寄生蜂毒液蛋白调控寄主天然免疫反应
果蝇作为重要的模式昆虫及农业上重要的水果害虫,可被多种膜翅目寄生蜂寄生。目前有关果蝇寄生蜂的研究主要集中于有限的几个种类中,主要包括膜翅目环腹蜂科Leptopilina属和Ganaspis属以及茧蜂科Asobara属[13-14]。寄生蜂在成功寄生果蝇的过程中,其雌成蜂、胚胎或幼虫可携带或分泌多种活性因子,包括有PDVs、毒液、VLPs、畸形细胞等多种寄主免疫抑制因子[4]。无论是外寄生蜂或是内寄生蜂,其毒液蛋白在抑制寄主天然免疫反应过程中均发挥了重要作用[15]。
2.1毒液蛋白鉴定
寄生蜂毒液是一种由多重组分构成的混合活性物质,主要由蛋白、肽及生物小分子等组成。毒液蛋白中的各组分大多由雌成蜂毒腺表达,而后其表达产物被转运至毒囊中进行贮存,在寄生过程中,雌成蜂会将其毒囊中的毒液蛋白伴随产卵过程而同时注入寄主果蝇体内。由于受限于果蝇寄生蜂雌蜂个体较小,毒囊组织更是微小,且每头雌成蜂毒囊所含毒液极其微量,长期以来如何分离纯化并鉴定获得寄生蜂毒液蛋白组分一直是该研究领域的技术难点,这也使寄生蜂毒液蛋白的相关研究明显落后于其他大型动物甚至其他社会性膜翅目昆虫的毒液蛋白研究。近年来,基因组学、转录组学与蛋白质组学及高通量测序及生物大分子质谱鉴定技术的迅猛发展,为微型动物尤其是寄生蜂毒液蛋白的分离与鉴定提供了可能与技术支持[16]。目前已完成雌成蜂毒液蛋白分离与鉴定的果蝇寄生蜂的种类主要包括果蝇幼虫内寄生蜂L.heterotoma、L.boulardi和Ganaspis sp.等13种。其中,从L.heterotoma毒液中共鉴定获得176种毒液蛋白,其中得到注释的毒液蛋白有90种,共分为12大类,未得到注释的毒液蛋白共86种;从L.boulardi毒液中共鉴定获得129种毒液蛋白,其中得到注释的毒液蛋白有69种,共分为5大类,未得到注释的毒液蛋白共60种;从Ganaspis sp.1毒液中共鉴定获得166种毒液蛋白,其中得到注释的毒液蛋白有98种,共分为19大类,未得到注释的毒液蛋白共68种[14-16]。相较于果蝇幼虫寄生蜂,其蛹期寄生蜂的毒液蛋白组分的分离与鉴定尚未见报道,研究相对滞后,该研究领域尚待昆虫学家们进一步开拓。
2.2 毒液蛋白多样性
现有研究结果表明,已成功分离鉴定的寄生蜂毒液蛋白组分,一般可归类分为麻痹毒素、抗菌活性物质、酶类、酶抑制剂、未知组分等5大类[17]。不同科、属,甚至种间的寄生蜂毒液蛋白组成之间存在一定的保守性与特异性[18]。截至目前,已经有超过17种寄生蜂的毒液蛋白组分得到分离鉴定,其中包含上述3种果蝇幼虫内寄生蜂,即L. heterotoma、L.boulardi和Ganaspis sp.1[18]。此3种寄生蜂毒液蛋白的主要组成如表1所示[14-16]。SDS-PAGE结果表明,同为Leptopilina属的L. heterotoma和L.boulardi雌成蜂毒液蛋白的组成间存在一定的相似性与差异性。此外,果蝇寄生蜂L.boulardi的不同地理种群的个体间毒液蛋白组成亦存在显著差异性[18]。上述研究表明,果蝇寄生蜂可能因其营不同寄生策略,而在长期抵御寄主天然免疫反应过程中,通过协同进化而衍生出不同的毒液蛋白组分,用以满足自身成功寄生所需。

表1 采用转录组与蛋白组学相结合的方法成功鉴定出的果蝇寄生蜂毒液蛋白组分
2.3 毒液蛋白功能
2.3.1 寄生蜂毒液蛋白调控果蝇细胞免疫反应
果蝇寄生蜂在长期抵御寄主细胞免疫反应的过程中进化出两种应对策略,即免疫逃避和免疫抑制[19]。Ganaspis sp.1在寄生果蝇幼虫后12 h内,可将卵黏附于其脂肪体或肠道组织;在寄生后12~24 h内,其卵可完全被寄主脂肪体或肠道组织所覆盖,而使寄生蜂卵避免与寄主血细胞进行接触,以此逃避寄主血细胞介导的包囊反应[14]。此外,现有多项研究表明,多种果蝇寄生蜂毒液蛋白可通过不同途径抑制寄主的细胞免疫反应。例如,L.boulardi毒液蛋白中的Ras同源鸟苷三磷酸酶激活蛋白(ras homologous GTPase activating protein,RhoGAP)可通过抑制果蝇血细胞Rho家族的鸟苷三磷酸酶(Rho GTPases)活性,调节果蝇血细胞肌动蛋白细胞骨架、囊泡转运和增殖、改变薄层细胞形态进而降低其黏附能力[20-21]。另外,家蝇蛹期外寄生蜂丽蝇蛹集金小蜂Nasonia vitripennis毒液中的钙网蛋白(calreticulin,CRT)能抑制寄主血细胞的延展反应,从而抑制寄主血细胞包囊反应[22]。毒液蛋白鉴定与分析结果表明,L. heterotoma和L.boulardi毒液蛋白中亦存在CRT组分,其与N.vitripennis的CRT无论在氨基酸序列及结构域上均具有高度的相似性,推测L.boulardi的CRT蛋白亦具有抑制果蝇血细胞包囊反应的功能[16]。L.boulardi毒液蛋白组分P4还可改变薄层细胞的细胞形态,进而抑制果蝇血细胞包囊作用[20]。L.victoriae毒液则可通过抑制果蝇薄层细胞表面蛋白的糖基化,进而改变其生物学特性[23]。果蝇寄生蜂L.heterotoma、A.citri和A.japonica毒液可引起寄主果蝇血细胞死亡或阻断其分化,使血细胞数量下降,进而影响寄主细胞免疫反应[24]。此外,被Ganaspis sp.1寄生后的果蝇幼虫浆血细胞无法向卵迁移并延展,但其血细胞形态无显著变化,因此推测Ganaspis sp.1毒液可能通过抑制浆血细胞激活从而抑制包囊反应[14]。进一步研究结果表明,Ganaspis sp.1毒液蛋白中存在的内质网钙腺苷三磷酸酶(sarco/endoplasmic reticulum calcium ATPase,SERCA)组分能抑制寄主果蝇浆血细胞Ca2+内流,使Ca2+信号通路发生紊乱,以此来抑制浆血细胞激活[14]。
2.3.2 寄生蜂毒液蛋白调控果蝇体液免疫反应
相比于寄生蜂毒液蛋白调控果蝇细胞免疫反应方面的研究,寄生蜂毒液蛋白调控果蝇体液免疫反应的相关研究成果报道较少,主要包括寄生蜂毒液蛋白扰乱寄主抗菌肽合成,抑制寄主血淋巴中酚氧化酶级联反应等[9]。L.boulardi毒液蛋白中的丝氨酸蛋白酶抑制剂(serine protease inhibitor,serpin)组分能显著抑制果蝇幼虫血淋巴中的酚氧化酶原激活反应,进一步研究结果表明,其主要通过干扰寄主酚氧化酶原上游信号通路,进而抑制寄主血淋巴的黑化反应[11-28]。此外,该毒液组分还能抑制二元酚真黑色素前体多巴胺(dopamine,DA)和5,6-二羟基吲哚(5,6-dihydroxy-indole,DHI)的氧化,进而影响寄主果蝇体内的黑化反应[9]。另外,当果蝇被L.boulardi寄生后,其体内的Toll和JAK-STAT信号通路中多个基因表达被抑制,同时还降低了寄主免疫通路下游的Drosomycin和Metchnikowin等多种抗菌肽的合成与表达[11]。
3 小总与展望
果蝇寄生蜂是模式昆虫与重要农业果树害虫的重要天敌,以其为研究对象,开展其与寄主间的互作研究,对于利用寄生性天敌防治植物害虫具有重要的理论与实践指导意义。近年来,随着学者对果蝇寄生蜂毒液蛋白的研究逐步深入,其结构组成、组分分子特性、功能组成与组分作用机理逐渐明晰,这极大深化了昆虫学界对寄生蜂与寄主昆虫之间互作关系的认识,为其他种类寄生蜂毒液蛋白资源挖掘与利用奠定了很好的基础。然而,目前有关寄生蜂毒液蛋白调控果蝇天然免疫反应方面的研究仍然存在诸多不足,尚有许多难题亟待深入解决。就不足之处,主要概括为以下几点:第一,尚缺乏蛹期内寄生蜂及幼虫或蛹期外寄生蜂与果蝇天然免疫反应间的互作研究,其互作机理更是尚未知晓;第二,目前相关研究多局限于单一毒液蛋白组分对果蝇天然免疫反应的调控作用,而有关多组分如何通过协同互作,进而有效调控寄主生理过程的研究尚不足;第三,果蝇与其寄生蜂的协同进化机制亦尚缺乏深入研究。
参考文献:
[1] HOFFMANN J A.Innate immunity of insects[J].Current Opinion in Immunology,1995,7:4-10.
[2] LEMAITRE B,HOFFMANN J.The host defense of Drosophila melanogaster[J].The Annual Review of Immunology,2007,25:697-743.
[3] VLISIDOU I,WOOD W.Drosophila blood cells and their role in immune responses[J].FEBS Journal,2015,282(8):1368-1382.
[4] COLINET D,MATHE-HUBERT H,ALLEMAND R,et al. Variability of venom components in immune suppressive parasitoid wasps:from a phylogenetic to a population approach[J].Journal of Insect Physiology,2013,59(2):205-212.
[5] MARIE M.Blood cells of Drosophila:cell lineages and role in host defence[J].Current Opinion in Immunology,2004,16(1):10-15.
[6] VASS E,NAPPI A J.Fruit fly immunity[J].BioScience,2001,51(7):529-535.
[7] PARSONS B,FOLEY E.Cellular immune defenses of Drosophila melanogaster[J].Developmental and Comparative Immunology,2016,58:95-101.
[8] IMLER J L.Overview of Drosophila immunity:a historical perspective[J].Developmental and Comparative Immunology,2014,42(1):3-15.
[9] TANG H P.Regulation and function of themelanization reaction in Drosophila[J].Fly,2014,3(1):105-111.
[10] NAPPI A.Cellular immunity and pathogen strategies in combative interactions involving Drosophila hosts and their endoparasitic wasps[J].Insect Science,2010,7:198-210.
[11] SCHLENKE T A,MORALES J,GOVIND S,et al.Contrasting infection strategies in generalist and specialist wasp parasitoids of Drosophila melanogaster[J].PLoS Pathogens,2007,3(10):e158.
[12] GREGORIO E D.The Toll and Imd pathways are the major regulators of the immune response in Drosophila[J].The EMBO Journal,2002,21(11):2568-2579.
[13] WERTHEIM B,KRAAIJEVELD A R,SCHUSTER E,et al. Genome-wide gene expression in response to parasitoid attack in Drosophila[J].Genome Biology,2005,6(11):R94.
[14] MORTIMER N T,GOECKS J,KACSOH B Z,et al.Parasitoid wasp venom SERCA regulates Drosophila calcium levels and inhibits cellular immunity[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(23):9427-9432.
[15] ASGARIS,RIVERS D B.Venom proteins from endoparasitoid wasps and their role in host-parasite interactions[J].Annual Review of Entomology,2011,56:313-335.
[16] MOREAU S J,ASGARI S.Venom proteins from parasitoid wasps and their biological functions[J].Toxins(Basel),2015,7(7):2385-2412.
[17] GOECKS J,MORTIMER N T,MOBLEY JA,et al.Integrative approach reveals composition of endoparasitoid wasp venoms[J].PLoSOne,2013,8(5):e64125.
[18] 朱家颖,叶恭银,胡萃.寄生蜂毒液蛋白的研究进展[J].植物保护学报,2008,35(3):270-278.
[19] POIRIM,COLINET D,GATTI J-L.Insights into function and evolution of parasitoid wasp venoms[J].Current Opinion in Insect Science,2014,6:52-60.
[20] MORTIMER N T.Parasitoid wasp virulence[J].Fly,2013,7(4):242-248.
[21] LABROSSE C,STASIAK K,LESOBRE J,et al.A RhoGAP protein as a main immune suppressive factor in the Leptopilina boulardi(Hymenoptera,Figitidae)-Drosophila melanogaster interaction[J].Insect Biochemistry and Molecular Biology,2005,35(2):93-103.
[22] COLINET D,SCHMITZ A,DEPOIX D,et al.Convergent use of RhoGAP toxins by eukaryotic parasites and bacterial pathogens[J].PLoS Pathogens,2007,3(12):e203.
[23] RIVERS D B,BROGAN A.Venom glands from the ectoparasitoid Nasonia vitripennis(Walker)(Hymenoptera:Pteromalidae)produce a calreticulin-like protein that functions in developmental arrest and cell death in the flesh fly host,Sarcophaga bullata Parker(Diptera:Sarcophagidae)[J]. Insect Physiology:New Research,2008:259-278.
[24] MORTIMER N T,KACSOH B Z,KEEBAUGH E S,et al.Mgat1-dependent N-glycosylation of membrane components primes Drosophila melanogaster blood cells for the cellular encapsulation response[J].PLoS Pathogens,2012,8(7):e1002819.
[25] LABROSSE C,ESLIN P,DOURY G,et al.Haemocyte changes in D.Melanogaster in response to long gland components of the parasitoid wasp Leptopilina boulardi:a Rho-GAP protein as an important factor[J].Journal of Insect Physiology,2005,51(2):161-170.
[26] Moreau S J M,Eslin P,Giordanengo P,et al.Comparative study of the strategies evolved by two parasitoids of the genus Asobara to avoid the immune response of the host,Drosophila melanogaster[J].Developmental and Comparative Immunology,2002,27(4):273-282.
[27] MABIALA-MOUNDOUNGOU A D,DOURY G,ESLIN P,et al.Dead ly venom of Asobara japonica parasitoid needs ovarian antidote to regulate host physiology[J].Journal of Insect Physiology,2010,56(1):35-41.
[28] COLINET D,DUBUFFET A,CAZES D,et al.A serpin from the parasitoid wasp Leptopilina boulardi targets the Drosophila phenoloxidase cascade[J].Developmental and Comparative Immunology,2009,33(5):681-689.
(责任编辑:张 韵)
S186
:A
:0528-9017(2016)12-1951-05
文献著录格式:杨磊,方琦,黄佳,等.果蝇天然免疫与寄生蜂毒液蛋白对其调控研究进展[J].浙江农业科学,2016,57(12):1951-1955.
10.16178/j.issn.0528-9017.20161204
2016-09-20
国家自然学科基金面上项目(31272098,31472038)
杨 磊(1993—),男,湖北十堰人,博士研究生在读,研究方向为农业昆虫与害虫防治,E-mail:yanglei@zju.edu.cn。
叶恭银(1966—),男,浙江建德人,博士,教授,研究方向为害虫生物防治及昆虫生理生化与分子生物学,E-mail:chu @zju.edu.cn。

