预处理和播种方式对朱丽叶种子萌发的影响
郝渊鹏,李浩铮,刘笑笑,王慧芳,尹艺臻,李伟,杜方
(1.山西农业大学农学院,山西太谷030801;2.山西农业大学园艺学院,山西太谷030801)
预处理和播种方式对朱丽叶种子萌发的影响
郝渊鹏1,李浩铮1,刘笑笑1,王慧芳1,尹艺臻1,李伟1,杜方2
(1.山西农业大学农学院,山西太谷030801;2.山西农业大学园艺学院,山西太谷030801)
以新铁炮百合朱丽叶当年采收种子为材料,对种子分别进行室温浸泡3 d,室温浸泡5 d,4℃浸泡5 d和不浸泡预处理后,再分别进行无菌播种、培养皿播种和穴盘播种,研究促进朱丽叶种子发芽的最佳方式。结果表明,以无菌的方式播种,4℃浸泡5 d并剥皮处理,第10天即可发芽,第45天发芽率最高(97.78%),并且幼苗长势也较其他处理健壮;以培养皿的方式播种,室温浸泡3 d或5 d且不剥皮处理的方式优于其他各处理,第15天开始发芽,第50天发芽率最高(83%);田园土∶锯末为3∶1配制的播种基质并不适合朱丽叶种子的萌发。
新铁炮百合;种子;低温;剥皮;无菌播种
全世界有百合科(Liliaceae)百合属(Lilium)植物100多种,均具有很高的观赏价值。百合属植物主要依靠分球繁殖和鳞片扦插繁殖,种子繁殖主要用于育种或种质资源的保存。为充分利用好原产于我国的百合属种质资源,许多学者对我国原产的易于自然结实的百合属植物进行了种子繁殖的生物学特性研究[1-9]。然而,这些百合属植物从种子到开花需2~3 a的时间。
我国台湾地区的高砂百合(L.formosanum)是一种种子繁殖当年成花的百合,具有优良的抗热性。20世纪20年代,日本的西村氏将其与铁炮百合(L.longiflorum)杂交,获得了花大瓣厚、花型别致、花期长的一种新型百合,命名为新铁炮百合(L.formolongi),并经过多次改良,形成了新铁炮百合杂种系[10-11]。该杂种系花朵朝天开放,有别于普通铁炮百合向前开放的特性,特别适合做鲜切花[12],已成为我国新兴的外来百合品种。为了利用好这一特殊资源,有学者从温度、光照和药剂处理等方面探讨了使新铁炮百合杂种系快速、整齐出苗的条件[10-11,13-14]。现有的研究表明,新铁炮百合种子的萌发对光照并不敏感,30℃高温不利于种子的萌发,利用药剂(聚乙烯醇和聚乙二醇)处理种子对发芽并无明显影响[10],种子的褐色膜状种皮对种子的顺利发芽有抑制作用[15-16],低温对亚洲百合萌发有促进作用[17],然而尚不明确播种前低温和浸泡处理以及播种方式对新铁炮百合种子发芽有怎样的影响。
本研究以新铁炮百合朱丽叶(Julius)为材料,研究百合种子膜的去除、浸泡、低温等播种前处理以及有菌和无菌播种方式对朱丽叶种子萌发的影响,旨在找出新铁炮百合朱丽叶的最佳播种方式,为促进该品种在生产上的快速推广提供技术支持。
1 材料和方法
1.1 材料
2015年9月于山西农业大学园艺站采收新铁炮百合朱丽叶自交后充分成熟的蒴果,选择颗粒饱满、胚清晰的种子作为试验材料(图1)。

1.2 方法
试验于2015年10—12月在山西农业大学园艺学院组织培养实验室及园艺试验站日光温室内进行。试验设培养方式、种子浸泡时间和温度、种皮是否剥除3个处理。培养方式设3个水平:无菌播种、培养皿播种和穴盘播种(其中,穴盘播种不设去除种皮的处理);浸泡时间和温度设4个水平:不浸泡、室温浸泡3 d、室温浸泡5 d和4℃浸泡5 d;种皮是否剥除设2个水平:剥除和不剥除。试验共20个处理,每处理60粒种子,重复3次,共用3 600粒种子。
1.2.1 浸泡处理用普通自来水对种子进行浸泡,10月6日浸泡,一部分放在室内,一部分放在4℃冰箱内。
1.2.2 剥皮处理10月9,11日播种前,将每一处理分成2份,其中一份种子用镊子和刀片小心刮擦,去除褐色种皮。因不浸泡处理的种子种皮不易去除,在播种前,将种子浸入水中,去除了其他处理的种皮后,再去除不浸泡种子的种皮。
1.2.3 无菌播种种子在自来水下冲洗2 h,在超净工作台上用75%乙醇消毒30s,无菌水冲洗3次,然后用2%NaClO消毒6 min,最后用无菌水冲洗6~7次。需要剥皮的种子,在超净工作台上用手术刀去除种子外面褐色的种皮,然后将处理好的种子每10粒放入一个培养瓶。对于无需剥皮的种子消毒后放在滤纸上吸干水分,每10粒放入一个培养瓶中,每个处理重复3次。无菌播种培养基为MS培养基(pH值5.9),每1 L培养基中含30 g蔗糖、4.74 g MS粉和5.5 g琼脂粉,不添加任何激素。培养基在121℃下灭菌20 min。播种完毕后将培养瓶放置在无菌室,前期遮光处理,发芽后,去掉遮光布。组培室每天光照14 h,温度(25±2)℃。
1.2.4 培养皿播种将培养皿洗净后,铺一层滤纸,用自来水打湿,每皿摆15粒种子,放入25℃培养室内培养。3 d检查一次,如果滤纸干燥则需及时补水。
1.2.5 穴盘播种以田园土∶锯末为3∶1的比例配制播种基质,将基质装入穴盘,喷水,点播,播种后覆土0.5 cm,再喷透水,覆膜保温保湿。
1.3 观察与统计
采用肉眼观察的方法,每隔5 d观察一次,直至种子发芽完毕。萌发标志以胚根突破种皮为准。
发芽率=发芽种子数/播种种子总数×100%;污染率=污染种子数/播种种子总数×100%。
1.4 数据分析
采用DPS软件分析试验结果,数据分析时进行反正弦的转换,并采用Duncan新复极差法进行方差分析。
2 结果与分析
2.1 无菌播种各处理对发芽率的影响
由表1可知,无菌播种在去种皮的条件下,播种50 d后,4℃浸泡5 d的发芽率最高,为97.78%;不浸泡和室温浸泡3 d的发芽率差异不显著,分别为87.78%和82.22%;室温浸泡5 d的发芽率最低,仅为55.00%,而且50 d时,污染率达88.89%。
无菌播种在不去种皮的条件下,播种50 d后,不浸泡和4℃浸泡5 d的发芽率分别为76.29%和70.00%,差异不显著;而室温浸泡3,5 d的处理发芽率均不到30%,且污染率均大于50%。
无论是否进行剥皮处理,室温浸泡5 d后进行无菌播种,发芽率均最低,且与其他处理差异显著。
当不浸泡种子直接无菌播种时,不论是否剥皮,发芽率均在80%左右,差异不显著。而室温浸泡3,5 d和低温浸泡各处理,剥皮的发芽率显著大于不剥皮各处理。
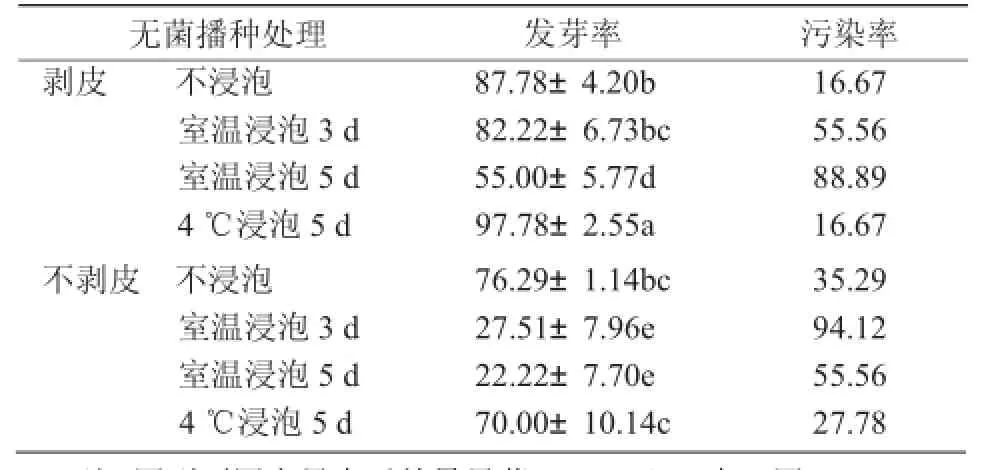
表1 无菌播种50 d后各处理发芽率和污染率比较%
2.2 无菌播种各处理对发芽速度的影响
由图2可知,无菌播种去种皮的条件下,各处理在第10天均有一定发芽率,之后发芽率随天数的增加缓慢增加。4℃浸泡5 d的处理在第10天发芽率达83.33%,到第45天达最大值(97.78%)。不浸泡和室温浸泡3 d的处理,第10天发芽率均大于65.00%,分别在第45天和第30天达最大值(之后因种子污染而不再发芽)。相较而言,室温浸泡5 d的处理,发芽慢且发芽率低,10 d时,仅有41.67%的发芽率,到第35天,发芽率也仅为52.22%。
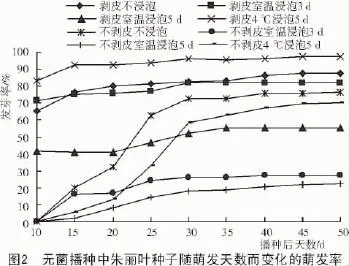
无菌播种不去种皮时,发芽较去种皮处理迟,15 d时才可看到种子萌发,不浸泡和4℃浸泡5 d的发芽率到第30天时达最大值,分别为72.87%和58.33%;室温浸泡3,5 d,发芽率低,没有明显的发芽拐点(图2)。
2.3 培养皿播种各处理对发芽率的影响
剥皮与否对培养皿播种种子发芽率的影响很大。由表2可知,不剥皮各处理的发芽率显著高于剥皮各处理,且不剥皮各处理污染率均小于10%,而剥皮各处理污染率均为100%。其中,不剥皮直接进行培养皿播种的,播种50 d后,室温浸泡3,5 d的发芽率分别为82.78%和85.40%,且差异不显著;4℃浸泡5 d和不浸泡的发芽率分别为79.03%和72.22%,差异也不显著。
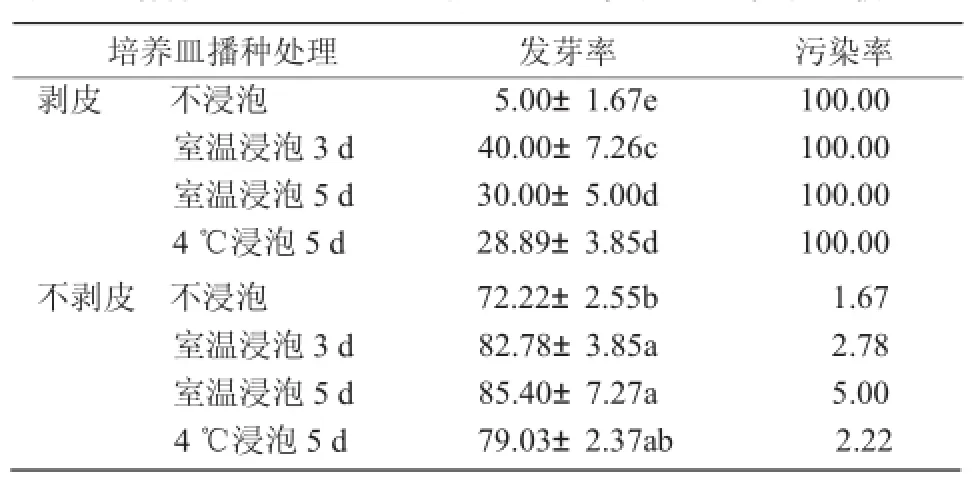
表2 培养皿播种50 d后各处理发芽率和污染率比较%
剥皮后进行培养皿播种的,播种50 d后,室温浸泡3 d的发芽率显著高于其他处理,发芽率为40.00%;室温浸泡5 d和4℃浸泡5 d的发芽率间差异不显著,分别为30.00%和28.89%;不浸泡的发芽率最低,仅为5.00%。
无论是否进行剥皮处理,不浸泡直接进行培养皿播种,发芽率均最低,且与其他处理相比差异显著。
2.4 培养皿播种各处理对发芽速度的影响
由图3可知,去种皮后将百合种子播于培养皿中,各处理在第10天均有一定发芽率;15 d后,室温浸泡3,5 d和4℃浸泡5 d的发芽率均达到最高,分别为40.00%,30.00%和28.89%;之后,因种子污染严重,发芽率不再增加。相较而言,不浸泡但去种皮的,发芽慢且发芽率低,第10天仅有3.89%的发芽率,而到第15天,发芽率也仅为5.00%。
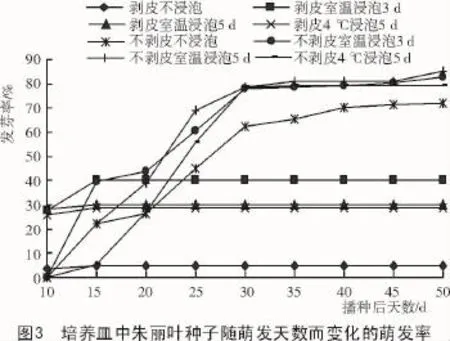
不去种皮进行培养皿播种时,发芽较去种皮处理迟,15 d时才可看到各处理的种子萌发。发芽后,发芽率随天数的增加而快速增加,到第30天时,发芽率达到拐点,第50天发芽率达到最大值。相较不浸泡和室温浸泡3,5 d的处理,4℃浸泡5 d的处理第15天虽有发芽,但发芽率仅为5.42%,不过,第15~30天这段时间,发芽率直线增长,到第35天达到最大值(79.03%)。
2.5 无菌播种、培养皿播种及穴盘播种对发芽率的影响
统计分析表明,无菌播种处理的平均发芽率(61.09%)高于培养皿播种处理的平均发芽率(50.16%)。由于田园土∶锯末为3∶1配制的播种基质并不适合朱丽叶的种子萌发,穴盘播种的发芽率不足1%。
2.6 无菌播种各处理对幼苗长势的影响
由图4可知,无菌播种各处理方式对发芽后幼苗的生长有影响。综合来看,剥皮处理要好于未剥皮处理。剥皮处理的叶数较多,叶片宽厚,叶色浓绿,长势健壮。其中,室温浸泡3 d和4℃浸泡5 d的长势相近,幼苗最为健壮,不浸泡稍次之,室温浸泡5 d的长势最弱。在不剥皮的处理中,4℃浸泡5 d和不浸泡稍次之,室温浸泡5 d和室温浸泡3 d的发芽率低,长势也弱,后期污染严重。

3 结论与讨论
多数百合种子发芽的时间为20~30 d。本试验结果表明,预处理得当,生活力强的朱丽叶种子在第10天即可发芽。不过,绝大多数朱丽叶种子,在30~50 d内才能发芽整齐,可能是由于植株个体差异和种子在蒴果内着生部位差异所造成的。
吴昀等[15]研究认为,百合属种子的膜质种皮会抑制百合种子的萌发,如未经剥皮处理的药百合(L.speciosum var.gloriosoides)种子即使在无菌条件下播种30 d后,也没有任何萌动迹象。但马怡迪等[16]研究认为,无菌播种时,不剥皮处理巨球百合(L.brownii var.giganteum)种子也有一定的萌发率,当培养基中激素配比适宜,其种子的萌发率还可能超过90%。本试验结果与马怡迪等[16]的结论有一定的相似性,朱丽叶种子无菌播种时,不剥皮种子也有一定的发芽率,但剥皮处理更利于种子萌发。可见,播种时是否需要进行剥皮处理与种子的基因型有关。研究还发现,以培养皿的方式播种,剥皮处理反而会造成严重污染,不剥皮处理的反而会减少污染概率。可见,播种时是否需要进行剥皮处理还与播种方式有关。
正因为考虑到种皮会影响百合种子发芽,本试验试图探明浸泡时间是否会对朱丽叶种子的萌发产生影响。结果发现,室温浸泡时间越长,越有可能引起发芽过程中的污染问题,室温浸泡3 d或5 d的发芽率差异不显著,这与郎利新等[18]的研究结果相似。
温度是影响种子萌发的又一因素,低温预处理有助于提高种子在高温下的发芽率[12-13]。本试验研究发现,无菌播种时,4℃低温浸泡5 d后剥皮处理,确实显著提高了朱丽叶种子在(25±2)℃的发芽率,但是,以培养皿的方式进行播种,低温浸泡对种子萌发的影响与室温浸泡的差异不显著,可见播种前是否需要低温浸润处理,与播种方式有很大关系。
总之,本试验研究发现,播种前的预处理方式对新铁炮百合朱丽叶发芽的影响与播种方式有直接关系。以无菌的方式播种,最佳预处理方式为4℃浸泡5 d并剥皮处理;而以培养皿的方式播种,室温浸泡3 d或5 d且不剥皮处理的发芽率要显著高于其他各处理。田园土∶锯末=3∶1配制的播种基质并不适合朱丽叶种子萌发。
[1]杨利平,杨青杰,文惠民.细叶百合的种子萌发[J].东北林业大学学报,2002,30(5):70-72.
[2]孙晓玉,杨利平,姜浩野,等.条叶百合种子萌发的研究[J].植物研究,2003,13(1):61-65.
[3]何丽萍,李龙根,庞祖云.野生泸定百合种子休眠和萌发习性的研究[J].种子,2010,29(4):46-49.
[4]杨炜茹,张启翔.崛江百合种子萌发的研究[J].种子,2008,27(11):5-7.
[5]张方,于海滨,张显国,等.毛百合繁殖生物学研究(III)——毛百合种子萌发特性[J].东北林业大学学报,1994,22(2):46-51.
[6]胡蓬清,肖海燕,刘青林.垂花百合种子发芽试验[J].现代园林,2015,12(4):250-254.
[7]张凌云.濒危植物青岛百合种子的形态特征与萌发特性[J].江苏农业科学,2014,42(7):193-194.
[8]王丽花,杨秀梅,瞿素萍.温度和播种基质对5种野生百合种子发芽特性的影响[J].江苏农业科学,2012,40(5):129-131.
[9]栗艳龄,梁建萍,罗凤霞.切花百合杂种胚抢救方法[J].山西农业科学,2012,40(6):566-570.
[10]韩秀丽,贾桂霞.新铁炮百合不同品种种子适宜萌发条件的研究[J].林业科学研究,2008,21(5):729-733.
[11]王新颖,李智辉,邢致远.新铁炮百合种子萌发的研究[J].种子,2006,25(9):14-16.
[12]丁兰,刘国安,田卫东,等.新铁炮百合组织培养和快速繁殖研究[J].西北师范大学学报:自然科学版,2001,3(1):80-82.
[13]何泽明,温文兴,王凤兰,等.新铁炮百合种子发芽技术研究[J].广东农业科学,2011(16):33-34.
[14]李智辉,鲁明,祝朋芳,等.新铁炮百合的播种育苗技术研究[J].辽宁农业科学,2002(3):44-45.
[15]吴昀,马怡迪,张琳,等.药百合种子萌发及染色体倍性检测[J].中国农学通报,2013,29(13):153-157.
[16]马怡迪,李岳,李丹青,等.巨球百合无菌播种影响因素的研究[J].湖南农业大学学报,2015,41(3):271-275.
[17]崔光芬,杜文文,段青,等.不同倍性亚洲百合的花粉形态与活力变化规律分析[J].华北农学报,2015,30(增刊):55-60.
[18]郎利新,白锦荣,孔滢,等.浸泡和切割处理对东方百合杂交种子萌发的影响[J].种子,2015,34(7):74-77.
Effects of Preliminary Treatment Methods and Sowing Way on Germination ofLilium formolongiJulius Seeds
HAOYuanpeng1,LI Haozheng1,LIUXiaoxiao1,WANGHuifang1,YINYizhen1,LI Wei1,DUFang2
(1.College ofAgronomy,Shanxi Agricultural University,Taigu 030801,China;2.College ofHorticulture,Shanxi Agricultural University,Taigu 030801,China)
To explore the best way for Lilium formolongi Julius seeds germination,newly collected seeds treated preliminarily in different methods were used.After preliminary treatment of lower temperature,soak time or removal of seed coat,seeds of Julius were sowed in sterile bottles,petri dishes and soil substrate.The result showed that if one sowed Julius seeds in a sterile manner,the highest germination speed(ten days)and germination rate(97.78%)were gained after seeds were soaked in 4℃for five days and the seed coats were removed.Ifone sowed Julius seeds in petri dishes,the highest germination speed(fifteen days)and germination rate(83%)were gained after seeds were soaked in roomtemperature for three or five days and the seed coats were not removed.Sowingsubstrate ofgarden soil with sawdust(3∶1)is not suitable for Julius seeds germination.
Lilium formolongi;seeds;lowtemperature;peeling;sterile sowing
S682.2+9
A
1002-2481(2016)12-1785-05
10.3969/j.issn.1002-2481.2016.12.11
2016-07-26
山西省应用基础研究项目(201601D011077);山西省普通高等学校大学生创新性创业训练项目(2015099,2015102);山西农业大学引进人才科研启动项目(2014ZZ02)
郝渊鹏(1994-),男,山西长治人,在校学生,研究方向:观赏植物种质资源及分子育种。杜方为通信作者。

