铜绿微囊藻对褶皱臂尾轮虫种群生长的影响
谢钦铭, 骆和东, 魏 施, 江兴龙, 林伟彬
(1.集美大学水产学院,福建厦门 361021;2.鳗鲡现代产业技术教育部工程研究中心,福建厦门 361021;3.厦门市疾病预防控制中心公共卫生监测科,福建厦门 361021)
铜绿微囊藻对褶皱臂尾轮虫种群生长的影响
谢钦铭1,2, 骆和东3, 魏 施1, 江兴龙1,2, 林伟彬1
(1.集美大学水产学院,福建厦门 361021;2.鳗鲡现代产业技术教育部工程研究中心,福建厦门 361021;3.厦门市疾病预防控制中心公共卫生监测科,福建厦门 361021)
[目的]探讨铜绿微囊藻对轮虫种群生长的影响。[方法]先观察单一食物条件下轮虫的成活状况,再用混合食物喂养轮虫,研究混合食料中不同浓度铜绿微囊藻对轮虫种群密度的影响。[结果]单一食物条件下,褶皱臂尾轮虫以小球藻、酵母菌为食时种群持续增长,铜绿微囊藻 Ⅰ 组轮虫的种群密度能保持6 d以上,铜绿微囊藻 Ⅱ 组褶皱轮虫仅能存活4 d,而对照组轮虫能存活7 d。在混合食料的培养试验中,当轮虫处于低浓度铜绿微囊藻(1.0×104cells/mL)的环境时,种群密度的增长前3 d不受明显影响,第4天后轮虫种群增长受到一定抑制,而处于高浓度铜绿微囊藻(1.0×106cells/mL)的环境时轮虫第6天死亡。[结论]该研究结果可为今后研究微球藻对生态的影响提供参考依据。
铜绿微囊藻; 褶皱臂尾轮虫; 种群; 生长
近年来,由于人类生产生活过程中大量工业废水和生活污水未经处理而随意排放,造成淡水水体富营养化,导致每年夏秋季之间在一些淡水湖泊、河流中常见到“水华”现象,致使水体感官性状恶化,严重影响供水水质和破坏生态平衡。水体富营养化进程加快的结果是湖泊的生态系统遭到破坏, 生物多样性迅速下降,浮游动物和鱼类有小型化的趋势。在退化的淡水生态系统中,许多水生植物和鱼类的种群也严重退化,甚至灭绝,在这一系列生态恶化过程中淡水藻类所产生的微囊藻毒素可能起到一定作用,因此微囊藻对生态系统的影响受到生态环境研究者的广泛重视。淡水藻毒素是某些生活在淡水中的藻类产生的次生代谢物,这些次生代谢物可污染淡水水体或饮用水源,进而通过食物链毒化其他淡水水生动植物或饮用水,并通过食物链进入人体,对人类健康产生严重危害[1-2]。在所有的淡水产毒藻类中,已知毒性最高、污染分布范围最广的是蓝藻[3],其中可产生毒素的蓝藻主要包括铜绿微囊藻(Microcystisaeruginosa)、水华鱼腥藻(Anabaenaflosaquae)等。水华蓝藻对浮游动物的危害不仅会导致浮游动物群落结构的变动[4-5],而且对鱼虾等的次级生产力也会产生深远的影响[6-7],更为严重的是,某些藻类还可以产生毒素,对人类健康造成危害,长期饮用被微囊藻毒素污染的水可能对人体肝脏有损伤作用,影响血清中某些酶指标[8-9]。
1 材料与方法
1.1 轮虫的来源和培养 使用采水器在厦门集美敬贤公园湖水2 m深处采水后沉淀分离,并用浮游动物网过滤,在解剖镜下分离出轮虫,并鉴定为褶皱臂尾轮虫(Brachionusplicatilis)。将其在室内小烧杯中用单胞藻液、酵母等饵料进行培育,培养3~5 d,当轮虫密度为30~50 ind./mL时,全部采收。采收、清理烧杯后,重新培养第2代用于试验[14]。
1.2 铜绿微囊藻的来源和培养 铜绿微囊藻PCC7820,购自武汉水生生物研究所。将其接种于BG11 培养液中, 在温度(20±4)℃、自然光线条件下连续培养,调节pH至7.1。
1.3 试验设计
1.3.1 单一食物条件下的培养试验。分别以小球藻(Chlorellavulgaris)、酵母菌(Saccharomyces)和铜绿微囊藻作为食物喂养轮虫,另外以不添加食物(即饥饿)作为对照组。试验设置5个处理组,小球藻组用小球藻喂养轮虫,小球藻浓度为5.0×105cells/mL;酵母菌组用酵母菌喂养轮虫,酵母菌浓度为5.0×105cells/mL;铜绿微囊藻 Ⅰ 组和铜绿微囊藻 Ⅱ 组均用铜绿微囊藻喂养轮虫,铜绿微囊藻浓度分别为1.0×104和1.0×106cells/mL。单一食物条件下的培养试验设计见表1。每组3 个重复,每个重复10只轮虫幼体,分别放入含不同浓度食物的10 mL 培养液中进行群体累积培养。每天统计轮虫的数量,同时更换新鲜的培养液(使用250~300目滤网将原来的培养液滤除5 mL, 然后加入相应5 mL新的培养液),试验持续7 d。
1.3.2 混合食物条件下的培养试验。混合食物条件下的培养试验设置3个处理组(M0、M1、M2),各组小球藻的浓度均为5.0×105cells/mL,各组铜绿微囊藻浓度分别为0、1.0×104和1.0×106cells/mL,每组3个重复,每个重复10只褶皱臂尾轮虫。混合食物条件下轮虫的培养试验设计如表2所示。培养液体积为10 mL,其他条件(如温度、光照等)与预培养相同。每天统计轮虫数量,同时更换新鲜的含有相应浓度食物的培养液,试验共持续7 d。
表2 混合食物条件下轮虫的培养试验设计
Table 2 The experimental design for the culture test of rotifers under the conditions of mixed food

组别Group轮虫数Numberofrotifers∥只小球藻浓度ConcentrationofC.vulgariscells/mL铜绿微囊藻ConcentrationofM.aeruginosacells/mLM0305.0×105—M1305.0×1051.0×104M2305.0×1051.0×106
1.4 定量技术分析法 铜绿微囊藻培养液和小球藻的培养液浓度采用血球计数板计数方法[15]计数,显微镜下统计每个样品单位体积(铜绿微囊藻和小球藻各计数0.02 mm3)中总个体数以及总细胞数,从而计算出上述藻类的密度和平均每个个体的细胞数量;利用1 mL的浮游生物计数框在解剖镜下观察轮虫并计数。
(2) P2Y12受体抑制剂:除非有极高出血风险等禁忌证,在阿司匹林基础上应联合应用1种P2Y12受体抑制剂并维持至少12个月(Ⅰ,A)。选择包括替格瑞洛(180mg负荷剂量,90mg、2次/d维持)或氯吡格雷(负荷剂量300mg~600mg,75 mg/d维持)(Ⅰ,B)。
1.5 数据处理 试验数据使用Excel 2003(SP1)软件进行处理,使用SPSS 13.0统计软件进行统计与分析,多组间比较采用方差齐性检验和单因素方差分析(One-way ANOVA),对处理组和对照组的试验结果进行显著性检验。进行组间两两比较时,若方差齐时,采用SNK检验;若方差不齐时,采用Games-Howell检验。P<0.05表示差异显著。
2 结果与分析
2.1 单一食物对轮虫种群密度的影响 由表3可知,褶皱臂尾轮虫在以小球藻为食时种群持续增长。试验结束时,轮虫种群密度达(9.93±0.45)ind./mL;以酵母菌为食时,轮虫种群数量亦持续增长,试验结束时轮虫种群密度达(10.34±0.61)ind./mL;其他组轮虫均无法维持种群持续增长,对照组轮虫仅存活7 d;低浓度(1.0×104cells/mL)的铜绿微囊藻Ⅰ 组的轮虫种群密度在第5天后开始增长,第9天轮虫种群密度达到高峰,然后轮虫种群增长停止,第10天种群密度开始明显减少;高浓度(1.0×106cells/mL)铜绿微囊藻 Ⅱ 组的褶皱轮虫仅存活4 d。
2.2 混合食物中不同浓度铜绿微囊藻对轮虫种群密度的影响 由表4可知,铜绿微囊藻对褶皱臂尾轮虫的种群密度有显著影响。当轮虫处于低浓度(1.0×104cells/mL)的铜绿微囊藻环境时,第1~3天种群密度的增长未受明显影响,在高浓度(1.0×106cells/mL)的铜绿微囊藻环境时轮虫种群密度的增长第1~2天未受到明显影响,但第3天后轮虫种群密度的增长受到明显抑制。高浓度(1.0×106cells/mL)铜绿微囊藻 Ⅱ 组第7天轮虫种群全部消亡。
3 讨论与结论
3.1 单一食物对轮虫种群密度的影响 当褶皱臂尾轮虫以小球藻和酵母菌为食物时,轮虫种群持续增长,轮虫在初期种群密度略有上升,仅约为1.30 ind./mL,这可能与温度、轮虫生活习性的适应性有关;随后,轮虫种群密度总体上呈持续上升增长,在培养结束时小球藻组轮虫种群密度达9.93 ind./mL,而酵母菌组轮虫密度达10.34 ind./mL,略高于小球藻组,但差异不显著。除了小球藻组与酵母菌组外,其他组褶皱臂尾轮虫均无法维持种群增长,对照组轮虫由于没有食物来源仅存活7 d。

表3 单一食物对轮虫种群密度的影响
注:同列不同小写字母表示差异显著(P<0.05)。
Note:Different small letters in the same column indicate significant difference(P<0.05).
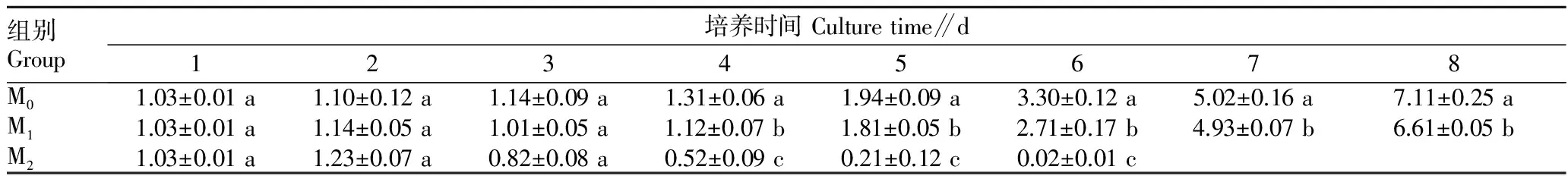
表4 混合食物中不同浓度铜绿微囊藻对轮虫种群密度的影响
注:同列不同小写字母表示差异显著(P<0.05)。
Note:Different small letters in the same column indicate significant difference(P<0.05).
低浓度的铜绿微囊藻(1.0×104cells/mL)Ⅰ 组的轮虫种群密度在初期呈现增长状态,在低浓度的铜绿微囊藻培养液环境下轮虫对其有一定的耐受性。由于轮虫对食物颗粒的选择性一般仅依赖于颗粒物大小,并无选择性,这种不加选择导致摄食的微囊藻对其生理活动产生负面影响[3], 小球藻所提供的营养远高于铜绿微囊藻[14]。蓝藻较低的营养价值使得轮虫摄取的铜绿微囊藻不足以弥补减少的那部分小球藻,抑制了轮虫种群增长[7]。该试验中第6天以后低浓度的微囊藻组轮虫种群密度的增长趋势减缓,第7~9天仅轮虫种群密度保持平衡状态,且第10天后种群密度开始减少。
该试验结果表明高浓度的铜绿微囊藻(1.0×106cells/mL) Ⅱ 组,试验轮虫个体在第4天大量死亡,第6天轮虫种群即消失。当轮虫在某种微囊藻存在时,轮虫个体死亡明显快于饥饿状态下,表明该种蓝藻对这种浮游动物有毒害作用[16]。该研究中的单一食物试验中尽管处理组轮虫对铜绿微囊藻有一定的耐受性,但高浓度铜绿微囊藻(1.0×106cells/mL)的存在仍然强烈抑制了轮虫种群增长,降低了轮虫的存活率,可能是由于微囊藻浓度的升高,藻毒素含量增加,从而加大了对轮虫种群的抑制作用。
3.2 混合食物中不同浓度铜绿微囊藻对轮虫种群密度的影响 该试验中对照组食料中仅有小球藻,由于每天更换新鲜的含有相应浓度食物的培养液,轮虫有充足的食物来源,其种群密度呈现持续上升状态,第8天试验结束时种群密度达7.11 ind./mL。M1组铜绿微囊藻浓度为1.0×104cells/mL,轮虫的种群密度在初期处于平滑状态,此后持续上升,第1~3天轮虫种群密度增长与对照组无显著差异,总体而言,轮虫种群密度略低于对照组,说明低浓度的铜绿微囊藻对轮虫种群密度无显著影响。第4天后,M1组轮虫种群密度的增长略低于对照组。但是,由于轮虫摄食不加选择,铜绿微囊藻的存在抑制了其对小球藻的摄食。在单一食物试验中,低浓度(1.0×104cells/mL)的铜绿微囊藻 Ⅰ 组的轮虫种群密度在后期处于平衡状态,这是由于蓝藻较低的营养价值使得轮虫摄取的铜绿微囊藻不足以弥补减少的那部分小球藻[7],因此该试验中低浓度(1.0×104cells/mL)的铜绿微囊藻 Ⅰ 组轮虫的种群密度要稍微低于小球藻对照组。M2组轮虫种群密度第7~8天为0。尽管轮虫对铜绿微囊藻有一定的耐受性,但在高浓度(1.0×106cells/mL)铜绿微囊藻存在时,仍然强烈抑制了轮虫种群增长以及轮虫的存活率和繁殖率等。由于微囊藻浓度的升高,藻毒素含量增加,从而加大了对轮虫种群的抑制作用。微囊藻浓度的升高,轮虫摄取的食物中小球藻所占的比例相对减少,从而严重影响了轮虫对小球藻摄食,抑制了轮虫种群密度的增长。
综上所述,在低浓度(1.0×104cells/mL)的铜绿微囊藻环境中褶皱臂尾轮虫的种群密度未受到严重抑制,并能从铜绿微囊藻中摄取一定营养以供其生长繁殖。高浓度(1.0×106cells/mL)铜绿微囊藻能强烈影响轮虫的存活和繁殖,从而抑制轮虫种群密度的增长。
3.3 铜绿微囊藻对浮游轮虫种群生态的影响 耿红[17]通过不同浓度铜绿微囊藻条件下萼花臂尾轮虫(Brachionuscalyciflorus)群体的培养试验表明,当铜绿微囊藻浓度为1.0×104和1.0×105cells/mL时,铜绿微囊藻对萼花臂尾轮虫的存活率、繁殖率、内禀增长率和净生殖率等均无抑制作用。尽管萼花臂尾轮虫对铜绿微囊藻有一定的耐受性,高浓度(1.0×105cells/mL)铜绿微囊藻的存在仍然强烈抑制了轮虫种群增长以及轮虫的存活率和繁殖率等。Fulton等[18]研究表明,萼花臂尾轮虫在仅喂食铜绿微囊藻时的存活时间长于饥饿组,且轮虫仍有一定的繁殖,萼花臂尾轮虫能抵抗微囊藻毒素,并从铜绿微囊藻中获取一定的营养,利用其作为辅助食物来源。Rothhaupt[19]研究表明,单独投喂1.0×105cells/mL铜绿微囊藻时红臂尾轮虫(Brachionusrubens)的存活时间短于饥饿对照组,铜绿微囊藻对红臂尾轮虫的种群有明显的毒害作用。该试验结果也证实,与萼花臂尾轮虫相比,铜绿微囊藻对红臂尾轮虫和褶皱臂尾轮虫种群的抑制作用非常明显,因此轮虫种群的增长对有毒铜绿微囊藻的敏感性随轮虫种类的不同而有差异。参考文献
[1] 李效宇,李磊.微囊藻毒素与人类健康关系研究进展[J].中国公共卫生,2008,24(8):1076-1077.
[2] 谢钦铭,张燕伟,孔江红.铜绿微囊藻通过食物链对红鲤肝和鳃组织的影响[J].集美大学学报(自然科学版),2011,16(6):407-412.
[3] 雷质文,李伟才,贾俊涛,等.淡水藻毒素的研究现状[J].中国动物检疫,2004,21(11):46-49.
[4] NANAZATO T,YASUNO M.Population dynamics and production of cladoceran zooplankton in the highly eutrophic Lake Kasumigaura[J].Hydrobiologia,1985,124(1):13-22.
[5] TRABEAU M,BRUHN-KEUP R,MCDERMOTT C,et al.Midsummer decline of aDaphniapopulation attributed in part to cyanobacterial capsule production[J].J Plankt Res,2004,26(8):949-961.
[6] GULATI R D.Structural and grazing responses of zooplankton community to biomanipulation of some Dutch water bodies[J].Hydrobiologia,1990,200(1):99-118.
[7] CHRISTOFFERSEN K.Ecological implications of cyanobacterial toxins in aquatic food webs[J].Phycologia,1996,35(6S):42-50.
[8] 丁震,陈晓东,林萍.饮用水藻毒素对健康的影响与污染控制研究进展[J].中国公共卫生,2001,17(12):1149-1151.
[9] 李效宇,李磊.微囊藻毒素与人类健康关系研究进展[J].中国公共卫生,2008,24(8):1016-1017.
[10] 朱津永,陆开宏,潘洁慧.微囊藻水华对淡水浮游动物轮虫和枝角类影响的研究进展[J].中国水产科学,2008,15(2):367-375.
[11] 刘河川, 张伟, 余国忠,等.铜绿微囊藻对浮游动物生长繁殖的影响[J].信阳师范学院学报(自然科学版),2004,17(4):437-439.
[12] 张钰,谷孝鸿, 何俊.太湖长刺溞对浮游植物摄食的生态学研究[J].湖泊科学,2008,20(1):100-104.
[13] 胡菊香, 吴生桂, 陈金生,等.巢湖富营养化对轮虫的影响研究[J].环境科学与技术,2007,30(12):16-18.
[14] 杨州,孔繁翔,史小丽,等.萼花臂尾轮虫培养滤液对铜绿微囊藻、斜生栅藻和小球藻群体形成及生长的影响[J].应用生态学报,2005,16(6):1138-1141.
[15] 黄薇,王盛良,熊剑娟,等.饮用水中霉菌、酵母菌计数滤膜测定法[J].环境与健康杂志,1999,16(3):169.
[16] BURKERT U,HYENSTRAND P,DRAKARE S,et al.Effects of the mixotrophic flagellateOchromonassp.on colony formation inMicrocystisaeruginosa[J].Aqua Ecol,2001,35(1):11-17.
[17] 耿红.水体富营养化和蓝藻对轮虫影响的生态毒理学研究[D].武汉:中国科学院水生生物研究所,2006:65-83.
[18] FULTON R S,PAERL H W.Toxic and inhibitory effects of the blue-green algaMicrocystisaeruginosaon herbivorous zooplankton[J].J Plankt Res,1987,9(5):837-855.
[19] ROTHHAUPT K O.The influence of toxic and filamentous blue-green algae on feeding and population growth of the rotiferBrachionusrubens[J].Hydrobiology,1991,76(1):67-72.
Effects ofMicrocysisaeruginosaon the Population Growth ofBrachionusplicatilis
XIE Qin-ming1,2, LUO He-dong3, WE Shi1et al
(1.Fishery College of Jimei University, Xiamen, Fujian 361021;2.Engineering Research Center of the Modern Industry Technology for Eel,Ministry of Education, Xiamen, Fujian 361021;3.Department of Public Health Monitoring, Xiamen Center for Disease Control and Prevention, Xiamen, Fujian 361021)
[Objective] To discuss the effects ofMicrocystisaeruginosaon the population growth ofBrachionusplicatilis. [Method] The survival situations ofB.plicatilisunder the conditions of single food were observed.Then the effects of different concentrations ofM.aeruginosain mixed food on the population density ofB.plicatiliswere studied.[Result] Under the conditions of single food,B.plicatilispopulation could maintain sustainable increase withC.vulgarisorSaccharomyceteas single food.The population density ofB.plicatilisin group Ⅰ ofM.aeruginosacould be maintained for more than 6 days, butB.plicatilisin group Ⅱ ofM.aeruginosacould only survive for 4 days, and that in control group could survive for 7 days.In the culture under the conditions of mixed food, when the concentration ofM.aeruginosawas 1.0×104cells/mL, the density increase ofB.plicatilispopulation was not influenced in the first 3 days, but the density increase ofB.plicatilispopulation was inhibited.When the concentration ofM.aeruginosawas 1.0×106cells/mL,B.plicatilisdied on the sixth day.[Conclusion] The research results can provide reference basis for studying the effects ofM.aeruginosaon the ecology in future.
Microcystisaeruginosa;Brachionusplicatilis; Population; Growth
福建省自然科学基金项目(2013J01136);福建省科技厅区域发展项目(2016N3002);厦门市科技计划指导项目(ZD2011S0471);福建省教育厅项目(JA13176)。
谢钦铭(1965- ),男,江西高安人,副教授,博士,从事生态学研究。
2016-11-23
S 963.21+4
A
0517-6611(2016)35-0011-03

